Wnt/β-catenin信号通路在体外调控诱导性多能干细胞向神经干细胞分化中的作用及机制研究
2021-09-13周丽萍林德菊周斌杰姚盼盼余勤
周丽萍 林德菊 周斌杰 姚盼盼 余勤
浙江中医药大学生命科学学院 杭州 310053
诱导性多能干细胞(induced pluripotent stem cell,iPS)是一种类似胚胎干细胞(embryonic stem cell,ES)的多能性干细胞,具有多向分化、自我更新等优势,同时能够克服ES在临床应用时涉及的移植免疫排斥与伦理道德问题,现已成为再生医学的研究热点[1]。已有研究证实,iPS经过诱导可分化为多种神经细胞,如神经干细胞、神经元、星形胶质细胞和少突胶质细胞[2-4],是神经系统疾病细胞移植治疗的理想种子细胞。然而,目前其诱导分化机制仍不明确。
近年来,大量研究表明Wnt/β-catenin信号通路可调控神经发生和神经元分化[5-7],而β-连环蛋白(βcatenin)在该过程中起着关键作用[8-9]。因此,本研究以Wnt信号通路激活剂Wnt3a、抑制剂Dickkopf相关蛋白-1(Dickkopf-1,DKK-1)和IWR-1为干预因素,探讨Wnt/β-catenin信号通路在iPS向神经干细胞分化调控中的作用及相关机制。
1 材料和方法
1.1 材料
1.1.1 实验动物及细胞 妊娠13.5d的清洁级CF1小鼠,用于小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)的获取,购于上海市计划生育科学研究所实验动物经营部[实验动物生产许可证号:SCXK(沪)2018-0006],饲养于浙江中医药大学动物实验中心[实验动物使用许可证号:SYXK(浙)2018-0012]。小鼠iPS由本课题组前期研究建立[10]。
1.1.2 主要试剂 胎牛血清、N2添加剂、B27添加剂、放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解原液、神经基础培养基均购于美国Thermo Fisher公司(批号:1704207、1731337、1736741、89900、1749050);小鼠Wnt3a重组细胞因子、人DKK-1重组细胞因子均购于美国PeproTech公司(批号:96-315-20-10、96-120-30-10);小分子抑制剂IWR-1购于美国Selleck公司(批号:S7086);维甲酸(retinoic acid,RA) 购于美国Sigma公司(批号:R2625);β-微管蛋白Ⅲ(β-tubulin Ⅲ)、β-catenin抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)抗体、山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)H&L抗体均购于Abcam公司(批号:ab68193、ab32572、ab181602、ab150077);巢蛋白(Nestin)抗体购于Novus公司(批号:NBP1-02419);逆转录试剂盒、实时荧光定量聚合酶链式反应(Real-time quantitative polymerase chain reaction,Real-time qPCR)试剂盒均购于日本Takara公司(批号:RR047A、RR420A)。
1.1.3 主要仪器设备 TE2000-S型倒置相差荧光显微镜购于日本Nikon公司;3111型二氧化碳培养箱为美国Forma公司产品;3K-15型台式高速冷冻离心机购于美国Sigma公司;Tpersongal PCR仪购于德国Analytik Jena公司;StepOneTMReal-time PCR仪购于美国Applied Biosystems公司;Wes全自动蛋白表达分析系统为美国Protein Simple公司产品。
1.2 方法
1.2.1 体外诱导iPS向神经干细胞分化 iPS的饲养层细胞来源于MEF,操作方法参照本课题组前期研究[10]。饲养层细胞制备好后,复苏iPS,按一定比例接种培养。以0.25%的胰酶消化成单个细胞,更换用于拟胚体(embryoid body,EB)培养的培养基进行重悬,差速贴壁去除MEF后,将iPS接种到黏附度低的培养皿中进行悬浮培养,每2d换液。培养第6天时,在培养皿中添加工作浓度为1μmol·L-1的RA,进行诱导培养。第9天更换为N2B27诱导培养基培养3d,最后采用神经分化诱导培养基继续培养。见图1。

图1 体外诱导iPS向神经干细胞分化Fig.1 Differentiation of iPS into neural stem cells in vitro
1.2.2 免疫荧光法检测Nestin和β-tubulinⅢ的表达 诱导iPS向神经干细胞分化第12天,吸除培养基,加入4%多聚甲醛固定10min。磷酸缓冲盐溶液(phosphate buffer saline,PBS)漂洗后加入1mL含0.5% Triton X-100的封闭液,室温封闭40min。吸除封闭液,加入以封闭液配置的相应一抗,4℃孵育过夜。吸除一抗,PBS摇洗3遍后加入二抗,室温避光孵育1h。4,6-联脒-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)染色5min,PBS清洗后,以倒置相差荧光显微镜观察蛋白表达情况。
1.2.3 实验分组 诱导分化第6天,在加入RA诱导之前,将细胞随机分成正常组、Wnt3a组、DKK-1组和IWR-1组共4组,各组用相应的试剂进行处理,Wnt3a工作浓度为10μg·L-1,DKK-1为50μg·L-1,IWR-1为10μmol·L-1,正常组予以等量的PBS,处理至诱导分化第12天,进行后续检测。
1.2.4 Real-time qPCR检测Nestin、β-tubulin Ⅲ及β-catenin基因表达 收集各组细胞,依据Trizol操作说明,提取总RNA。根据试剂盒说明书进行逆转录反应,合成cDNA,再进行目的基因的扩增。反应条件为:95℃预变性30s,95℃变性30s、60℃退火30s、72℃延伸30s,共40个循环。使用StepOne Software v2.2.2软件分析实验数据,各个样本中的每种基因表达水平均以内参基因β-actin的表达量作为标准,利用相对定量法中的2-ΔΔCt法进行归一化分析。所有引物由生工生物工程(上海)有限公司合成。见表1。

表1 引物序列Tab.1 Primer sequences
1.2.5 Western blot检测Nestin、β-tubulin Ⅲ及βcatenin蛋白表达 收集各组细胞,加入含有蛋白酶抑制剂的RIPA裂解液裂解细胞。采用二喹啉甲酸(bicinchoninic acid,BCA)法检测总蛋白的浓度,每孔上样量为4μg,上机检测。 Western blot采用Wes全自动蛋白表达分析系统完成,操作步骤依据ProteinSimple公司Wes检测试剂盒(12-230kDa)说明完成。采用Compass for SW(3.3.9-0908.1603)软件分析实验结果,以GAPDH作为内参,进行归一化分析,以得到蛋白相对表达定量结果。
1.2.6 iPS分化来源神经干细胞的增殖情况 检测iPS来源神经干细胞以0.25%胰酶消化成单个细胞,800r/min离心5min,以N2B27培养基重悬,进行悬浮培养,倒置相差荧光显微镜下观察其生长情况。
1.3 统计学分析 应用SPSS 19.0统计软件进行统计学分析。计量资料以±s表示,常规进行方差齐性检验,多组间比较采用单因素方差分析,进一步比较采用最小显著差法(least significant difference,LSD)检验。以P<0.05为差异有统计学意义。
2 结果
2.1 iPS向神经干细胞分化结果 iPS在饲养层细胞上呈岛屿状分布,边缘清晰平滑,表面光滑,结构致密。悬浮培养后,单个细胞增殖为细胞团,逐渐形成具有囊腔的EB;RA诱导后,EB迅速变大;更换为N2B27培养基诱导培养后,边缘可见少量有突起的神经元样细胞;在神经诱导分化培养后,逐渐分化为神经元样细胞。见图2。免疫荧光检测显示,神经干细胞的特异性标志物Nestin表达阳性,并且早期神经元特异性标志物β-tubulinⅢ的表达亦为阳性。见图3。由此提示,采用N2B27培养基联合RA诱导法,可诱导iPS向神经干细胞分化,并且得到的神经干细胞趋向于神经元分化。

图2 诱导iPS向神经干细胞分化过程中细胞形态变化(100×)Fig.2 Cell morphology changes during the differentiation of iPS into neural stem cells(100×)

图3 iPS分化来源神经干细胞表面标志物表达情况(100×)Fig.3 Expression of surface markers on iPS-derived neural stem cells(100×)
2.2 iPS神经分化过程中Nestin、β-tubulinⅢ及βcatenin表达 Real-time qPCR结果提示,iPS向神经干细胞分化第12天,神经干细胞特异性标志物Nestin的mRNA表达较第0天和第6天均显著升高(P<0.05,P<0.05);早期神经元特异性标志物β-tubulinⅢ的mRNA表达在第12天较第0天显著升高(P<0.05);Wnt/βcatenin信号通路关键因子β-catenin的mRNA表达在第12天较第6天显著降低(P<0.05)。 见图4。 Western blot结果提示,Nestin的蛋白表达在第6天较第0天升高(P<0.05),第12天较第0天和第6天均显著升高(P<0.01,P<0.01);β-tubulin Ⅲ的蛋白表达在第12天较第0天 和 第6天 均 显 著 升 高 (P<0.01,P<0.01);βcatenin的蛋白表达在第12天较第0天和第6天均显著降低(P<0.01,P<0.01)。 见图5。由此可见,在小鼠iPS向神经干细胞诱导分化过程中,Wnt/β-catenin信号通路受到抑制。
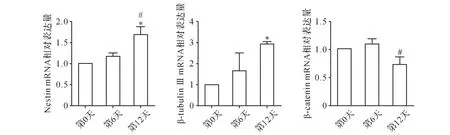
图4 iPS神经分化过程中Nestin、β-tubulinⅢ及β-catenin的mRNA表达Fig.4 The mRNA expression of Nestin, β-tubulin Ⅲ and β-catenin during neural differentiation of iPS
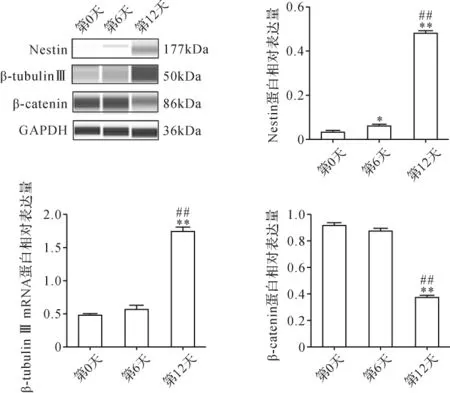
图5 iPS神经分化过程中Nestin、β-tubulinⅢ及β-catenin的蛋白表达Fig.5 The protein expression of Nestin, β-tubulin Ⅲ and β-catenin during neural differentiation of iPS
2.3 各组iPS来源神经干细胞增殖能力比较 iPS来源的神经干细胞增殖能力检测提示,与正常组比较,Wnt3a组的类神经球较小,DKK-1组和IWR-1组的类神经球较大,其中IWR-1组最大,而DKK-1组的类神经球较多。见图6。由此可见,采用Wnt3a处理,上调Wnt/β-catenin信号通路得到的神经干细胞增殖能力较弱;而采用DKK-1和IWR-1处理,下调Wnt/βcatenin信号通路得到的神经干细胞增殖能力较强。
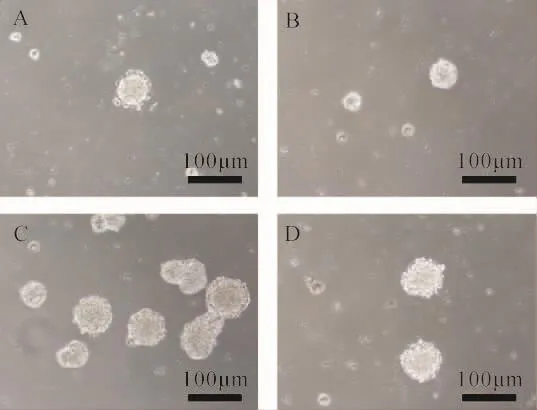
图6 iPS来源神经干细胞增殖能力(100×)Fig.6 Proliferation ability of iPS-derived neural stem cells(100×)
2.4 各组iPS来源神经干细胞分化标志物表达比较Real-time qPCR检测提示,与正常组比较,Wnt3a组Nestin、β-catenin的mRNA表达差异无统计学意义(P>0.05,P>0.05);DKK-1和IWR-1组Nestin的mRNA表达显著升高(P<0.01,P<0.01),β-catenin的mRNA表达显著降低(P<0.05,P<0.05)。 见图7。 Western blot结果提示,与正常组比较,Wnt3a组Nestin的蛋白表达显著降低(P<0.01),β-catenin的蛋白表达略升高,但差异无统计学意义(P>0.05);DKK-1和IWR-1组Nestin的蛋白表达显著升高(P<0.01,P<0.01)、β-catenin的蛋白表达显著降低(P<0.01,P<0.01)。见图8。由此可见,采用DKK-1和IWR-1下调Wnt/β-catenin信号通路可促进iPS向神经干细胞分化。
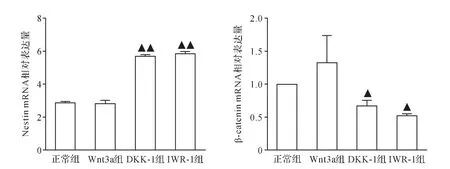
图7 各组iPS来源神经干细胞Nestin及β-catenin mRNA表达比较Fig.7 Comparison of mRNA expression of Nestin and β-catenin in each group of iPS-derived neural stem cells
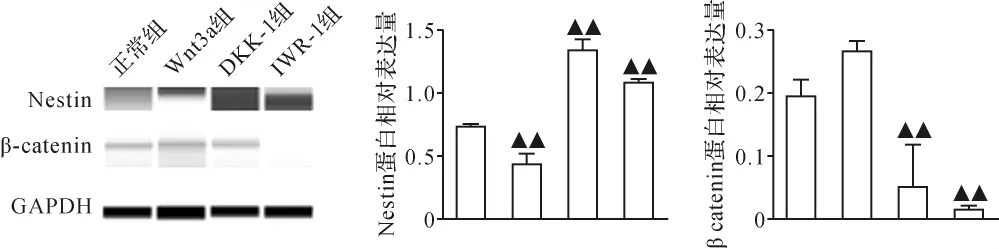
图8 各组iPS来源神经干细胞Nestin及β-catenin蛋白表达比较Fig.8 Comparison of protein expression of Nestin and β-catenin in each group of iPS-derived neural stem cells
3 讨论
iPS已用于多种神经退行性疾病的治疗研究,特别是阿尔兹海默病和帕金森病等一些全世界公认的疑难病症的研究,为神经退行性疾病的治疗带来了新的希望。本研究采用神经诱导培养基N2B27联合RA进行分步程序诱导,获得的细胞表达神经干细胞标志物Nestin,同时还表达了早期神经元的特异性标志物β-tubulinⅢ,提示成功地将小鼠iPS定向诱导分化为神经干细胞。
近年来,科学家们致力于探讨iPS向神经干细胞分化的机制,寻找提高分化效率与功能的靶点与方法[11]。研究显示,Wnt信号通路在干细胞的神经分化过程中发挥重要作用[12-13],如Slawny等[14]发现,Wnt/βcatenin信号通路参与了调控ES向神经细胞分化。Wnt/β-catenin信号通路是影响细胞生物学行为的重要信号通路之一,其中胞质内效应分子β-catenin是关键因子,该通路的信号传递取决于胞质中游离β-catenin的水平[8-9]。本研究提示,iPS诱导分化过程中β-catenin的表达水平均显著降低,说明在分化过程中Wnt/βcatenin信号通路受到抑制。
本研究进一步探讨了Wnt/β-catenin信号通路在iPS向神经干细胞分化中的作用。Wnt3a是外源的Wnt重组蛋白,可以和细胞膜表面的Wnt受体结合,启动Wnt信号通路。本研究发现Wnt3a处理后,β-catenin表达差异无统计学意义,可能与其能同时激活经典和非经典的Wnt信号通路有关[8];同时,结果显示Wnt3a处理后,Nestin mRNA表达无明显变化,而蛋白表达降低,蛋白和mRNA表达并不完全一致,可能是由于基因表达的转录和翻译发生的时间和位点存在差异,而且存在转录后加工及翻译后修饰等多方面原因,具体机制需进一步探讨。DKK-1是一种分泌型的Wnt配体拮抗剂[15],它可以与Wnt受体之一的单跨膜受体低密度脂蛋白相关蛋白5/6(low density lipoprotein-related proteins 5/6,LRP5/6)结合,从而竞争性抑制Wnt/βcatenin信号通路。Ren等[16]研究报道,DKK-1在胚胎发育、神经再生、突触发生等方面都起着重要作用。本研究发现在iPS向神经干细胞分化过程中,DKK-1处理后β-catenin表达降低,Nestin表达增加。IWR-1可以增强β-catenin降解复合体中的Axin的稳定性,从而起到促进β-catenin降解的作用[17]。与DKK-1作用类似,本研究中IWR-1处理后,β-catenin表达降低,Nestin表达增加。相关报道显示,激活Wnt信号通路会诱导多能干细胞分化为中胚层和内胚层的细胞[18]。例如Woll等[19]研究发现,激活Wnt/β-catenin信号通路可以促进人的多能干细胞分化为早期的造血祖细胞;Nakashima等[20]发现Wnt/β-catenin信号通路激活可促进小鼠ES和人iPS分化为胰腺β细胞,而降低向神经细胞分化的概率。Raitano等[21]对痴呆症患者来源的iPS进行神经分化诱导,发现Wnt/β-catenin信号通路异常激活,而加入Wnt/β-catenin信号通路抑制剂I-WP2抑制β-catenin的表达后,神经分化有所恢复。由此说明,本研究中DKK-1和IWR-1抑制了Wnt/βcatenin信号通路,从而促进了iPS向神经干细胞分化。
综上所述,本研究采用N2B27培养基联合RA诱导法,成功诱导了小鼠iPS向神经干细胞分化,并证明Wnt/β-catenin信号通路在小鼠iPS向神经干细胞诱导分化过程中受抑制;采用DKK-1和IWR-1下调Wnt/β-catenin信号通路,可促进iPS向神经干细胞分化,提高iPS来源神经干细胞的增殖能力,提示Wnt/βcatenin信号通路在小鼠iPS神经干细胞分化过程中具有负调控的作用。
