苓桂术甘汤对慢性心律失常大鼠心肌损伤的保护作用及对Nrf2/HO-1通路的影响
2021-09-13李晓玲汪砚雨徐梅赵子明
李晓玲 汪砚雨 徐梅 赵子明
1.河南科技大学第一附属医院 河南,洛阳 471003 2.三门峡市中心医院 3.郑州市第七人民医院
心律失常是最常见的诱发心源性猝死的病因之一,其发病率在近数十年来呈持续上升的趋势,且发病年龄日趋年轻化[1-2]。迄今为止,心律失常的治疗仍以酒石酸美托洛尔等西药治疗为基础,尽管引入了射频消融术,但对于心律失常患者心肌损伤的改善效果仍不尽如人意。据研究报道,心肌细胞凋亡与氧化应激相关,核因子E2相关因子2(nuclear factor E2 related factor2,Nrf2)被证实为细胞内氧化应激调节的重要转录因子,生理状态下Nrf2被胞质蛋白伴侣分子kelch样ECH关联蛋白1(Kelch-like ECH-associated protein 1,Keap1)锚定于细胞质,一旦发生氧化应激反应,Keap1-Nrf2/抗氧化反应元件(antioxidant response element,ARE) 抗氧化系统被激活,Keap1与Nrf2分离,Nrf2进入细胞核,结合ARE,启动以血红素氧合酶-1(heme oxygenase-1,HO-1)为代表的抗氧化酶的基因转录,进而发挥抗氧化作用[3]。苓桂术甘汤是《伤寒杂病论》中经典方剂,治疗慢性心律失常疗效确切[4],但具体作用机制尚不明确。本研究以慢性心律失常大鼠模型为对象,观察苓桂术甘汤对大鼠心肌损伤以及氧化应激防御能力的影响,分析其保护慢性心律失常大鼠心肌组织的可能机制。
1 材料和方法
1.1 材料
1.1.1 实验动物 雄性无特定病原体(specific pathogen free,SPF) 级SD大鼠45只,7周龄, 体质量260~280g,购于上海斯莱克实验动物有限公司[实验动物生产许可证号码:SCXK(沪)2017-0005]。实验开展前适应性饲养1周,饲养于河南中医药大学动物实验中心[实验动物使用许可证号码:SYXK(豫)2020-0004],根据动物福利委员会要求饲养,即在(23±1)℃恒温、SPF级环境中饲养,自然通风,人工照明,明暗各12h,自由进食饮水。
1.1.2 药物、主要试剂和仪器 苓桂术甘汤由茯苓、桂枝、白术、甘草组成,比例为4:3:3:2,所有药材购于河北省承德市中药材公司,品系鉴定符合中药药用标准。常规方法煎熬3次,混合3次滤液后,60℃水浴浓缩,制为内含生药2g·mL-1的药液,于4℃冰箱内保存。苓桂术甘汤的具体给药剂量根据“人和动物体表面积折算的等效剂量比率表”换算,动物与人每kg体重剂量折算系数是6.25,成人日总剂量为25g·kg-1,折算大鼠日用药剂量为4g·kg-1。酒石酸美托洛尔(规格:25mg×20片)购于阿斯利康制药有限公司(批准文号:国药准字H32025391);二喹啉甲酸(bicinchoninic acid,BCA)试剂盒购于中国碧云天生物公司(批号:20191106);血清谷胱甘肽(glutathione,GSH)、谷胱甘肽硫基转移酶(glutathione S-transferase,GST)酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)试剂盒均购于南京建成生物工程研究所(批号 :20190913、20190922);DNA 缺 口 末 端 标 记 法(TdT-mediated dUTP nick-end labeling,TUNEL)染色试剂盒购于北京博奥森生物科技有限公司(批号:20191213);兔抗大鼠β-actin、Nrf2、HO-1单克隆抗体(一抗)以及辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔IgG二抗均购于北京百奥莱博科技有限公司(批号:20190815、20190712、20190206、20190528)。DB-3型心电图机为上海广电医用电子仪器有限公司产品;TGL-16M台式高速冷冻离心机、LW300-28LT型生物显微镜均购于西安禾普生物科技有限公司;UVCI-01型机载凝胶成像仪购于美国Bio-Rad公司;EG1150H型包埋机为德国徕卡微系统有限公司产品。
1.2 方法
1.2.1 造模、分组与干预 从45只大鼠中随机选取10只作为正常对照组,其余35只大鼠尾静脉注射氯化钡溶液,以制备慢性心律失常大鼠模型[5]。造模方法:称量大鼠体质量,按照体质量腹腔注射2%戊巴比妥钠1mL/400g,充分麻醉后将大鼠俯卧位固定在动物手术台上,在四肢内侧皮下置入针状电极,连接DB-3型心电图机,基线调零,描记Ⅱ导联心电图。待大鼠心电图正常平稳后,对其尾部充分消毒,于尾静脉5s内注射0.4%氯化钡溶液4mg·kg-1,快速记录心电图,共记录0.5h。正常对照组大鼠的麻醉、固定操作同上,尾静脉注射等体积0.9%氯化钠溶液。造模成功标准:大鼠心电图出现典型慢性心律失常表现,表示造模成功[5]。
共30只大鼠造模成功,将造模成功大鼠随机分为苓桂术甘汤组、阳性对照组和模型对照组,每组各10只。造模成功后当天,苓桂术甘汤组予苓桂术甘汤生药4g/(kg·d)灌胃,阳性对照组予酒石酸美托洛尔20mg/(kg·d)灌胃,模型对照组、正常对照组予以等体积0.9%氯化钠注射液灌胃。灌胃体积均为10mL·kg-1,早晚各1次,每次持续1min,共4周。
1.2.2 取材 灌胃第4周末,各组大鼠腹腔注射2%戊巴比妥钠1mL/400g麻醉,开胸后完整分离心脏,以预冷0.9%氯化钠注射液冲洗,滤纸吸干。一部分心肌组织以10%甲醛溶液固定,石蜡包埋,4μm切片,苏木精-伊红(hematoxylin-eosin,HE)染色后观察心肌组织的病理改变;一部分液氮冷冻,备行实时荧光定量聚合酶链式反应(Real-time fluorescence quantitative polymerase chain reaction,Real-time qPCR)和Western blot检测。
1.2.3 血清GSH、GST含量检测 取材过程同1.2.2,经心脏取血2mL,静置后3 000r/min离心10min,离心半径10cm,分离血清,采用ELISA检测血清GSH、GST含量。操作严格按照试剂盒说明书进行,酶标仪检测450nm波长吸光度,并以标准品吸光度为横坐标,标准品含量为纵坐标,绘制标准曲线,得到直线回归方程,将样品吸光度带入方程,计算出样品含量。
1.2.4 心肌组织病理变化的HE染色观察 取1.2.2制作的心肌组织切片,脱蜡、水化后,苏木素染色5min,自来水冲洗1min,梯度乙醇分化15s,自来水冲洗0.5h,0.5%伊红染色1min,蒸馏水冲洗30s,脱水、透明,中性树胶封片,400倍光镜下观察心肌组织的病理形态学变化。
1.2.5 心肌细胞凋亡检测 按TUNEL染色试剂盒说明书进行操作,各组石蜡切片常规入水脱蜡,蒸馏水洗涤切片,37℃加入以Tris缓冲盐溶液1:100新鲜稀释的蛋白酶K,孵育10min后,蒸馏水洗涤,37℃加入末端脱氧核糖核酸转移酶(terminal deoxynucleotidyl transferase,TdT)、异羟基洋地 黄毒苷(digoxigenin,Dig)配基-脱氧尿嘧啶核苷三磷酸(deoxyuridine triphosphate,dUTP)标记的缓冲液20μL,孵育2h后以Tris缓冲盐溶液洗涤,室温加入封闭液50μL,0.5h后甩干,37℃加入封闭液1:100稀释的生物素标记抗Dig抗体50μL,孵育0.5h后以Tris缓冲盐溶液洗涤,37℃加入Tris缓冲盐溶液1:100稀释的链酶亲合素-生物素-过氧化物酶复合物,孵育0.5h后以Tris缓冲盐溶液洗涤,二氨基联苯胺(3,3’-diaminobenzidine,DAB) 显色20min,蒸馏水洗涤,苏木素复染,Tris缓冲盐溶液洗涤,脱水,透明、封片,400倍光镜下观察大鼠心肌细胞凋亡情况。凋亡阳性细胞的细胞核呈黄染,每张切片随机抽选10个视野,计数细胞总数和凋亡阳性细胞数,计算心肌细胞凋亡率,心肌细胞凋亡率(%)=(阳性细胞数/细胞总数)×100%。
1.2.6 心肌组织中Nrf2、HO-1基因表达检测 取心肌组织,按Trizol试剂盒说明书提取总RNA,经紫外分光光度计检测RNA浓度,电泳观察RNA完整性。采用反转录试剂盒合成cDNA,进行PCR扩增,扩增所用引物由上海生工生物工程公司合成,序列见表1。PCR扩增 体 系 共25μL, 包 括SYBR Green Mix 12.5μL、ddH2O 9.5μL、 上下游引物各0.5μL、cDNA模板2μL。反 应 条 件 :95℃ 10min,95℃ 10s,60℃ 1min,95℃15s,60℃ 15s,共40个循环。采集目的基因及内参基因3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)各个循环扩增的荧光信号引物,反应结束后确认扩增曲线与熔解曲线,制作标准曲线,采取2-△△Ct计算目的基因相对表达量。

表1 引物序列Tab.1 Primer sequences
1.2.7 心肌组织中Nrf2、HO-1蛋白表达检测 提取心肌组织总蛋白,加入500μL细胞裂解液,BCA法测定蛋白总量,蛋白与上样缓冲液混匀后,沸水浴变性,冷却后行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,湿法电转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,5%脱脂奶粉室温封闭1.5h,加入兔抗大鼠Nrf2、HO-1、β-actin一抗(稀释比例1∶1 000),4℃摇床过夜,洗膜后加入HRP标记的山羊抗兔IgG二抗(稀释比例1∶8 000),室温孵育1h,增强化学发光法检验,PVDF膜与化学发光底物孵育后,胶片曝光显影。采用凝胶成像仪机载Labworks软件分析,以目的蛋白与内参蛋白β-actin灰度值的比值计算目的蛋白的相对表达量。
1.3 统计学分析 应用SPSS 19.0统计软件进行统计学分析,计量资料以±s表示,多样本计量资料比较采用单因素方差分析,两样本比较采用Fisher最小显著性差异(least significant difference,LSD)-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 造模大鼠心电图观察 35只造模大鼠中30只造模成功,苓桂术甘汤组、阳性对照组、模型对照组各10只,均出现心律失常的典型心电图表现,即ST段T波改变、异常Q波,造模成功率85.71%。见图1。
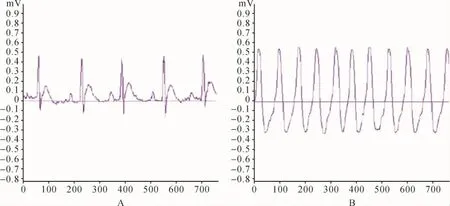
图1 造模大鼠心电图表现Fig.1 Electrocardiogram of model rats
2.2 各组大鼠GSH和GST含量比较 各组间总体比较,GSH和GST含量差异有统计学意义(P<0.001)。与正常对照组比较,模型对照组、阳性对照组、苓桂术甘汤组大鼠的GSH和GST含量较低(P<0.05);与模型对照组比较,阳性对照组、苓桂术甘汤组大鼠的GSH和GST含量较高(P<0.05);与阳性对照组比较,苓桂术甘汤组大鼠的GSH和GST含量较低(P<0.05)。见表2。
表2 各组大鼠的GSH、GST含量比较(±s)Tab.2 Comparison of GSH and GST contents of rats in each group(±s)

表2 各组大鼠的GSH、GST含量比较(±s)Tab.2 Comparison of GSH and GST contents of rats in each group(±s)
注:与正常对照组比较,*P<0.05;与模型对照组比较,△P<0.05;与阳性对照组比较,#P<0.05Note:Compared with normal control group, *P<0.05;compared with model control group, △P<0.05;compared with positive control group,#P<0.05
组别 n GSH(mg·gprot-1) GST(U·mgprot-1)正常对照组 10 1.09±0.21 94.39±5.58模型对照组 10 0.56±0.13* 82.17±3.28*阳性对照组 10 0.91±0.15*△ 92.67±4.46*△苓桂术甘汤组 10 0.76±0.16*△# 88.11±4.69*△#F值 18.552 14.245 P值 <0.001 <0.001
2.3 各组大鼠心肌组织病理变化 HE染色提示,正常对照组大鼠心肌组织肌束清晰、排列规则,无水肿、充血;模型对照组大鼠心肌组织水肿、充血严重,肌束紊乱明显,心肌细胞间隙增宽;与模型对照组比较,阳性对照组、苓桂术甘汤组心肌组织轻度水肿、充血,肌束有轻微模糊、紊乱情况,心肌细胞间隙缩小。见图2。
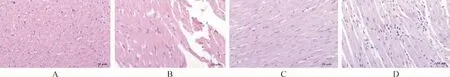
图2 各组大鼠心肌组织病理变化(HE染色,400×)Fig.2 Pathological changes of myocardial tissue in each group(HE staining, 400×)
2.4 各组大鼠心肌细胞凋亡率比较 显微镜下正常心肌细胞核为蓝色,凋亡细胞核为棕褐色,正常对照组心肌极少见凋亡细胞,模型对照组凋亡细胞增多且分布密集;与模型对照组比较,阳性对照组、苓桂术甘汤组凋亡细胞减少。见图3。各组间总体比较,心肌细胞凋亡率差异有统计学意义(P<0.001)。与正常对照组比较,模型对照组、阳性对照组、苓桂术甘汤组大鼠的心肌细胞凋亡率较高 (P<0.05);与模型对照组比较,阳性对照组、苓桂术甘汤组大鼠的心肌细胞凋亡率较低(P<0.05);与阳性对照组比较,苓桂术甘汤组大鼠的心肌细胞凋亡率较高(P<0.05)。见表3。
表3 各组大鼠心肌细胞凋亡率比较(±s,%)Tab.3 Comparison of apoptosis rate of Cardiomyocytes in each group(±s,%)

表3 各组大鼠心肌细胞凋亡率比较(±s,%)Tab.3 Comparison of apoptosis rate of Cardiomyocytes in each group(±s,%)
注:与正常对照组比较,*P<0.05;与模型对照组比较,△P<0.05;与阳性对照组比较,#P<0.05Note:Compared with normal control group, *P<0.05;compared with model control group, △P<0.05;compared with positive control group,#P<0.05
细胞凋亡率正常对照组 10 6.31±0.29模型对照组 10 15.36±0.72*阳性对照组 10 12.64±0.59*△苓桂术甘汤组 10 13.71±0.62*△#F值 469.406 P值 <0.001组别n

图3 各组大鼠心肌细胞凋亡情况(TUNEL染色,400×)Fig.3 Cardiomyocytes apoptosis in each group(TUNEL staining, 400×)
2.5 各组大鼠Nrf2、HO-1基因表达比较 各组间总体比较,心肌细胞Nrf2、HO-1 mRNA表达差异有统计学意义(P<0.001)。与正常对照组比较,模型对照组、阳性对照组、苓桂术甘汤组大鼠的Nrf2、HO-1 mRNA相对表达量均较高(P<0.05);与模型对照组比较,阳性对照组、苓桂术甘汤组大鼠Nrf2、HO-1 mRNA相对表达量均较高(P<0.05);与阳性对照组比较,苓桂术甘汤组大鼠Nrf2、HO-1 mRNA相对表达量均较低(P<0.05)。见表4。
表4 各组大鼠Nrf2、HO-1 mRNA表达比较(±s)Tab.4 Comparison of expressions of Nrf2 and HO-1 mRNA in each group(±s)
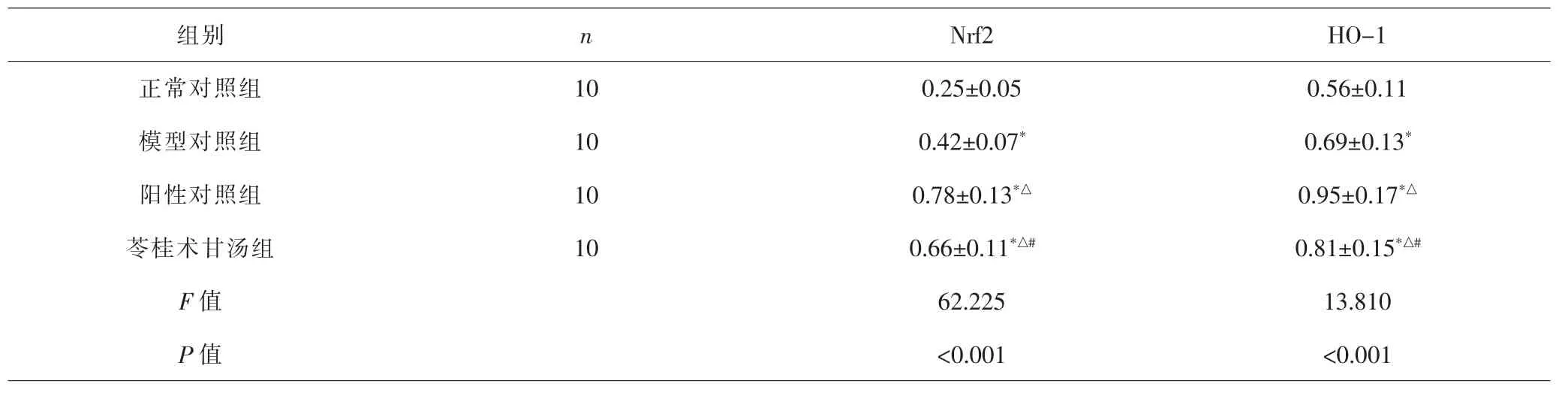
表4 各组大鼠Nrf2、HO-1 mRNA表达比较(±s)Tab.4 Comparison of expressions of Nrf2 and HO-1 mRNA in each group(±s)
注:与正常对照组比较,*P<0.05;与模型对照组比较,△P<0.05;与阳性对照组比较,#P<0.05Note:Compared with normal control group, *P<0.05;compared with model control group, △P<0.05;compared with positive control group,#P<0.05
组别 n Nrf2 HO-1正常对照组 10 0.25±0.05 0.56±0.11模型对照组 10 0.42±0.07* 0.69±0.13*阳性对照组 10 0.78±0.13*△ 0.95±0.17*△苓桂术甘汤组 10 0.66±0.11*△# 0.81±0.15*△#F值 62.225 13.810 P值 <0.001 <0.001
2.6 各组大鼠Nrf2、HO-1蛋白表达比较 各组间总体比较,心肌细胞Nrf2、HO-1蛋白表达差异有统计学意义(P<0.001)。与正常对照组比较,模型对照组、阳性对照组、苓桂术甘汤组大鼠的Nrf2、HO-1蛋白相对表达量均较高(P<0.05);与模型对照组比较,阳性对照组、苓桂术甘汤组大鼠Nrf2、HO-1蛋白相对表达量均较高(P<0.05);与阳性对照组比较,苓桂术甘汤组大鼠Nrf2、HO-1蛋白相对表达量均较低(P<0.05)。 见表5、图4。

图4 Western blot检测各组大鼠Nrf2、HO-1蛋白表达Fig.4 Nrf2 and HO-1 protein expressions in each group detected with Western blot
表5 各组大鼠Nrf2、HO-1蛋白表达比较(±s)Tab.5 Comparison of expressions of Nrf2 and HO-1 protein in each group(±s)

表5 各组大鼠Nrf2、HO-1蛋白表达比较(±s)Tab.5 Comparison of expressions of Nrf2 and HO-1 protein in each group(±s)
注:与正常对照组比较,*P<0.05;与模型对照组比较,△P<0.05;与阳性对照组比较,#P<0.05Note:Compared with normal control group, *P<0.05;compared with model control group, △P<0.05;compared with positive control group,#P<0.05
组别 n Nrf2 HO-1正常对照组 10 0.17±0.02 0.51±0.05模型对照组 10 0.25±0.04* 0.62±0.09*阳性对照组 10 0.59±0.08*△ 0.89±0.09*△苓桂术甘汤组 10 0.41±0.06*△# 0.75±0.08*△#F值 115.000 42.961 P值 <0.001 <0.001
3 讨论
心律失常为诸多心脏疾病的症状表现,是导致患者死亡的主要病因,因而应对慢性心律失常予以高度重视[6]。慢性心律失常的发病机制可能为窦房结激动异常、传导速度减慢,或传导阻滞而导致心脏搏动频率紊乱,以胸闷、失眠、心悸为主要临床表现,严重时可导致晕厥或猝死[7-8]。现阶段临床上治疗慢性心律失常以阿托品等常规药物为主,但不良反应明显等问题,且高龄患者的药物代谢能力和对药物的反应能力均下降,故探索其他更安全、高效的治疗方法十分必要。从中医学角度而言,慢性心律失常是因患者脏腑内气血阴阳虚损,气滞血瘀,引起心脉失畅、心失所养而致病。经中医学者研究发现,苓桂术甘汤作为治疗心胸满闷、气上冲胸、气短等症的温阳益气之祖方,用于心血管疾病的治疗效果良好[9],但对慢性心律失常的作用及其具体作用机制的研究少见,亟待深入分析。
研究表明,慢性心律失常导致心肌损伤的过程实质上是氧自由基产生、心肌细胞凋亡的病理生理过程,GSH作为低分子清除剂,可在细胞代谢过程中发挥清除氧自由基、抗氧化应激等功能,是细胞抵抗氧化应激损伤的关键组成部分[10]。GST在机体各组织器官中广泛存在,可催化外源有害物质和还原型谷胱甘肽巯基发生偶联,将有害物质代谢分解后排出体外,发挥解毒和清除过氧化物的双重功能。本研究结果显示,慢性心律失常大鼠体内衡量抗氧化防御能力的GSH、GST含量明显降低,提示慢性心律失常大鼠抗氧化防御体系受损,抗氧化应激损伤能力下降,通过酒石酸美托洛尔、苓桂术甘汤治疗可有效恢复大鼠抗氧化能力,从而减轻心肌组织损伤。据报道,个体长期处于心律失常状态下,氧自由基的产生与清除平衡失调,容易造成氧自由基蓄积,可直接损伤心肌细胞,致使其坏死、凋亡,加重心律失常病情[11]。本研究发现,与正常对照组比较,模型对照组心肌细胞凋亡率明显升高,而阳性对照组、苓桂术甘汤组则有所下降,苓桂术甘汤组心肌细胞凋亡率虽稍高于阳性对照组,但仍然低于模型对照组,差异有统计学意义,提示苓桂术甘汤在挽救慢性心律失常大鼠心肌细胞凋亡方面有一定价值。苓桂术甘汤方中茯苓补益心脾、宁心安神,桂枝振心阳、止悸动、通血脉,白术补气养神,甘草补中益气、通阳化气。现代药理学研究表明,桂枝有效成分可减少儿茶酚胺分泌,保护心脏[12];甘草可降低心脏异位起搏点兴奋性,调节心脏传导功能[13];茯苓、白术亦有调节心律作用,共奏平复心律、安神定悸之效[14-15]。同时,HE染色观察大鼠心肌组织病理形态发现,与正常对照组比较,模型对照组心肌充血严重、肌束紊乱,而与模型对照组比较,阳性对照组、苓桂术甘汤组心肌组织血红蛋白逸出、细胞核堆积等异常情况比较轻微,进一步提示苓桂术甘汤对慢性心律失常大鼠心肌损伤有一定保护作用。
Nrf2为Keap1-Nrf2/ARE抗氧化系统中的重要蛋白,Keap1-Nrf2/ARE抗氧化系统是细胞抗氧化防御机制中的关键通路,Nrf2通路负责调节HO-1等抗氧化酶基因表达,发挥其保护效应。Keap1是Nrf2特异性受体,氧化应激状态下,Keap1和Nrf2解离,Nrf2与ARE结合,启动ARE调控的第Ⅱ相抗氧化酶基因表达,增强细胞对氧化应激的拮抗能力。ARE所调控的抗氧化酶基因主要包括HO-1和GST等。HO-1属于氧化应激蛋白,是调节抗氧化应激反应的主要转录因子之一,可催化血红素生成胆绿素、铁离子、一氧化碳,在氧化性心肌损伤中发挥保护效应,同时与其酶解产物胆红素共同发挥抗氧化应激、抑制细胞凋亡等作用,还可降低组织对氧化应激损伤的敏感程度。Nrf2为其主要上游调控基因,正常生理状态下的HO-1表达较低,在氧化应激条件下可通过Nrf2通路启动HO-1表达,表现出抗氧化作用[16]。本研究发现,与正常对照组比较,模型对照组大鼠心肌组织中Nrf2、HO-1蛋白表达上调,提示慢性心律失常可诱发心肌细胞氧化应激,激活Nrf2基因并增强Nrf2蛋白表达,从而进一步诱导下游HO-1蛋白表达增强;与模型对照组比较,阳性对照组、苓桂术甘汤组Nrf2、HO-1 mRNA及蛋白相对表达量较高。结合本研究结果,推测苓桂术甘汤治疗慢性心律失常的主要机制可能是促进细胞Nrf2信号通路活化,诱导抗氧化酶类如HO-1表达进一步增强,从而抵抗氧化应激损伤,保护机体免受毒性物质侵害,抑制心肌细胞凋亡。本研究以临床常用药物酒石酸美托洛尔作为阳性对照,结果提示苓桂术甘汤治疗慢性心律失常的效果弱于酒石酸美托洛尔,但结合临床实践,与西药比较,中药不良反应更少,安全性较高,因此笔者认为苓桂术甘汤可以作为慢性心律失常的一种治疗选择。
综上所述,苓桂术甘汤可抑制慢性心律失常大鼠心肌细胞凋亡,减轻氧化应激损伤,其机制可能与激活Nrf2/HO-1通路有关。中药复方的药效与方中药物的药理活性有关,苓桂术甘汤阻止慢性心律失常大鼠心肌细胞凋亡的药理学效应可能涉及多方面机制,是药物多靶点、微效应的综合表现,Nrf2/HO-1信号通路或许是关键环节之一。但本研究仍存在诸多不足,如观察指标较少等,未来应从多角度进行研究,并分析其他可能存在的作用机制,为苓桂术甘汤治疗慢性心律失常的可行性提供更多依据。
