原发干燥综合征合并双原发肺癌及胸腺囊肿一例并文献回顾
2021-09-13熊鑫崔健刘领薛兵北京市垂杨柳医院呼吸内科000北京市垂杨柳医院胸外科000
熊鑫 崔健 刘领 薛兵北京市垂杨柳医院呼吸内科 000;北京市垂杨柳医院胸外科 000
干燥综合征(Sjogren syndrome,SS)属于慢性自身免疫性疾病,主要侵犯唾液腺和泪腺为主的外分泌腺体,表现为口干、眼干、疯狂龋齿,此外还可有多器官、多系统的损害。SS可独立发生即原发干燥综合征(primary Sjogren syndrome,pSS),也可与类风湿性关节炎、系统性红斑狼疮和系统性硬化症等其他自身免疫性疾病重叠发生,即继发性干燥综合征(secondary Sjogren syndrome,sSS)。近年来研究发现,pSS与肿瘤关系密切,非霍奇金淋巴瘤发生风险较高[1],但合并肺癌报道较少,同时存在双原发肺癌(double primary ling cancer,DPLC)、胸腺囊肿,临床更是未见报道。现将近期收治的pSS伴有肺部囊样变、胸腺囊肿及DPLC 1例报道,并复习国内外相关文献,以提高临床医生的认识。
1 病例摘要
患者,女,67岁,退休职工,因“咳嗽、咳痰、发热9 d,发现肺部阴影7 d”2017年9月29日入院。患者自诉9 d前感冒后出现咳嗽、咳痰、发热,最高体温38.6℃,发热前无明显畏寒、寒战,无胸痛、盗汗、消瘦症状,咳少量白黏痰,无痰中带血,无咽痛、流涕,自行服用感冒药物治疗,效果不佳,仍发热。遂于7 d前就诊于我院呼吸内科,胸部X线检查示:双肺多发片状阴影,诊断:“肺部阴影,肺炎?”,建议住院治疗,患者拒绝,给予口服头孢类抗生素治疗,3 d后,体温正常。1 d前患者于我院呼吸科复诊,胸部CT,发现右肺下叶片状密度增高影,右肺中叶及右肺上叶磨玻璃结节,双肺多发无壁囊样透亮区,纵隔内团块影,考虑“肺部阴影性质待查”,收入胸外科。患者病程中精神、食欲可,大小便正常,体重无减轻。既往确诊原发干燥综合征20年,自觉不影响生活,未进一步治疗,仍间断存在口干、眼干症状。否认高血压、冠心病、糖尿病病史,否认肝炎、结核等传染病病史,否认吸烟及饮酒史,否认粉尘接触史及化学物质接触史。已绝经,适龄婚育,子女体健,否认家族遗传病史。
入院查体:体温36℃,脉搏80次/min,呼吸19次/min,血压115/86 mm Hg(1 mm Hg=0.133 k Pa),无明显皮疹、瘀斑,全身浅表淋巴结无明显肿大,无疯狂龋齿,腮腺无肿大,皮肤稍干燥,听诊两肺呼吸音清,未及明显干湿啰音,心率80次/min,律齐,关节无红肿,四肢无畸形。胸部CT(2017年9月28日):右肺下叶背段可见结节影,直径约1.7 cm,边缘欠光滑,周围可见分叶、毛刺及血管集束征,周围可见散在小结节灶。右肺上叶可见磨玻璃密度结节,边界欠清,直径约3.5 mm,右肺中叶可见混合磨玻璃密度结节,边界欠清,直径约8.5 mm,右肺下叶前基底段可见钙化,左肺上叶舌段及下叶后基底段可见不规则斑片影,周围可见索条牵拉,双肺散在大小不等无壁透亮区,纵隔内可见多发淋巴结,前纵隔团块影,见图1~4。腹部超声:胆囊多发结石。心脏超声:左心房增大。颅脑磁共振成像:左侧颞叶皮层下、右侧脑室额角旁多发小缺血灶。肺功能正常,心脏超声未见明显异常。血常规:白细胞(WBC)9.6×109/L,血红蛋白(Hgb)119 g/L,血小板(Plt)116×109/L。生化:白蛋白35 g/L,肝肾功能正常,心肌酶正常,降钙素原正常,尿、便常规正常,凝血功能正常,肿瘤标记物均阴性。ANA:斑点型1∶320,抗SS-A(+),抗SS-B(+),类风湿因子(RF)29 U/ml,抗链“O”:36 U/ml,血沉46 mm/1 h。于2017年10月22日于全麻下行胸腔镜探查,右肺上叶楔形切除+右肺中叶楔形切除+右肺下叶切除术+纵隔肿物切除术,术中冰冻病理回报腺癌,遂行周围淋巴结清扫术。

图1 2017年9月28日胸部CT 右肺中叶可见混合磨玻璃密度结节,边界欠清,直径约8.5 mm
病理诊断(2017年10月27日):右肺下叶肿物:大小约1 cm×1 cm×0.2 cm,可见肺腺癌细胞,贴壁为主型,伴少许腺泡型、乳头型及微乳头型腺癌成分,见图5。免疫组织化学:TTF-1(+),SP-A(+),P53(-),ALK(-),PD-1(-),PD-L1(-),EGFR(+/-),Braf(+),Cg A(-),Ki67(+<5%),特殊染色弹力纤维(+),Masson(+)。右肺中叶结节:浸润性肺腺癌,最大径约1 cm,贴壁为主型,伴部分腺泡型、乳头型及微乳头型腺癌成分,局部临近剥离面,可疑胸膜侵犯。周围肺组织肺泡腔扩张、充血,肺泡间隔增宽,小血管扩张、充血,肺泡间质内多灶状淋巴组织增生,局灶钙盐沉积,另见炎性渗出物伴囊肿样结构,见图6。右肺上叶结节:不典型腺瘤样增生,最大5 mm。纵隔肿物:胸腺组织,多房囊性变,被覆假复层纤毛柱状上皮,符合胸腺囊肿。考虑DPLC,诊断右肺中叶腺癌T2N0M0ⅠB期,右肺下叶浸润性腺癌T2N0M0ⅠB期,右肺上叶不典型腺瘤样增生,胸腺囊肿。EGFR基因检测阴性,给予顺铂+培美曲塞二钠化疗,因白细胞及血小板进行性下降,暂停化疗。目前随访1年,复查胸部CT无肿瘤复发倾向。

图2 2017年9月28日胸部CT 右肺下叶背段可见结节影,直径约1.7 cm,边缘欠光滑,周围可见分叶、毛刺及血管集束征
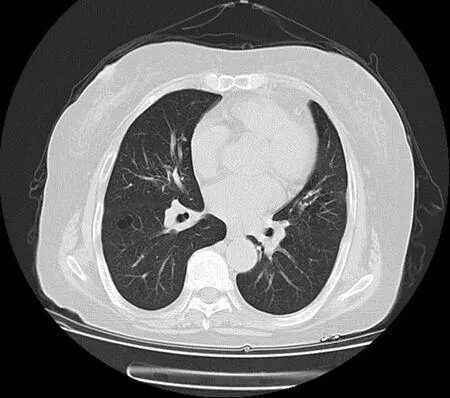
图3 2017年9月28日胸部CT 双肺散在多发大小不等无壁透亮区,右肺为著

图4 2017年9月28日胸部CT 可见双肺多发无壁透亮囊样改变,右下肺囊腔内可见偏心血管影

图5 2017年10月27日右肺下叶肿物 大小约1 cm×1 cm×0.2 cm,可见肺腺癌细胞,贴壁为主型,伴少许腺泡型、乳头型及微乳头型腺癌成分 HE ×10

图6 2017年10月27日右肺中叶结节 浸润性肺腺癌,最大径约1 cm,贴壁为主型,伴部分腺泡型、乳头型及微乳头型腺癌成分,局部临近剥离面,可疑胸膜侵犯。周围肺组织肺泡腔扩张、充血,肺泡间隔增宽,小血管扩张、充血,肺泡间质内多灶状淋巴组织增生,局灶钙盐沉积,另见炎性渗出物伴囊肿样结构 HE ×20
2 文献回顾
本研究我们以“干燥综合征,肿瘤”为检索词,检索万方数据库,检索到pSS合并肺癌相关文献2篇,其中1篇为个案报道[2];以“Sjogren syndrome AND tumor or cancer”为检索词,检索Pub Med数据库,共检索到近20年的相关文献9篇,其中3篇为个案报道[3-5],见表1。
万方数据库检索到的相关文献中,最早的是我国1986年的1篇个案[2],报道了1例39岁男性患者,伴有无汗、无泪、口干、鼻黏膜干燥症状,确诊pSS合并肺癌。另1篇为苏清芳等[6]对15例风湿性疾病合并恶性肿瘤患者的临床资料进行的总结研究,发现了pSS合并肺癌1例。Pub Med数据库中检索到的相关文献9篇,3篇个案报道,其中2篇来自日本。
文献共报道pSS合并肺癌30例,部分文献病历资料欠缺。分析现有已知资料,见表1。年龄39~79岁,标 注 性 别 共23例,男 性9例(39.1%),女性14例(60.9%);标注吸烟史者13例,不 吸 烟11例(84.6%),吸 烟2例(15.4%);有症状描述的15例,患者均具有典型口干、眼干表现(100%);记录pSS肺累及情况12例,其中7例(58.3%)伴有肺累及,5例无肺累及(41.7%);描述肺癌类型16例,病理类型腺癌14(87.5%),小细胞肺癌2例(12.5%),明确死亡8例。

表1 相关文献报道病例临床特点
Theander等[7]的一项多中心研究,收集了pSS 507例,并进行了平均8年(1个月~19年)的随访,其中4例(0.79%)发生了肺癌。英国的Lazarus等[8]在关于慢性pSS合并肿瘤的研究2例(1.79%)发生肺癌,甚至一些pSS患者患了不止一种癌症,该研究认为pSS患者淋巴瘤的发病率高于一般人群。2007年,Touma等[9]对存在淋巴瘤家族史的pSS病例研究,发现了存在血液系统肿瘤家族史的女性患者1例,口干、眼干症状出现20年后,诊断pSS,并在确诊7年后逐渐出现紫癜及雷诺现象,诊断肺癌。该研究认为血液系统疾病家族史增加了pSS患者实体肿瘤的发生风险。韩国的1项对pSS死亡原因进行的研究,收集了2010-2014年新诊断pSS患者5 891例,其中死亡114例,发现6例(5.26%)死于支气管、肺肿瘤,其中男性5例,女性1例,并证实pSS发病无明显区域分布差异[10]。2010年,我国的协和医院也进行了关于pSS合并肿瘤的研究,收集了1 320例pSS病例的临床资料,平均随访4.4年,发现合并肿瘤29例,其中血液系统肿瘤10例,实体瘤19例,肺癌2例(0.15%)[11]。2015年,协和医院又进行了一项对10例pSS合并肺癌情况的专项研究,患者年龄48~76岁,平均年龄(60.8±8.9)岁,pSS从诊断到发现肺癌0.92~42年,肺癌发病率0.48%[12]。
3 讨论
风湿免疫疾病尤其是pSS,最常累及肺部,表现为淋巴细胞和浆细胞弥漫性侵犯肺泡间隔和小气道,造成管腔的狭窄,进而形成单向“活瓣”,导致气体潴留;间质性肺炎和肺的纤维样变使得肺疱的弹性降低,而破裂形成肺大疱,导致CT上表现为界限不清的小叶中心性结节和/或磨玻璃密度衰减影以及多发薄壁囊腔等改变[13]。肺部囊腔样改变是pSS肺累及最具特征性表现,囊壁上的偏心血管影是指向SS的重要线索[14]。本例pSS诊断明确,SSA、SSB阳性,双肺多发无壁透亮囊样改变以及典型的囊腔内偏心血管影,病理可见病灶周围肺组织内肺泡腔扩张,肺泡间隔增宽,肺泡间质内多灶状淋巴组织增生,并存在囊肿样结构,强烈提示为pSS的肺累及表现。
胸腺囊肿分为先天性和后天性,先天性胸腺囊肿比较少见。后天性囊肿多表现为多房囊肿,与原始内胚层细胞、胸腺小体、网状细胞和淋巴细胞的炎性或退行性改变相关[15]。SS可累及胸腺,造成胸腺病变[16]。李璟波等[17]报道了干燥综合征合并巨大胸腺囊肿1例,因部分胸腺囊肿镜下常可见到纤维组织增生及炎细胞浸润,考虑胸腺囊肿的发生与干燥综合征病史存在一定相关性。本例患者存在pSS病史,囊肿呈现多房囊性变,考虑后天胸腺囊肿,暂未发现其他导致胸腺囊肿的危险因素,因此有理由认为本例的胸腺囊肿与pSS相关。
DPLC是指在患者肺内同时或先后发生2个原发恶性肿瘤,根据病灶间诊断时间间隔是否大于6个月分为同时性双原发癌和异时性双原发癌,病理类型相同者以腺-腺最常见[18]。肺腺癌分为原位腺癌、微浸润腺癌及浸润性腺癌[19]。本例多部位同时出现,右肺下叶为腺癌,右肺中叶为浸润性腺癌,可认为组织学类型不同,且位于不同肺叶,共同的引流淋巴结无癌肿,确立诊断时无肺外转移,因此诊断为同时性DPLC。
风湿免疫性疾病包括pSS可引起人体炎症负荷增加,部分细胞因子又可激活癌基因,环磷酰胺、肿瘤坏死因子、硫唑嘌呤等免疫抑制剂的使用使得机体的免疫缺陷或调节异常,使肿瘤细胞逃脱免疫监视,从而导致肿瘤发生[20]。pSS肺癌发生率0.15%~1.79%[7-8,11-12],吸烟和饮酒情况与普通人群比较差异无统计学意义[10-11],女性比例高于男性,病理类型以肺腺癌最常见,其次为小细胞肺癌。分析其中原因:(1)pSS好发于女性;(2)女性人群吸烟比例低于男性;(3)女性、非吸烟人群腺癌及小细胞肺癌发病率高于男性,因此造成了pSS合并肺癌时同样以女性、非吸烟人群的腺癌高发。
对相关文献进行回顾发现58.3%的pSS合并肺癌患者存在肺累及,与协和医院的研究报道的50%数据相近[11]。有研究认为肺癌可能来自SS相关的囊性病变[6],而本例表现为肺内无壁囊样变以及胸腺囊肿,因此我们认为DPLC可能来自pSS导致的多发囊样变,肺内其他部位的囊样病变是否会继续发展为肺癌,仍需继续密切随访观察。
尽管pSS的预后相对良好,但合并肺癌者病死率明显增加,因此早期诊断显得尤为重要。当患者胸部CT出现双肺弥漫性分布的多发无壁囊泡表现或存在胸腺囊肿时,临床上应考虑SS。pSS患者可合并肺癌甚至多原发肺癌,且与吸烟无明显相关性。女性存在表现为囊样变的肺累及者,肺癌发病率增加。腺癌是最常见的病理类型,其次为小细胞肺癌。pSS患者肺内存在无壁囊腔样表现,若同时合并肺部小结节,肺部磨玻璃影,可能是发展为肺癌的高危因素,临床医生应对上述重点人群定期进行肺癌相关的筛查,从而改善患者预后。
利益冲突所有作者均声明不存在利益冲突
志谢本文得到北京大学第三医院呼吸与危重症学科孙永昌教授指导
