S100A6通过抑制细胞分裂、迁移、侵袭及促进凋亡抑制Calu-6肺癌细胞株生长
2021-09-13屈晓一王婷白乐乐西安市人民医院西安市第四医院呼吸内科70004西安市人民医院西安市第四医院全科70004
屈晓一 王婷 白乐乐西安市人民医院(西安市第四医院)呼吸内科 70004;西安市人民医院(西安市第四医院)全科 70004
目前,肺癌已成为导致癌症相关死亡的主要原因[1]。因为早期缺乏特异性症状和体征,肺癌患者诊断时往往处于中晚期,失去手术机会,这是肺癌病死率居高不下的主要原因。按照病理类型,肺癌分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC)。其中,NSCLC可进一步分为:腺癌(38.5%)、鳞状细胞癌(30.0%)、大细胞肺癌(2.9%)[2]。近年来,部分肺腺癌患者的预后因为针对表皮生长因子受体(epidemal growth factor receptor,EGFR)突变、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因重排等分子靶向药物的广泛使用而得以明显改善[3]。然而,无上述突变的腺癌及鳞癌等类型因发病分子机制不明确、缺乏特异性治疗靶点,至今仍无显著进展[4]。因此,积极探索肺癌发生发展进程中参与的分子机制,进一步确定治疗靶点,有望改善肺癌治疗效果,延长患者生存期。
S100A6作为S100蛋白家族中重要的一员,已被证实与多种肿瘤的发生和转移有关[5]。S100蛋白是最早由Moore等从牛脑中分离出的一种高度酸性钙结合蛋白[6]。目前,S100家族已知拥有25个成员,其中至少16个成员基因位于1号染色体长臂2区1带(1q21)。该区段染色体稳定性差,易发生多种染色体重排,从而导致肿瘤的发生[7-8]。在肺癌中,已证实S100A6在不同的肺癌亚型中存在差异表达。与单纯支气管肺泡癌(bronchioloalveolar carcinoma,BAC)相比,S100A6在混合有BAC成分的肺腺癌亚型中有更高的表达。在免疫组织化学相关实验中,与正常肺组织和局限性肿瘤组织相比,S100A6在侵袭性肺癌组织中表达更高。此外,还有研究发现S100A6在肺癌患者肿瘤细胞裂解物、血浆及胸腔积液标本中存在,高S100A6蛋白峰提示患者中位生存期较长[9]。在本研究中,我们将在细胞水平证实S100A6对肺癌细胞株生物学行为的影响,探究肺癌发生的可能分子机制。
1 资料与方法
1.1 p LVX-AcGFP1-N1-S100A6、慢病毒载体的构建及细胞感染 实验性研究。将肺癌细胞株Calu-6(购于中国科学院)培养扩增1~2周后用pcDNA-S100A6聚合酶链反应(PCR)方法制备PLVX-AcGFP1-N1-S100A6。引物设计如下:正向引 物 为5′-CCCAAGCTTACCATGGCATGCCCCCTGGTCA-3′,反 向 引 物 为5′-CGGAATTCCGGTCAGCCCTTGAGGGCTTCATT-3′。然 后 应用DNA测序来验证定位和插入序列。
p LVX-AcGFP1-N1-S100A6、pspax2和pmd2.G以2∶1∶1的比例共转染293T细胞。72 h后在显微镜下观察荧光表达,收集上清液,然后通过0.45μm PVDF过滤器(微孔)过滤,超离心(50 000 g,150 min,4℃)后获得30倍的浓缩原料。将颗粒重新悬浮在PBS中,并在-80℃下储存。
取对数期生长的Calu-6细胞,胰酶消化调整细胞密度为3×105/ml铺于6孔板中,置于培养箱中培养,待细胞汇合度达到80%~90%时,加入S100A6过表达慢病毒(MOI=10),空载体对照慢病毒(MOI=10)转染Calu-6细胞,并设置空细胞组为空白对照,命名三组为:Calu-6/S100A6实验组(Calu-6/S100A6组)、Calu-6/空载体对照组(Calu-6/neo组)、Calu-6空细胞对照组(Calu-6组)。感 染48 h后 收 细 胞 样 进 行QPCR、Western blot方法检测S100A6表达情况,验证过表达效果。
1.2 RNA提取和QPCR 使用TRIzol试剂(Invitrogen,USA)进行细胞裂解,收集离心上清液,在上清液中依次加入氯仿、2-丙醇和75%乙醇,分离RNA。提取RNA后,使用Nanodrop 2000(Thermo,USA)检测RNA的浓度和纯度。使用Revert Aid First Strand cDNA合成试剂盒(Thermo,USA)完成反转录过程,所有步骤均按说明书严格执行。PCR的具体步骤和条件为:孵育(95℃、5 min)、变性(94℃、30 s共44周)、退火(55℃、30 s)、延伸(72℃、30 s)。此外,PCR中使用的引物信息如下:S100A6正向引 物(5′-GGGAGGGTGACAAGCACAC-3′)和S100A6反 向 引 物(5′-AGCTTCGAGCCAATGGTGAG-3′);甘 油 醛-3-磷 酸 脱 氢 酶(GAPDH,内源性对照)正向引物(5′-GGAGCGAGATCCCTCCAAAAT-3′)和GAPDH反 向 引 物(5′-GGCTGT-TGTCATACTTCTCATGG-3′)。
1.3 Western-blot 感染48 h后,收集细胞并使用总蛋白提取试剂盒进一步获取细胞裂解物。对裂解液进行离心澄清(14 000 r/min,10 min),然后将装载样品缓冲液添加到裂解液中,在95℃下加热5 min,用10%十二烷基硫酸钠-聚丙烯酰胺分离后转移到硝化纤维素膜上。用5%脱脂牛奶封堵硝化纤维过滤器,然后在4℃下与S100A6的一抗(MAB769Hu22,USCN生命科学公司,中国武汉,稀释度1/500)孵育过夜。同时,将小鼠GAPDH抗体作为内源性对照。随后,冲洗膜,加入辣根过氧化物酶标记聚合物的二抗(LAB769Hu71,USCN生命科学公司,中国武汉,1/5 000稀释液),再次冲洗,然后使用增强化学发光法观察成像。
1.4 MTT增殖曲线测定 取对数期细胞Clau-6,空载体细胞,过表达载体细胞离心制成细胞悬液,细胞计数调整其浓度至(5~10)×104/ml。将细胞悬液制备好后,轻轻混匀,吸取100μl细胞悬液接种于96孔板中,每种细胞设置3个复孔,边缘孔用无菌PBS填充。将接种好的细胞培养板放入培养箱中培养,分别在培养24 h,36 h,48 h,60 h,72 h时间点取出酶标仪测定吸光度。小心吸弃上清,加入90μl新鲜培养液,再加入10μl MTT溶液,继续培养4 h。然后吸掉上清,每孔加入100μl Formazan溶解液,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的吸光值。
1.5 Transwell检测细胞迁移和侵袭 取对数期生长的细胞,0.25%胰酶消化并收集细胞,800 r/mim离心5 min,弃上清液,用无血清Dulbecco改良Eagle培 养 基(Dulbecco′s Modified Eagle Medium,DMEM)培养液重悬细胞,计数,调整细胞密度为1×106个/ml。将3组单细胞重悬液各取100μl加入上室,下室中加入600μl含30%FBS的DMEM培养液。种板时注意下层培养基和小室中的聚碳酸酯膜间不要有气泡产生,于37℃、5%CO2细胞培养箱内培养48 h。取出小室,小心吸去上室的培养液,PBS缓冲液轻洗3次,用消毒湿棉签轻轻擦净上室未迁移细胞,95%乙醇固定30 min,结晶紫染色20 min,自来水冲洗3次以上,晾干,100倍光学显微镜下观察、拍照。
Transwell检测细胞迁移和侵袭步骤类似,稍有不同的是后者所需六孔板涂有Matrigel基质胶。
1.6 流式细胞术 流式细胞术用来检测细胞凋亡和细胞周期。取对数期细胞制成细胞悬液,细胞计数调整其浓度为3×105/ml。将细胞悬液制备好后,轻轻混匀,吸取2 000μl细胞悬液接种于6孔板中,置于培养箱培养48 h后进行流式检测。分组处理后离心5 min(1 000 r/min,4℃),收集细胞。用预冷的PBS洗涤2次,再次离心5 min(1 000 r/min,4℃),收集细胞,调整浓度为(1~5)×105/ml。吸弃PBS,加入100μl 1×Binding Buffer重悬细胞。然后,加入5μl的Annexin VFITC和10μl的PI染色液,轻轻混匀。避光、室温反 应10~15 min。加 入400μl 1×Binding Buffer,混匀后置于冰上,样品在1 h内用流式细胞仪检测。
在流式细胞检测细胞周期检测过程中,离心后细胞需在75%乙醇中固定1 h,用PBS洗涤,用100μl RNase A溶液处理,重新悬浮,然后在37℃的水中浸泡30 min。在400μl PI染色液存在下,将细胞沉淀在4℃的黑暗中培养30 min,然后在488 nm的波长下用流式细胞仪分析混合物。我们使用Cell Quest和Mid Fit软件来确定细胞周期,主要包括G1、S、G2三个阶段。
1.7 动物实验 在小鼠实验中,15只8~10周龄Balb/c裸鼠被分为Calu-6组(n=4)、Calu-neo组(n=4)和Calu-6/S100A6组(n=7)。将2.5×106/L稳定转染的Calu-6/S100A6细胞(添加在200μl PBS中)注射到小鼠的右前背部。对照组同时注射等量的Calu-6空细胞和Calu-6/空载体细胞。每周测量每只小鼠的肿瘤体积,记录数据。5周后,处死小鼠,取出肿瘤,然后拍照。
1.8 统计学分析 采用SPSS 22.0分析数据。计量资料以±s表达。采用单因素方差分析比较符合正态分布的3组数据差异。涉及组间、时间点双因素的数据采用重复测量方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 S100A6 m RNA和蛋白表达情况 根据是否被S100A6过表达慢病毒载体感染,将Calu-6肺癌细胞分为3组,分别为Calu-6/S100A6实验组,Calu-6/空载体对照组,Calu-6空细胞对照组(Calu-6组)。感染48 h后使用QPCR和Western blot方法检测感染效果。与Calu-6/空载体对照组(Calu-6/neo组),Calu-6空细胞对照组相比,S100A6在Calu-6/S100A6实验组(Calu/S100A6组)中高表达,蛋白(图1A)及mRNA(图1B)表达均呈上升趋势,提示感染率高。
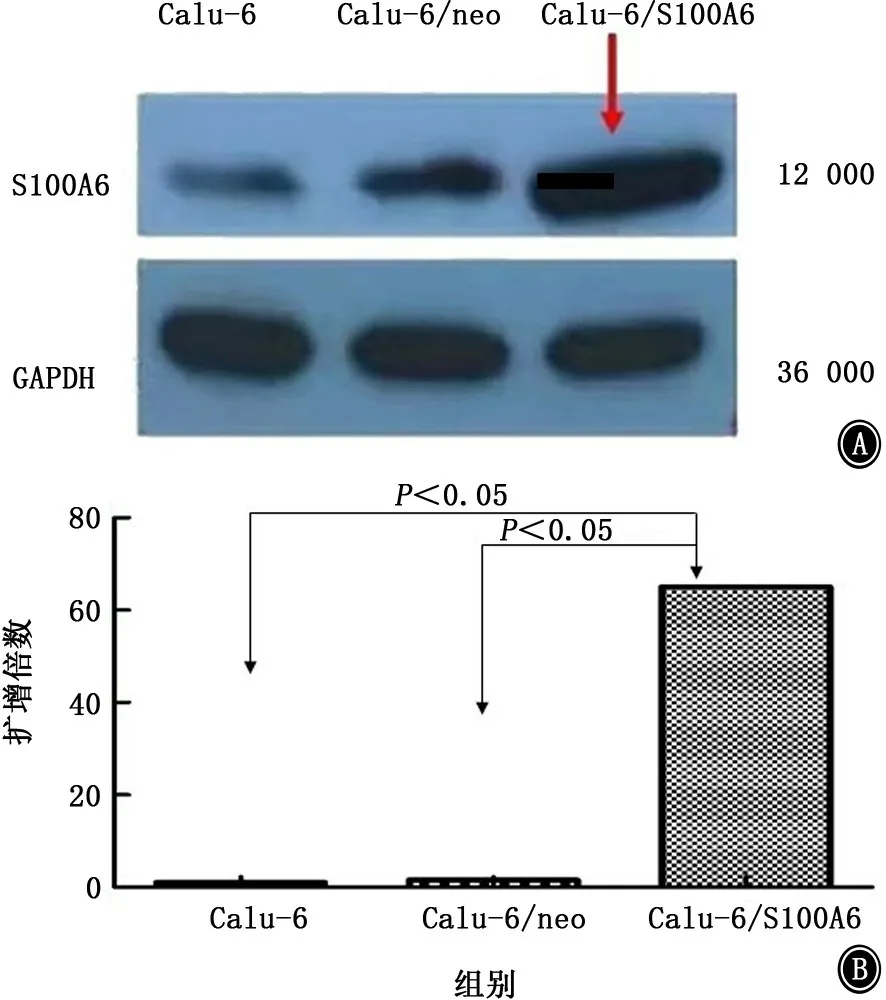
图1 感染后S100A6在三组细胞中蛋白和m RNA表达
2.2 S100A6抑制细胞增殖、侵袭和迁移 MTT和Transwell用来检测细胞增殖能力、侵袭和迁移能力。感染S100A6后,相比于Calu-6/neo,Calu-6,Calu-6/S100A6实验组增殖能力下降,3组组间、时点间以及组间·时点间交互作用差异均有统计学意义(P<0.01),见表1。相比于对照组,Calu-6/S100A6实验组细胞侵袭能力和迁移能力均下降(P<0.05),分别见图2、图3。

图2 Calu-6,Calu-6/neo及Calu-6/S100A6侵袭能力 A:Calu-6;B:Calu-6/neo;C:Calu-6/S100A6;D:柱状图

图3 Calu-6,Calu-6/neo及Calu-6/S100A6迁移能力 A:Calu-6;B:Calu-6/neo;C:Calu-6/S100A6;D:柱状图
表1 3组细胞平均吸光值比较(±s)
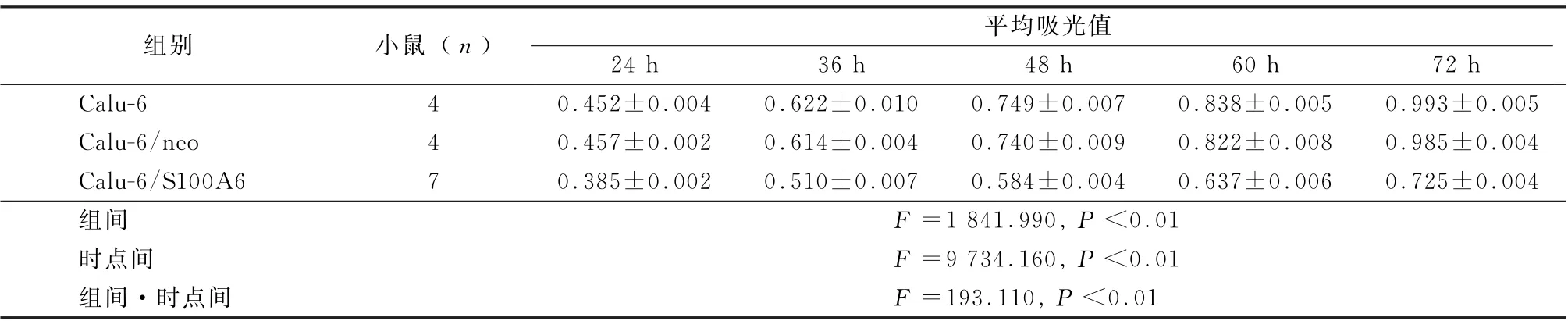
表1 3组细胞平均吸光值比较(±s)
组别 小鼠(n) 平均吸光值24 h 36 h 48 h 60 h 72 h Calu-6 4 0.452±0.004 0.622±0.010 0.749±0.007 0.838±0.005 0.993±0.005 Calu-6/neo 4 0.457±0.002 0.614±0.004 0.740±0.009 0.822±0.008 0.985±0.004 Calu-6/S100A6 7 0.385±0.002 0.510±0.007 0.584±0.004 0.637±0.006 0.725±0.004组间 F=1 841.990,P<0.01时点间 F=9 734.160,P<0.01组间·时点间 F=193.110,P<0.01
2.3 S100A6促进Calu-6细胞凋亡、抑制细胞周期 采用流式细胞术检测细胞凋亡能力及细胞周期变化。感染S100A6过表达慢病毒载体后,Calu-6/S100A6组 凋 亡 比 例 明 显 升 高(P<0.05)。Calu-6/S100A6组处于G1期的细胞比例显著高于Calu-6对照组和Calu/neo组(P<0.05)。与对照组比较,Calu-6/S100A6实验组G1期到S期转化能力下降(P<0.05)。见表2。
表2 3组细胞凋亡能力及细胞周期变化比较(%,±s)
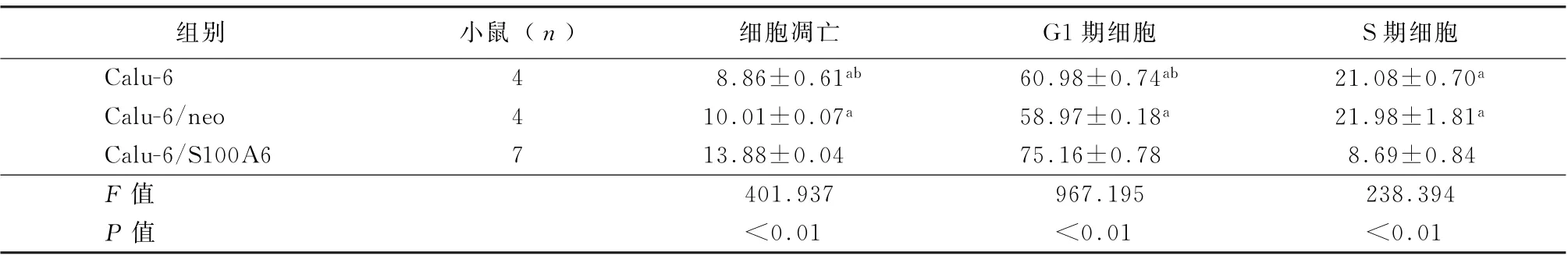
表2 3组细胞凋亡能力及细胞周期变化比较(%,±s)
注:与Calu-6/S100A6组比较,a P<0.05;与Calu-6/neo组比较,b P<0.05
组别 小鼠(n) 细胞凋亡 G1期细胞 S期细胞Calu-6 4 8.86±0.61ab 60.98±0.74ab 21.08±0.70a Calu-6/neo 4 10.01±0.07a 58.97±0.18a 21.98±1.81a Calu-6/S100A6 7 13.88±0.04 75.16±0.78 8.69±0.84 F值 401.937 967.195 238.394 P值 <0.01 <0.01 <0.01
2.4 S100A6抑制Calu-6细胞在小鼠体内成瘤动物实验结果显示:从第2周开始,Calu-6/S100A6实验组与对照组肿瘤体积的差距逐渐扩大。3组组间、时点间以及组间时点间交互作用差异均有统计学意义(P<0.01)。见表3。
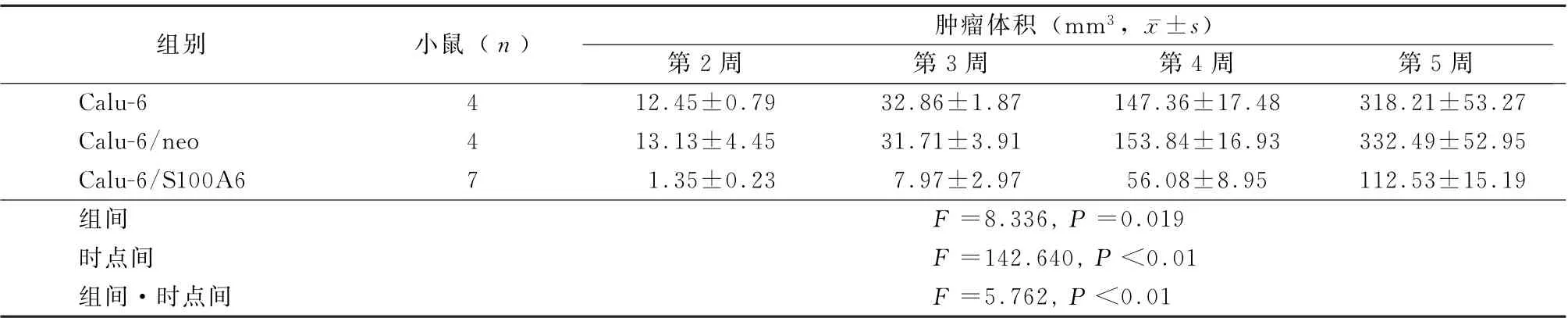
表3 3组动物肿瘤体积比较
3 讨论
在本研究中,我们构建了S100A6表达慢病毒载体,并将其感染Calu-6细胞,进一步探讨了S100A6在肺癌细胞系中的作用。通过比较三组(Calu-6、Calu-6/neo、Calu-6/S100A6)的细胞生物学行为,发现S100A6可抑制Calu-6肺癌细胞株增殖、侵袭和迁移,抑制该细胞株凋亡并抑制细胞周期中G1期向S期改变,证实S100A6可能有抑制肺癌的发生和发展的作用。
近年来,S100蛋白家族中一些成员作为多种恶性肿瘤的辅助诊断和评估预后的生物标志物越来越受到研究者的重视。这些蛋白通过结合Ca2+和激活Ca2+介导的信号通路参与许多细胞活动,如细胞增殖、分裂等[10]。S100A6作为该家族中一个重要而独特的成员,在不同类型的肿瘤中也有不同的表达[11]。S100A6又称为Calcylin蛋白,最初在Ehrlich腹水肿瘤细胞中发现,也是S100蛋白家族中第一个被确定与细胞增殖有关的蛋白。研究发现,与静止细胞相比,S100A6在处于高增殖的细胞中有高表达,例如,Luu等[12]的研究发现,S100A6在骨肉瘤中表达明显升高。Stulík等[13]研究正常结肠组织细胞、结肠腺瘤细胞和结肠癌细胞中S100A6的表达,证实S100A6在结肠癌细胞中表达升高。关于S100A6对肿瘤细胞生物学行为影响的研究则得出了矛盾的结论,即S100 A6在多种肿瘤中的升高可能会介导两种相反的细胞生物学功能。例如,在胰腺癌中S100A6表达升高与促进细胞分化及预后差有关,m RNA和蛋白水平显示S100A6诱导表达胰腺癌细胞内β-连环蛋白、N-黏连蛋白、波形蛋白表达增加,E黏连蛋白表达下降,而β-连环蛋白sh RNA可影响胰腺癌细胞内上皮间质转化标志物的表达,如E-黏连蛋白表达增加,N-黏连蛋白、波形蛋白表达下降。也就是说,S100A6蛋白通过激活β-连环蛋白而促进上皮细胞-间充质转化(epithlial-mesenchymal trans differentiation,EMT),进一步促进细胞的侵袭性,S100A6也有可能成为胰腺癌潜在的治疗靶点。但在骨肉瘤中,S100A6水平增高则提示着肿瘤发生远处转移可能性小[14]。
在肺癌中,De Petris等[9]检测了S100A6在A549肿瘤细胞裂解物以及39例NSCLC患者的血清和胸水中的表达情况,证实翻译后修饰的S100A6蛋白在上述标本中均有表达。此外,研究进一步证实,S100A6阳性的病例倾向于拥有更长的生存时间,尤其那些P53表达阴性的病例[9]。相关免疫组织化学研究结果显示:103例NSCLC组织中,25%S100A6表达阳性,且在腺癌中表达高于鳞癌(P<0.01),S100A6表达阳性者生存期较阴性者长。上述研究与我们的研究得出的结论类似,即S100A6在肺癌细胞水平上被证实有抑癌作用。但也有一些学者得出相反的结论,He等[15]使用免疫组织化学方法检测了177例肺鳞癌患者组织S100A6表达并根据其表达情况绘制生存曲线,发现S100A6高表达的患者生存期较短。关于其具体机制的研究发现,S100A6的广泛生物学功能源自其可能与其他蛋白质结合并通过诱导构象变化、干扰翻译后蛋白的方式影响其他蛋白的功能。体外实验中发现,S100A6蛋白可以绑定到p53的N端,在其磷酸化区域较非磷酸化区域有较高的亲和力。实验进一步表明S00A6可影响抑癌基因p53作用的发挥,这可能是通过p53上至少含有6个乙酰化赖氨酸的区域—p300来实现的。Song等研究也发现,在Hep G2细胞株中,S100A6表达增高的细胞内p53的转录活性也增高,同时这些细胞凋亡的敏感性也更容易被过氧化氢诱发[16]。电泳迁移率变动分析显示S100A6不影响p53与DNA结合,但另一方面,S100A6存在下p53易出现核堆积。故总的来说S100A6与p53相互作用并影响其生物活性[16]。
本研究证实S100A6可从多方面抑制Calu-6肺癌细胞株生长。但结合目前其他学者的研究结论,S100A6在肺癌中可能扮演较复杂角色,其发挥作用具体的机制也需要进一步研究,在未来的实验中也希望将在多种肺癌细胞株及多层面探究S100A6在肺癌中所发挥的具体作用及具体分子机制。
利益冲突所有作者均声明不存在利益冲突
