微小RNA-92a在非小细胞肺癌中的表达及其生物学行为特性实验研究
2021-09-13李志强张和平陈凯
李志强 张和平 陈凯
宝鸡市中心医院呼吸与危重症医学科 721008
肺癌是临床常见的恶性肿瘤,其中80%以上为非小细胞肺癌(non-small cell lung cancer,NSCLC)。NSCLC被确诊时大多处于中晚期,错过手术切除时机,总体预后不够理想[1]。近年来多项研究发现,微小RNA(miRNA)是一类在恶性肿瘤异常表达的小分子RNA,在肿瘤中作用与原癌基因和抑癌基因相似,影响着肿瘤细胞增殖、转移、侵袭过程[2]。miR-92a是miRNA家族的重要成员之一,目前已经发现其可影响胃癌、结直肠癌、前列腺癌等多种恶性肿瘤细胞的生物学行为,但在不同种类肿瘤细胞中可能分别起到致癌或抑癌作用[3-4]。目前miR-92a对NSCLC细胞的发生发展过程作用尚无定论,本次拟通过收集临床样本和进行体外细胞实验,分析miR-92a在人NSCLC组织中表达情况,同时分析其差异性表达对NSCLC细胞生物学行为的影响,以期为NSCLC临床治疗提供新的靶点和方向。
1 资料与方法
1.1 一般资料 实验性研究。收集我院2018年1月至2020年10月收治的39例NSCLC患者癌组织及其对应的癌旁正常组织,入组条件:(1)患者经穿刺活检取得NSCLC组织和癌旁组织标本,所有操作符合临床实验操作规范;(2)取组织前患者未接受过放化疗及相关药物治疗;(3)患者临床资料完整。收集NSCLC患者临床资料,39例患者中男21例,女18例;年龄(67.52±5.26)岁,范围为42~73岁,其中≥60岁24例,<60岁15例;病理分型中有鳞癌20例,腺癌19例,TNM分期中T1期10例,T2期8例,T3期14例,T4期7例;淋巴结转移24例,未转移15例;组织分化中高分化26例,中等分化8例,低分化5例。本研究经宝鸡市中心医院伦理委员会批准(BZYL2018-1),所有患者均签署了知情同意书。
1.2 实验试剂和仪器 PCR试剂盒(日本TAKARA公司),RNA提取试剂盒(美国默克公司),miR-92a mimics、miR-92a inhibitor及对应阴性对照质粒(购自北京中科院),RPMI1640培养基及胎牛血清(美国Gibco公司),青链霉素(美国Invirogen公司),RIPA裂解液(上海碧云天生物技术有限公司),Lipofectamine2000转染试剂盒(美国赛默飞公司),CCK8试剂盒(武汉默沙克生物有限公司)。PCR扩增仪(美国Bio-Rad伯乐公司T100型),Transwell小室(北京优尼康生物科技有限公司),CO2培养箱(美国Thermo Scientific公司371型),酶标仪(美国迈瑞MR-96A型)。
1.3 NSCLC组织和癌旁组织中miR-92a m RNA相对表达量 采用RT-PCR检测组织中miR-92a mRNA相对表达量,具体步骤:在组织标本中加入Trizol试剂(60 mg匀浆组织中加入1 ml Trizol),经过RNA相位分离、沉淀、洗涤和再溶解来提取组织中总RNA,并于-80℃冻存以统一检测。测定提取的总RNA样品浓度,确定合格后逆转录成cDNA,配置好PCR反应体系后进行扩增,反应条件:95℃2 min,95℃15 s,58℃60 s,共55个循环。引物序列:miR-92a上游,5′-ACAGGCCGGGACAAGTGCAATA-3′,下 游,5′-GCTGTCAACGATACGCTACGTAAC-3′;内参U6上 游,5′-GCTTCGGCAGCACATTACTAAAAT-3′,下游,5′-CGCTTCACGAATTTGCGTCTCAT-3′,miR-92a m RNA相 对 表 达 量 以2-ΔΔCt表示,每个样本重复测3次并取平均值。记录每例组织标本中miR-92a m RNA相对表达量,并分析其与患者临床病理关系。
1.4 细胞培养与转染 将A549细胞(购自北京中科院)在含10%胎牛血清(FBS)和1%青链霉素的1640培养液中进行培养,取处于对数生长期的细胞进行转染,采用Lipofectamine2000转染试剂将miR-92a mimics、miR-92a inhibitor或miRNC对照序列转染入细胞中,并分别作为miR-92a mimics组、miR-92a inhibitor组和对照组,转染后继续孵育48 h。
1.5 RT-PCR检测细胞中miR-92a mRNA相对表达量 吸去培养液并加入PBS清洗、胰酶消化,在显微镜下观察到细胞变圆时加入培养基终止消化,随后用玻璃吸管吸取细胞液使之混合均匀,待培养瓶的细胞完全脱离瓶底悬浮,对细胞进行计数,调整细胞液浓度至(3~10)×106个/ml,在6孔板中接种培养细胞,每个孔内加入1 ml Trizol试剂,用移液枪打匀后移入EP管,随后用注射器进行快速抽吸以吹打裂细胞,加入氯仿震荡后离心并吸取上清液,在上清液中加入异丙醇静置1 min后再次离心,取沉淀加入DEPC水配置的乙醇稀释,离心并取沉淀,干燥,加入DEPC水溶解,采用分光光度计检测其紫外吸光度以确定RNA浓度和纯度,后面步骤与1.3中相同,逆转录、扩增,miR-92a m RNA相对表达量 以2-ΔΔCt表示,每个样本重复测3次并取平均值,然后对各组间表达量进行对比分析。
1.6 CCK8检测细胞存活率 将转染后的各组细胞用PBS清洗后加入胰酶消化,在显微镜下观察到细胞变圆时加入培养基终止消化,随后用玻璃吸管吸取细胞液使之混合均匀,待培养瓶的细胞完全脱离瓶底悬浮,对细胞进行计数,调整细胞液浓度至(3~5)×104个/ml,在96孔板中接种培养细胞并标记,培养条件为37℃5% CO2。在细胞培养24 h、48 h、72 h、96 h时,分别加入10μl CCK8试剂37℃避光孵育2 h,以空白孔调零,随后加入150μl DMSO溶解并在450 nm处测定吸光度值,OD值可反映增殖水平大小,每组重复操作3次并取平均值。
1.7 划痕实验检测细胞转移能力 在6孔板背面用记号笔划两条平行直线并接种细胞,采用移液枪将标记部位直线内细胞划除,此过程在显微镜下操作,并分别在划痕24 h、48 h后拍照并计算细胞迁移距离,迁移距离=原始距离-现阶段细胞间距离。
1.8 统计学分析 采用SPSS 22.0统计软件包对数据进行统计分析,符合正态分布的计量资料以±s表示,组间比较采用独立样本t检验,各组不同时点的比较采用重复测量的方差分析,计数资料以[例(%)]表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC组织和正常组织中miR-92a表达NSCLC组织中miR-92a m RNA相对表达量高于正常组织,差异有统计学意义(P<0.05),见表1。
表1 NSCLC组织和癌旁正常组织中miR-92a m RNA相对表达量(±s)
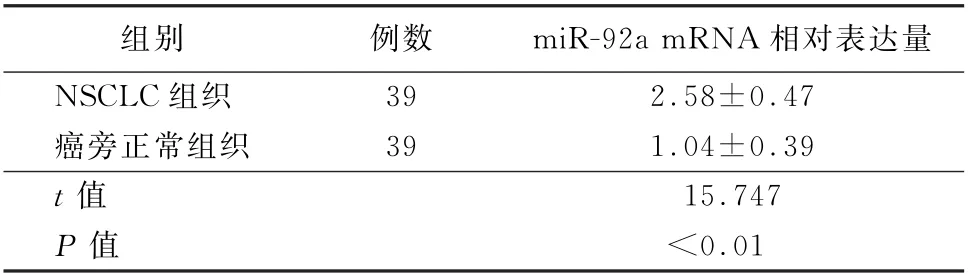
表1 NSCLC组织和癌旁正常组织中miR-92a m RNA相对表达量(±s)
组别 例数 miR-92a m RNA相对表达量NSCLC组织 39 2.58±0.47癌旁正常组织 39 1.04±0.39 t值 15.747 P值 <0.01
2.2 NSCLC患者不同临床病理miR-92a的表达NSCLC患者在不同性别、不同年龄以及鳞癌与腺癌的之间癌组织中miR-92a mRNA表达差异无统计学意义(P>0.05),但患者TNM分期T3+T4期者较T1+T2期者、中低分化较高分化者、有淋巴结转移较无淋巴结转移者miR-92a m RNA表达量高,差异有统计学意义,见表2。
表2 miR-92a m RNA表达与NSCLC患者临床病理关系(±s)

表2 miR-92a m RNA表达与NSCLC患者临床病理关系(±s)
项目 例数 miR-92a m RNA相对表达量 t值 P值性别 0.792 0.434男21 2.62±0.32女18 2.53±0.39年龄(岁) 1.982 0.055≥60 24 2.67±0.24<60 15 2.48±0.33病理类型 1.804 0.079鳞癌 20 2.63±0.20腺癌 19 2.49±0.28 TNM分期 4.651 0.000 T1+T2 18 2.19±0.30 T3+T4 21 2.68±0.35分化程度 6.047 0.000中低分化 13 2.84±0.26高分化 26 2.13±0.38淋巴结转移 5.203 0.000是24 3.25±0.68否15 2.17±0.54
2.3 各组细胞miR-92a m RNA相对表达量比较RT-PCR检测结果显示,miR-92a mimics组miR-92a m RNA相对表达水平高于mimics-NC组,转染24 h后miR-92a inhibitor组 细 胞miR-92a m RNA相对表达水平低于inhibitor-NC组,差异有统计学意义(P<0.05),见表3、4。
表3 两组miR-92a m RNA的表达(±s)

表3 两组miR-92a m RNA的表达(±s)
组别 细胞数 miR-92a m RNA相对表达量miR-92a mimics组 6 2.33±0.19 mimics-NC组 6 1.02±0.29 t值 4.704 P值 0.043
2.4 各组细胞增殖水平比较 培养24 h、48 h、72 h后,各组细胞均随着培养时间延长增殖水平逐渐升高,miR-92a mimics组细胞增殖水平高于mimics-NC组,miR-92a inhibitor组细胞增殖水平低于inhibitor-NC组,4组在组间、时点间以及组间和时点间的交互作用,差异均有统计学意义(P<0.05),见表5、图1。
表5 各组细胞增殖水平比较(±s)

表5 各组细胞增殖水平比较(±s)
组别 细胞数 细胞增殖水平(OD值)0 h 24 h 48 h 72 h miR-92a mimics组 6 0.375±0.014 0.690±0.02 0.778±0.023 0.984±0.015 mimics-NC组 6 0.381±0.025 0.407±0.017 0.527±0.018 0.672±0.019 miR-92a inhibitor组 6 0.372±0.018 0.398±0.015 0.407±0.036 0.428±0.026 inhibitor-NC组 6 0.376±0.23 0.403±0.026 0.531±0.024 0.679±0.038组间 F=2 319.690,P<0.001时点间 F=2 011.809,P<0.001组间·时点间 F=290.645,P<0.001
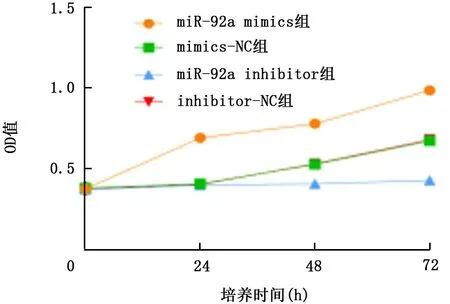
图1 各组细胞增殖情况比较
表4 两组转染24 h后miR-92a mRNA的表达(±s)

表4 两组转染24 h后miR-92a mRNA的表达(±s)
组别 细胞数 miR-92a m RNA相对表达量miR-92a inhibitor组 6 0.27±0.13 inhibitor-NC组 6 1.03±0.31 t值 6.110 P值 0.023
2.5 各组迁移能力比较 划痕24 h、48 h后,miR-92a mimics组细胞迁移能力高于mimics-NC组,miR-92a inhibitor组细胞迁移距离低于inhibitor-NC组,差异有统计学意义(P<0.05),见表6、图2。
表6 各组细胞转移能力比较(±s)

表6 各组细胞转移能力比较(±s)
组别 细胞数 细胞转移(μm)24 h 48 h miR-92a mimics组 6 601.4±95.6 840.2±168.9 mimics-NC组 6 220.1±67.2 324.7±13.5 miR-92a inhibitor组 6 97.6±18.4 128.7±46.7 inhibitor-NC组 6 226.1±38.3 319.6±23.3组间 F=2 506.614,P<0.01时点间 F=485.179,P<0.01组间·时点间 F=64.559,P<0.01

图2 各组细胞迁移能力比较
3 讨论
NSCLC是全球范围内常见的恶性肿瘤,具有较高的发病率和病死率,手术切除是其主要治愈手段[5]。NSCLC早期临床症状无明显特异性,确诊时多为中晚期而失去手术治疗机会[6]。目前临床上多采用放化疗、免疫疗法、分子靶向疗法等进行治疗,其中分子靶向疗法可有效延长患者生存期[7],因此寻找NSCLC靶向标志物能为肺癌治疗提供新的思路和方向。
miRNAs是一类具有重要生物学功能的小分子单链RNA,近年来大量研究证实多种miRNAs在恶性肿瘤发展过程中起作用[8-10]。miR-92a是miRNAs家族成员,位于13号染色体上,目前已经发现其在多种恶性肿瘤中异常表达[11]。有学者发现miR-92a在髓母细胞瘤中表达较高,且主要通过下调MMP蛋白抑制剂表达从而促进肿瘤细胞迁移[12]。还有学者在体外实验中下调乳腺癌细胞中miR-92a表达,发现细胞增殖、迁移、侵袭能力增强,提示miR-92a在乳腺癌中可能起到抑癌作用[13]。本研究结果显示,NSCLC组织中miR-92a相对表达量高于正常组织,提示miR-92a在NSCLC组织中表达上调。有学者采用原位杂交和PCR技术分析了多种NSCLC细胞系(H2170,SPC-A1,A549)中miR-92a表达,发现其均高于正常支气管上皮细胞中miR-92a表达[14],提示miR-92a在NSCLC细胞中呈过表达,可能在NSCLC中起到促癌作用,与本次研究结果类似。而分析miR-92a表达与NSCLC患者临床病理因素发现,TNM分期T3+T4期、中低分化、淋巴结转移的NSCLC患者癌组织中miR-92a m RNA相对表达量分别高于T1+T2期、高分化、淋巴结未转移者,提示miR-92a表达与NSCLC临床分期、分化程度和淋巴结转移有关,提示miR-92a可能参与了NSCLC的增殖生长和转移过程。为了进一步证实miR-92a在NSCLC中所起作用,本次通过在体外实验中构建体miR-92a高表达和低表达的NSCLC细胞系,发现上调miR-92a表达后细胞增殖和迁移能力均增强,而下调miR-92a表达后细胞增殖和迁移能力均降低,提示miR-92a可促进NSCLC细胞的增殖和迁移。还有研究发现miR-92a可促进NSCLC细胞对顺铂的耐药性,影响放化疗效果[15],有学者发现miR-92a在肺癌A549细胞的表达上调,且下调其表达后细胞增殖水平和血管生成标志物血管内皮生长因子(vascular endothelial growth factor,VEGF)表达量也降低,提示miR-92a可促进NSCLC进展[16]。以上结果表明miR-92a在NSCLC中发生发展过程中起到致癌作用。目前关于miR-92a参与NSCLC发生发展相关机制尚不明确。有学者发现miR-92a能靶向调节PTEN/PI3K/Akt通路抑制细胞自噬来促进鼻咽癌细胞存活,这可能是提高NSCLC细胞活性和增殖水平的原因之一[17]。还有学者研究发现,miR-92a能通过上调MMP-2、MMP-9表达促进直肠癌细胞的迁移能力[18],但miR-92a影响NSCLC细胞增殖和迁移相关作用机制有待进一步研究和论证。
综上所述,miR-92a在NSCLC组织中表达上调,且与患者临床病理相关,下调miR-92a表达可抑制NSCLC细胞的增殖、转移能力。因此通过本次研究我们初步验证了miR-92a在可促进NSCLC的发展,这可能为NSCLC的临床诊疗提供新的思路和治疗靶点。
利益冲突所有作者均声明不存在利益冲突
