3-乙酸齐墩果酸对非小细胞肺癌细胞的影响及相关机制研究
2021-09-13齐阿寅赖永新纪春东
齐阿寅 赖永新 纪春东
辽健集团阜新矿总医院呼吸内科 123000
肺癌为世界范围内发病率和病死率最高的恶性肿瘤疾病[1],且呈现逐年上升和低龄化的趋势[2],非小细胞肺癌(non-small cell lung cancer,NSCLC)为其中的主要亚型,占肺癌总例数的80%~90%[3]。目前,手术结合放化疗仍为其主要治疗手段[4],然而,由于肿瘤细胞的耐药以及放化疗较大的不良反应,导致多数患者预后较差、生存质量欠佳,因此寻求疗效好、不良反应低的替代治疗药物成为目前亟待解决的难题[5]。近年来,天然提取物凭借其高效低毒的特点,已逐步成为抗肿瘤药物研究的热点。齐墩果酸(oleanolic acid,OA)为人参中的次要活性成分之一,是一种五环三萜类天然化合物,国内外已有研究[6-7]表明其具有良好的抗炎、抗氧化、保肝、降血糖和抗肿瘤等多种活性。c-Jun氨 基 末 端 激 酶(c-Jun N-terminal kinase,JNK)信号转导通路亦称为应激活化蛋白激酶(stress-activated protein kinase,SAPK)通路,是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路的重要分支之一,在细胞增殖、分化、凋亡及应激等多种生理病理过程中均发挥关键作用[8]。因此,本研究以OA为基础合成了其乙酸化衍生物——3-乙酸齐墩果酸(oleanolic acid 3-acetate,OA3A),观察其对A549细胞增殖和凋亡的影响,并探究其可能的分子机制。
1 材料与方法
1.1 主要试剂RPMI 1640培养基、胎牛血清(fetal bovine serum,FBS)、胰蛋白酶、乙二胺四乙酸(EDTA):美国Gibco公司;二甲亚砜(DMSO)、磷酸盐缓冲液(phosphate buffer solution,PBS)、RIPA裂解液、MTT:北京索莱宝科技有限公司;BCA蛋白测定试剂盒:上海碧云天生物技术有限公司;磷酸化活化形式(p-JNK)、JNK抗体:美国Abcam公司;Bax、裂解半胱天冬酶3(cleaved-Caspase 3)、Bcl-2、β-actin兔多克隆抗体:美国Santa Cruz公司。实验性研究。
1.2 主要仪器 流式细胞仪,德国Partec公司;透射电子显微镜:日本Olympus公司;超净工作台:北京东联哈尔仪器制造有限公司;细胞培养箱:Thermo Fisher Scientific;超低温冰箱:美国Thermo Scientific公司;离心机:美国Sigma公司;酶标仪:美国Thermo Scientific公司。
1.3 实验方法
1.3.1 细胞培养肺癌A549细胞 由辽健集团阜新矿总医院医学中心实验室细胞库提供,将复苏的A549细胞培养于含10%FBS+1%青链霉素双抗的RPMI 1640培养基中,置于37℃、5%CO2培养箱中培养,每3天更换1次培养基,待细胞贴壁生长至融合85%左右时,以0.02% EDTA+0.25%胰蛋白酶消化传代,分瓶培养或进行后续实验。
1.3.2 药物配制及分组 称取适量OA3A粉末溶于DMSO中,配制成浓度为10 mg/ml的母液,再以完全培养基稀释成高(40 mg/L)、中(20 mg/L)、低(10 mg/L)浓度的工作液,实验共分 为 对 照 组、0.5% DMSO组、10 mg/L、20 mg/L和40 mg/L OA3A组。
1.3.3 MTT法检测细胞生存率 取对数生长期的A549细胞,以完全培养基制备成密度为1×104个/ml的细胞悬液,接种于96孔板中,每孔各100μl,每组各设置6个复孔,待细胞贴壁生长24 h后,分别按上述分组各加入100μl工作液,继续孵育24 h,吸弃上清,加入5 mg/ml的MTT溶 液20μl,孵 育4 h后 吸 弃 上 清,以100μl DMSO溶解结晶,震荡10 min,于490 nm下检测各孔的吸光度值(OD)。
1.3.4 流式细胞术检测细胞凋亡率 将A549细胞以1×106个/ml的密度接种于6孔板中,每孔100μl,贴壁生长24 h后,按上述分组各加入100μl工作液,继续孵育24 h,以不含EDTA的胰蛋白酶消化细胞,PBS洗涤两次并重悬细胞,取100μl单细胞悬液,加入5μl Annexin V-FITC和10μl PI,震荡混合均匀,于室温下避光孵育15 min,使用流式细胞仪分别在525 nm(Annexin V-FITC)和610 nm(PI)波长下检测荧光强度。
1.3.5 Western Blot检测 JNK通路活性和凋亡相关蛋白的表达按前述方法对各组细胞进行给药处理,培养24 h后用细胞裂解液进行裂解,提取总蛋白,BCA法测定蛋白浓度。取30μg蛋白上样,12%十二烷基磺酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳分离蛋白,转移至PVDF膜上,封闭1 h,于4℃下加入一抗p-JNK(1∶1 000)、JNK(1∶1 500)和β-actin(1∶2 000)孵育过夜,PBS洗涤3次,加入HRP标记的二抗(1∶10 000)后继续孵育1 h,PBS洗膜,加入ECL显影后于凝胶成像系统内曝光,应用Image Lab软件对图像进行分析并测定灰度值。
1.4 统计学分析 采用SPSS 22.0软件进行统计分析,计量资料以±s表示,多组间比较采用单因素方差分析(ANOVA),两两相比采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞存活率 各组A549细胞存活率情况:10 mg/L、20 mg/L和40 mg/L OA3A组的细胞存活率均显著低于对照组(P<0.05);3组OA3A组之间两两相比,细胞存活率差异均有统计学意义(P<0.05),随着OA3A浓度的增加,细胞存活率逐渐降低。见表1,图1。

图1 各组细胞存活率比较(n=6)
2.2 细胞凋亡率 与对照组比较,10 mg/L、20 mg/L和40 mg/L OA3A组的细胞凋亡率均较高(P<0.05);3组OA3A组之间两两相比,细胞凋亡率差异有统计学意义(P<0.05),随着OA3A浓度的增加,细胞凋亡率逐渐升高,见表1,图2。

图2 各组细胞凋亡率比较(n=6)
2.3 JNK通路活性 与对照组比较,10 mg/L、20 mg/L和40 mg/L OA3A组的p-JNK的相 对 表达均较高(P<0.05);且随着OA3A浓度的增加,p-JNK的相对表达逐渐升高(P<0.05);而各组之间JNK的相对表达差异无统计学意义(P>0.05),见表1,图3。
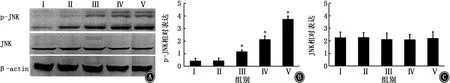
图3 p-JNK和JNK的相对表达(n=6) A:各组p-JNK、JNK蛋白电泳图;B:各组p-JNK蛋白表达;C:各组JNK蛋白表达
表1 各组细胞存活率细胞凋亡率和JNK通路活性比较(±s)

表1 各组细胞存活率细胞凋亡率和JNK通路活性比较(±s)
注:与对照组比较,a P<0.05;与0.5% DMSO组比较,b P<0.05;与OA3A 10 mg/L组比较,c P<0.05;与OA3A 20 mg/L组比较,d P<0.05
组别 细胞数 细胞存活率 细胞凋亡 p-JNK相对表达 JNK相对表达对照组 6 100.05±2.12 3.41±0.82 0.49±0.21 2.14±0.61 0.5%DMSO组 6 101.09±3.45 3.21±0.95 0.51±0.17a 2.17±0.57 OA3A10 mg/L组 6 91.20±2.04ab 15.89±4.61ab 1.13±0.12ab 2.08±0.59 OA3A20 mg/L组 6 81.38±5.67abc 37.16±5.48abc 2.23±0.20abc 2.09±0.51 OA3A40 mg/L组 6 75.11±7.48abcd 51.23±7.23abcd 3.89±0.18abcd 2.15±0.63 F值 35.973 129.842 388.123 0.027 P值 <0.001 <0.001 <0.001 0.998
2.4 凋亡相关蛋白的表达 与对照组比较,OA3A组中促凋亡相关蛋白Bax和c-Caspase 3的相对表达均显著上升(P<0.05),而抗凋亡相关蛋白Bcl-2的相对表达均显著降低(P<0.05);随着OA3A浓度的增加,Bax和c-Caspase 3的相对表达亦相应升高(P<0.05),而Bcl-2的相对表达相应降低(P<0.05),见表2和图4。

图4 凋亡相关蛋白的相对表达(n=6) A:各组Bax、c-Caspase和Bcl-2蛋白电泳图;B:各组Bax、c-Caspase和Bcl-2蛋白表达柱状图
表2 各组细胞凋亡相关蛋白的表达比较(±s)

表2 各组细胞凋亡相关蛋白的表达比较(±s)
注:与对照组比较,a P<0.05;与0.5% DMSO组比较,b P<0.05;与OA3A 10 mg/L组比较,c P<0.05;与OA3A 20 mg/L组比较,d P<0.05
组别 细胞数 Bax c-Caspase-3 Bcl-2对照组 6 0.59±0.29 0.23±0.19 0.98±0.26 0.5%DMSO组 6 0.57±0.27 0.22±0.17 0.99±0.23 OA3A10mg/L组 6 0.89±0.15a 0.46±0.30ab 0.62±0.17ab OA3A20mg/L组 6 1.37±0.14abc 0.88±0.25abc 0.33±0.11abc OA3A40mg/L组 6 1.94±0.27abcd 1.41±0.31abcd 0.12±0.09abcd F值 37.491 24.571 26.528 P值 <0.001 <0.001 <0.001
3 讨论
目前临床对于NSCLC的治疗方案主要以手术切除、放疗、化疗以及免疫治疗相结合为主[9],尽管外科手术方式、放疗技术以及靶向药物不断推陈出新,但肺癌患者预后及转归仍不理想[10]。临床常用治疗药物在杀死肿瘤细胞的同时,也杀伤了体内正常细胞,带来了巨大的不良反应,制约了其进一步的治疗[11]。
OA是广泛存在于齐墩果、青叶胆、女贞子、人参等植物中的天然五环三萜化合物,具有抗炎、保肝降酶、强心利尿、降血糖、调节血脂和抗肿瘤等多种活性[12],Li等[13]报道称,OA可通过调节细胞凋亡和细胞周期进程而抑制胆囊癌细胞的增殖;Zhao等[14]的研究则表明,OA可通过miR-122/Cyclin G1/MEF2D信号通路诱导肺腺癌细胞周期的阻滞,而实现抗肿瘤活性。然而,OA较差的水溶性限制了其应用的进一步拓展,因此本研究基于OA的分子结构合成了一种新的衍生物——OA3A,通过MTT实验和流式细胞术,观察其对A549细胞的影响。实验结果显示,OA3A抑制了A549细胞的增殖,促进了其凋亡,且这种作用呈剂量依赖性。Jo等[15]最新的研究表明,OA3A可通过不依赖活性氧(reactive oxygen species,ROS)的线粒体途径,诱导卵巢癌和子宫内膜癌细胞的凋亡,OA3A可作为一种潜在的抗肿瘤辅助用药。
为进一步探究OA3A抑制A549细胞增殖和诱导其凋亡的分子机制,笔者采用Western blot检测了JNK通路的活性,结果显示,OA3A可促进JNK的磷酸化,而活化的JNK通路可借助于转录依赖的方式调节凋亡相关蛋白的表达而诱导A549细胞的凋亡。对凋亡相关蛋白表达的检测结果显示,JNK下游促凋亡靶基因Bax和c-Caspase 3的表达显著上调,而抗凋亡相关基因Bcl-2则显著下调,提示JNK通路参与了OA3A诱导A549细胞凋亡的过程。Bax为人体中最主要的促凋亡基因之一,广泛分布于血管、支气管平滑肌细胞、肝细胞、上皮细胞中,可通过促进细胞色素C(cytochrome c,cyt-C)自线粒体向胞质释放而激活Caspase 9,进而激活其下游凋亡关键基因Caspase 3,从而启动凋亡程序[16]。Bcl-2为公认的抗凋亡基因,主要分布于核膜、内质网及线粒体膜上,可通过改变线粒体巯基的氧化还原状态、调节线粒体膜对凋亡基因前体的通透性等途径阻止自由基、射线以及各种化疗药物介导的细胞凋亡[17]。促凋亡和抗凋亡基因之间的维持动态平衡,共同调节凋亡的诱发和进展。夏荣木等[18]的研究报道称,OA可诱导A549细胞的凋亡,其作用机制可能与促进促凋亡相关因子Bax、tBid、c-Caspase 3的表达、抑制抗凋亡相关因子Bcl-2、Bcl-xl的表达有关。钟方明等[19]的研究显示,随着食管癌KYSE150和EC109细胞凋亡率的增加,Bax、Bak和c-Caspase 9的表达显著增加,而Bcl-2的表达显著降低,提示JNK通路可能参与了食管癌细胞的凋亡过程。
综上,本研究显示,OA3A可抑制A549细胞的增殖,诱导其凋亡,可作为一种潜在的抗NSCLC的药物,其作用机制可能是通过JNK通路实现的。
利益冲突所有作者均声明不存在利益冲突
