利用Na2CO3处理铝电解槽炭渣的研究
2021-09-12赵润民彭建平狄跃忠王耀武
梁 诚,赵润民,彭建平,狄跃忠,王耀武
东北大学冶金学院,沈阳 110819
Na3AlF6-Al2O3熔盐电解铝法,也称Hall-Héroult法,作为现代制备金属铝的唯一工业方法,一直被沿用至今. 该法以固体氧化铝为原料,将其溶解在以钠冰晶石为主的氟化物熔盐中,形成具有良好导电性的均匀熔体,在930~960 ℃下通入直流电进行电解[1]. 铝电解生产中,由于炭阳极的选择性氧化以及侧面掉渣、阴极剥落和电解质中发生的二次反应,不可避免地产生炭渣,其中阳极炭渣是电解槽内炭渣产生的主要来源.
现代电解铝厂大部分采用预焙阳极电解槽,其预焙阳极是由石油焦和黏结剂沥青组成[2]. 炭阳极表面的沥青黏结剂具有较大的化学活性,被优先电化学氧化. 石油焦由于消耗速度较慢,逐渐凸出于阳极,在电解质冲蚀下脱落;另一方面,在电解过程中,电解质和铝液的侵蚀会引起炭阴极的剥落;电解质中溶解Al将阳极产生的部分CO2还原成游离的固定炭[3],也会产生少量炭渣. 电解质中的大量炭渣会极大地影响铝电解的生产[4-12],具体表现为:增加电能消耗,产生热槽;造成阳极长包和侧部漏电,对电解槽生产极为不利;电解槽长期处于过热状态下运行,会加快阳极氧化和阴极破损速度,甚至缩短电解槽的寿命. 所以,技术人员需要定期打捞电解槽中的炭渣,以减少其对电解铝生产的危害.
据统计,每生产1 t原铝约产生10 kg的炭渣.我国2019年原铝产量高达3504万吨,因此其炭渣产生量约为35万吨. 参考《国家危险废物名录》(2016版),炭渣属于危险废物. 其类别为HW48(有色冶金危险废物),具有全空间污染和潜伏性污染等特征. 炭渣浸出液F-含量可达 3000 mg·L-1,大大超出排放标准. 对炭渣处置不当会导致大气、水体、土壤的污染,甚至对人们的健康造成威胁,所以炭渣的处理问题亟需解决[13-14]. 目前,国内公开报道的炭渣处理方法主要有浮选法[15-18]、真空冶炼法[19-20]和焙烧法[21-23]. 浮选法处理炭渣的原理是将炭渣磨细至一定粒度,与浮选剂搅拌混合,最后加入到浮选机并通入空气. 在通入空气的过程中,可浮的物料随着气泡上浮至矿浆上方,形成溢流炭粉,从而实现炭与电解质分离. 但浮选电解质精矿品位往往低于90%,炭精矿含碳量一般低于80%. 另外,浮选废水中的F-含量高,可能造成二次污染. 焙烧法处理炭渣的原理是将炭渣在一定温度下焙烧,使炭渣中的炭、氢等可燃物充分燃烧,所得焙烧产物即为电解质,从而实现炭渣中电解质与炭分离的目的. 但高温焙烧会产生含F废气,造成二次污染问题,而且炭渣中的炭燃烧不彻底. 真空冶炼法处理炭渣的原理是将炭渣磨成细粉,然后加入合适的黏结剂压制成团,最后置入在真空炉中冶炼. 利用电解质在高温下的易挥发特性,电解质在真空炉上部冷却凝结,而炭留在罐体中. 但是真空冶炼法处理后的残余渣中炭含量在70%左右,加上工艺的成本太高,限制了该法的应用. 本文提出一种新的炭渣处理方法,以期提高炭渣中炭和电解质的分离效率,实现炭渣的无害化和资源化.
1 试验
1.1 试验原料
试验所用炭渣来源于山东某电解铝厂. 所用Na2CO3为分析纯试剂(国药). 表1 描述了两份炭渣样品的化学成分,图1和图2分别为样品1的X射线衍射物相分析和扫描电镜-能谱(SEM-EDS)分析结果. 由表1可知,该炭渣主要由C、Na、Al、F、K、Li等元素组成,其中C元素的质量分数接近30%. 由图1可知,炭渣的主要成分为C、Na3AlF6、Na5Al3F14和Al2O3.
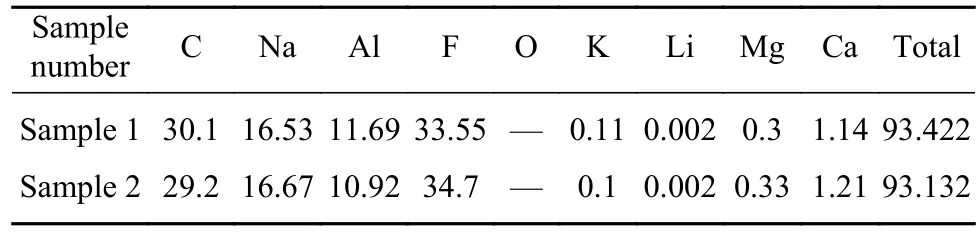
表1 炭渣主要成分(质量分数)Table 1 Main components of carbon residue %

图1 样品1的X射线衍射物相分析Fig.1 X-ray diffraction phase analysis of sample 1
由图2可知,大部分炭渣中的电解质和炭不是独立存在的,在不同区域内以不同方式结合. 在电解质含量较低区域,少量的电解质嵌入石墨片层内部,使其由紧密规则的层状结构变得疏松;在电解质含量较高的区域,电解质将该区域内少量的层状石墨完全包裹. 如果可以打破炭和电解质之间的紧密结合,浮选法、焙烧法等方法将会成为现阶段处理炭渣的有效方法.

图2 样品1的SEM-EDS图Fig.2 SEM-EDS images of sample 1
1.2 试验方法
试验具体流程如图3所示. 首先将铝电解槽炭渣粉碎,制成粒径小于0.074 mm的粉碎炭渣.将粉碎炭渣与Na2CO3添加料按照一定的比例混合均匀后置于电阻炉中升到特定温度,保温一定时间. Na2CO3与炭渣中的电解质反应,待冷却后的混合渣与水混合后,调节浸出液的pH,使浸出液的Al以铝酸钠的形式转移到液相中,F以氟化钠的形式转移至液相中;然后浸出液经过过滤、水洗烘干后制成炭粉. 向滤液中通入CO2后经过过滤和烘干得到冰晶石. 二次滤液中主要成分为Na2CO3,通过蒸发结晶回收后可返回至添加料中.通过扫描电镜观察炭粉和冰晶石的微观形貌,通过X射线衍射仪对焙烧后混合料和产物进行物相分析,从而研究焙烧以及水浸试验机理.

图3 炭渣焙烧-水浸试验流程图Fig.3 Flow chart of carbon residue roasting-water immersion test
1.3 试验原理
本试验的原理图如图4所示. 炭渣中的电解质与Na2CO3在高温下反应,转变为可浸出的NaF、NaAlO2,反应式如(1)~(4)所示. 焙烧后的混合料加水浸出,固液分离后的固体烘干后获得炭粉. 其NaF、NaAlO2、Na2CO3组分转移至滤液,然后利用碳酸化法对滤液中的F-进行回收,反应式如(5)所示[24].

图4 炭渣焙烧-水浸试验原理图Fig.4 Principle diagram of carbon residue roasting-water immersion test

采用HSC 6.0软件的Reaction Equations模块的计算功能,制作焙烧过程可能发生反应(1)~(4)的标准吉布斯自由能变(ΔG)与温度(T)关系图,结果如图 5所示. 由图 5可知,反应(1)~(4)的吉布斯自由能变在800 ℃以上都为负值且随着温度的升高变得越来越负,所以在高于800 ℃的焙烧温度条件下,上述反应在热力学上可自发进行,并且温度升高有利于反应(1)~(4)正向进行.

图5 焙烧试验主要反应热力学计算曲线Fig.5 Main reaction thermodynamic calculation curve of roasting test
2 结果与讨论
2.1 焙烧后混合料的分析
将质量比为2.5∶1的Na2CO3与炭渣混合均匀后置于坩埚电阻炉中,在950 ℃下焙烧2 h,焙烧后混合料的物相组成如图6所示. 由图6可知,炭渣与Na2CO3焙烧后混合料由C、Na2CO3、NaF、NaAlO2组成,而炭渣中的氧化铝、冰晶石和亚冰晶石几乎完全被Na2CO3消耗.

图6 焙烧混合料的X射线衍射物相分析Fig.6 X-ray diffraction phase analysis of roasted mixture
图7为炭渣和焙烧后混合料的面扫描分析,其中C和F分别为炭和电解质的特征元素. 由图7可知,炭渣中的C在扫描区域内分布不均匀,而C表面包裹的电解质与Na2CO3反应后脱落,所以焙烧后物料中的C在整个扫描范围内均匀分散分布;F元素也从冰晶石和亚冰晶石相转移到氟化钠相中,逐渐扩散至整个区域.

图7 炭渣(a)和焙烧混合料(b)的 SEM-EDS 图Fig.7 SEM-EDS mapping of carbon residue (a) and roasted mixture (b)
2.2 浸出试验条件分析
对焙烧后混合料进行水浸试验. 在浸出过程中,焙烧后混合料中的NaF、NaAlO2转移至溶液,从而实现电解质和炭的分离. 焙烧后混合料的浸出液主要由 Na2CO3、NaF、NaAlO2组成,其中 NaAlO2极易水解产生Al(OH)3. NaAlO2的水解不仅降低炭粉纯度,还会降低冰晶石的产率. 根据水溶液热力学计算原理,采用 HSC Chemistry6.0绘制 25、50、75和 100 ℃下Al-H2O系的E-pH图,其中E为平衡电极电位,如图8所示,并探究温度对NaAlO2水解过程的影响.
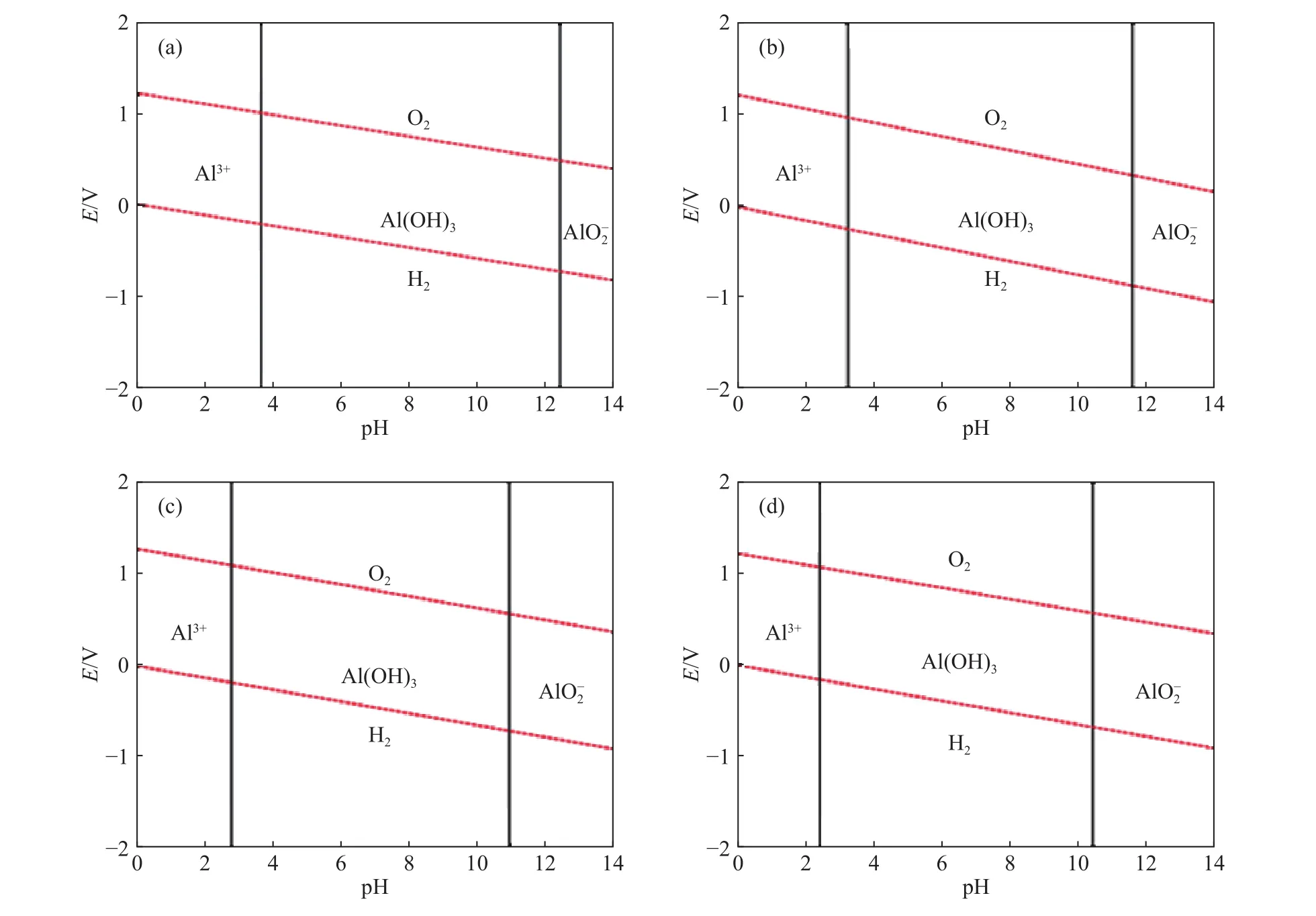
图8 不同温度下 Al-H2O 的 E-pH 图. (a)25 ℃;(b)50 ℃;(c)75 ℃;(d)100 ℃Fig.8 E-pH diagram of Al-H2O at different temperatures: (a) 25 ℃; (b) 50 ℃; (c) 75 ℃; (d) 100 ℃
由图 8 可知,当 pH<3.8时 (25 ℃),Al以 Al3+的形式存在于溶液中;随着pH的升高,Al以Al(OH)3的形式从溶液中析出;当pH升高至12.5时,Al以的形式存在于溶液中. 另外,随着温度的升高,Al(OH)3的稳定存在区域发生明显变化. 当浸出温度为100 ℃时,Al(OH)3可以在2.3~10.4的pH范围内稳定存在. 当浸出液为碱性时,升高浸出温度会提高NaAlO2的稳定性,从而提高炭粉的纯度.
2.3 焙烧试验条件分析
2.3.1 保温时间
为了确定炭渣与Na2CO3混合料焙烧时保温时间,首先对950 ℃下反应后混合料质量损失(Δm)与保温时间的关系进行测量,结果如图9所示.

图9 950 ℃时保温时间与混合料质量损失的关系Fig.9 Relationship between the holding time and mass loss of the mixture at 950 ℃
由图9可知,随着炭渣中电解质与Na2CO3反应的进行,反应体系中CO2溢出造成的质量损失也逐渐增加. 当反应时间为0.5 h时,不同反应物配比的混合料质量损失明显. 当保温时间大于2 h时,混合料质量损失趋于稳定. 为了更深入研究保温时间对炭渣与Na2CO3反应的影响,混合料保温时间选择在0.5~2 h范围内.
2.3.2 焙烧温度
为了确定炭渣中电解质与Na2CO3混合料的焙烧温度,首先对焙烧2 h后混合料质量损失与焙烧温度的关系进行测量,结果如图10所示.

图10 焙烧2 h时焙烧温度与混合料的质量损失的关系Fig.10 Relationship between the roasting temperature and mass loss of the mixture at 2 h roasting
由图10可知,随着混合料焙烧温度的升高,反应体系中CO2溢出造成的质量损失也逐渐增加,混合料质量损失主要在750~950 ℃范围内. 根据热力学分析可知,焙烧温度在800 ℃以下时,反应(3)上不能自发进行,所以体系在800 ℃以下未反应完全. 为了更深入研究焙烧温度对炭渣与Na2CO3反应的影响,混合料焙烧温度选择在800~950 ℃范围内. 为了保证炭渣中电解质与Na2CO3反应完全,焙烧试验选择Na2CO3和炭渣的质量比为2.5∶1.
2.3.3 浸出时间
为了确保焙烧后混合料的非炭相在水浸过程中最大程度地转移至液相,即保证炭粉纯度最大,需要确定浸出时间以及浸出温度. 分析图8可知,选择浸出试验中浸出液pH为13. 焙烧试验选择Na2CO3和炭渣的质量比为2.5∶1、焙烧温度为950 ℃、保温时间为2 h,对不同浸出温度下炭粉纯度与浸出时间的关系进行测量,结果如图11所示.

图11 浸出时间与炭粉纯度的关系Fig.11 Relationship between leaching time and carbon powder purity
由图11可知,在不同温度下碱浸焙烧后混合料时,随着浸出时间的延长,炭粉纯度提高. 在浸出时间小于1 h时,浸出温度越高,炭粉纯度越高.为了减少浸出试验的能耗,浸出试验的温度选择25 ℃,时间选择1 h.
2.4 炭粉的回收
确定水浸试验的浸出液pH为13,浸出温度为25 ℃,浸出时间为1 h后,在不同焙烧条件下进行八组试验,具体试验参数及结果如表2所示.
由表2可知,当Na2CO3和炭渣质量比为2.5∶1、保温时间为1 h,焙烧温度从800 ℃升高到950 ℃时,炭粉纯度从55%提高到84%. 由图5可知,当温度高于400 ℃时,Na2CO3可以与冰晶石等电解质反应,产物可能有Al2O3. 当温度进一步升高到800 ℃以上时,Al2O3可以与Na2CO3继续反应,其最终产物为NaAlO2. 所以提高焙烧温度,夹杂在炭粉产物中Al2O3含量降低,炭粉纯度明显提高. 图12为试验Ⅷ所得炭粉的XRD分析结果. 由图12可知,试验Ⅶ与Ⅷ所得炭粉中主成分为C. 当Na2CO3和炭渣质量比为2.5∶1、焙烧温度为950 ℃,保温时间从1 h延长到2 h,炭粉中冰晶石相的特征峰明显减弱,炭粉纯度从84%提高到89%. 结合图9和图10可知,适当地提高焙烧温度和延长保温时间提高了炭渣中C和电解质的分离效率,从而提高炭粉纯度.
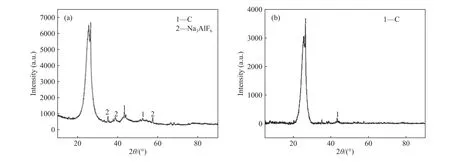
图12 试验Ⅶ(a)和Ⅷ(b)所得炭粉的X射线衍射物相分析Fig.12 X-ray diffraction phase analysis of carbon powder obtained in Ⅶ(a) and Ⅷ(b)

表2 炭渣焙烧试验参数及炭粉产物纯度Table 2 Roasting test parameters of carbon residue and purity of carbon powder
图13为用碳酸化法制取冰晶石产物的XRD图. 从图13可以看出,试验Ⅷ所得冰晶石产物的主成分为正冰晶石(Na3AlF6). 经过检测,试验制得的冰晶石元素质量分数(用w表示):w(F)=53.4%,w(Na) =25.2%,w(A1) =13.2%,其分子比为2.2.
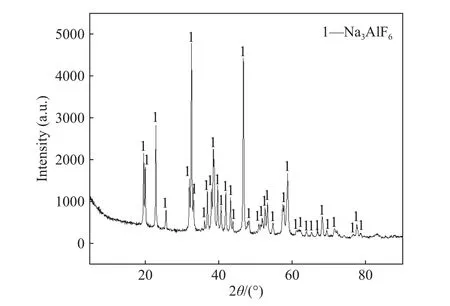
图13 试验Ⅷ所得冰晶石的X射线衍射物相分析Fig.13 X-ray diffraction phase analysis of cryolite obtained in Experiment Ⅷ
图14(a)和(b)为试验Ⅷ所得炭粉的SEM图.由图14(a)和(b)可知炭表面包裹的电解质层基本脱落,炭粉的层状结构明显. 但炭层间的电解质相依然少量存在,可以考虑提高焙烧温度,减小炭渣粒度等方式进一步提高炭粉的纯度.

图14 试验Ⅷ所得炭粉(a, b)和冰晶石(c, d)的SEM图Fig.14 SEM images of carbon powder (a, b) and cryolite (c, d) obtained from test Ⅷ
冰晶石可分为粉状、粒状、砂状冰晶石. 粉状冰晶石的分子比可达1.75~2.5,有较好的可调性,能满足特殊行业的要求;粒状冰晶石流动性好,分子比在2.5~3.0之间,适合电解铝的启槽;砂状冰晶石的分子比可在较大范围内调节,熔点低且熔化速度快. 图 14(c)和(d)为试验Ⅷ所得冰晶石的SEM 图. 由图 14(c)和(d)可知,冰晶石颗粒表面光滑,呈不规则形态;其粒径大部分小于1 μm,存在明显的颗粒间团聚现象. 由冰晶石分子比以及其颗粒粒径判断,试验Ⅷ制取的冰晶石属于粉状冰晶石,可以直接返回铝电解槽中.
3 结论
(1)炭渣主要由 C、Na3AlF6、Na5Al3F14和少量的Al2O3组成. 炭渣中的电解质与炭主要以两种方式结合,在电解质含量较高的区域,大量电解质包裹着炭;在电解质含量较低的区域,少许电解质嵌入到炭的层状结构中. 为了分离炭渣中的炭和电解质,必须打破冰晶石等电解质相对炭相的包裹.
(2)利用Na2CO3焙烧-碱浸工艺处理炭渣可实现炭和电解质的分离. 当Na2CO3与炭渣的质量比为2.5∶1,保温时间为2 h,焙烧温度为950 ℃时,焙烧后混合料由 C、Na2CO3、NaF、NaAlO2组成,炭渣中氧化铝、冰晶石和亚冰晶石基本完全被Na2CO3消耗. 然后通过分析Al-H2O系的E-pH图以及试验验证,确定了在25 ℃下浸出1 h、浸出液pH为13的试验条件. 在此试验条件下,炭粉的纯度可达89%.
(3)适当地提高焙烧温度和延长保温时间可提高炭渣中炭和电解质的分离效率. 浸出液中F-通过碳酸化法进行回收,获得主成分合格的粉状冰晶石可直接返回至电解槽中. 本工艺无废气废水排放,可实现炭渣无害化与资源化.
