基于分子对接和内质网应激探讨老鼠簕生物碱A对小鼠急性肝损伤的作用*
2021-09-12梁英琴徐万鹏王红园韦秀桂孙雪梅周焕芳
梁英琴,徐万鹏,王红园,韦秀桂,孙雪梅,周焕芳,张 华,林 军
(1.广西医科大学药学院,南宁 530021;2.广西医科大学附属肿瘤医院药学部,南宁 530021)
肝脏是人体的重要器官,具有代谢、解毒和免疫等功能。当肝脏受到病毒、酒精和药物等毒素和外源性物质刺激时,可引起肝细胞损伤,从而触发炎症导致细胞坏死,构成肝脏疾病的重要发病基础[1]。肝损伤是一种严重的临床综合征,预后较差,可导致极高的死亡率,严重危害人民群众的生命健康。脂多糖(LPS)是革兰阴性细菌产生的一种内毒素,具有引起巨噬细胞活化和强致炎作用,是造成肝脏损伤的重要药物之一。研究表明,LPS 可引起小鼠体内氧化应激和炎症,造成肝脏损害[2]。
肝脏中富含内质网(endoplasmic reticulum,ER),ER 是细胞加工脂质、蛋白质和贮存钙离子的主要场所,也负责细胞外空间中蛋白的合成、修饰和释放[3]。当肝脏受到损伤时,肝细胞内环境平衡遭到破坏,蛋白质的正确折叠受阻,未折叠或错误折叠的蛋白质积聚在内质网中,从而诱发内质网应激(ERS)。近年来相关研究发现,ERS 可能是多种肝脏疾病的发病机制之一,受损的肝细胞可触发ERS 并导致肝细胞死亡[4]。因此,寻找减轻或者抑制ERS的有效药物,对于肝脏疾病的治疗具有重要意义。
老鼠簕生物碱A(4-羟基苯并噁唑-2-酮,HBOA)是本课题组从药用红树林植物老鼠簕(Acanthus ilicifolius L.)中提取出的一种活性单体[5]。本课题组前期研究结果表明,HBOA 具有良好的减轻炎症、抗肝纤维化的作用[6],但对于LPS所致小鼠急性肝损伤ERS的作用还不明确。因此,本研究采用LPS建立小鼠急性肝损伤模型,从而评估HBOA对肝损伤所致的EPS的潜在影响及机制。
1 材料与方法
1.1 药物和主要试剂 HBOA 由广西医科大学药学院药物化学教研室合成,纯度>98%。LPS(北京索莱宝科技有限公司);联苯双酯滴丸(北京协和药厂)。乳酸脱氢酶(LDH)试剂盒、谷胱甘肽(GSH)试剂盒(南京建成生物工程研究所);增强型BCA蛋白浓度检测试剂盒(碧云天生物技术公司);磷酸甘油醛脱氢酶(GAPDH)、葡萄糖调节蛋白78(GRP78)、C/EBP 同源体蛋白(CHOP)、半胱天冬酶12(Caspase-12)抗体(武汉三鹰生物技术有限公司);肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)抗体、白细胞介素1β(IL-1β)(博士德生物工程有限公司);二抗(美国LICOR公司)。
1.2 主要仪器 连续光谱扫描式酶标仪(美国Thermo Fisher公司);双色红外激光成像系统(美国Odyssey LI-COR公司);MICRO17R小型离心机(赛默飞世尔科技有限公司);SWB-20L-1恒温摇床(美国Major Science 公司);Olympus BX53 正置荧光显微镜;Nanodrop3000 微量核酸蛋白分析仪(美国Thermo Fisher 公司);MP-300V 电泳仪(美国Major Science 公司)。
1.3 实验动物 SPF 级健康KM 雄性小鼠,体重18~22 g,由广西医科大学实验动物中心提供,生产许可证号为:SCXK(桂)2020-0003,使用许可证号为:SYXK(桂)2020-0004。小鼠饲养环境控制温度为(23±2)℃,相对湿度为50%~70%,12 h/12 h光/暗循环。
1.4 分子对接 先从PubChem 数据库获取HBOA的三维分子结构,RCSB PDB数据库(http://www.rcsb.org/)获取GRP78、IL-1β、TNF-α、IL-6蛋白质三维结构PDB格式。通过Pymol 2.4软件对各分子进行去掉水分子、计算电荷等操作。其次使用Auto Dock Tools 1.5.6 软 件将HBOA 和GRP78、IL-1β、TNF-α、IL-6 蛋白结构的PDB 格式文档均转化为PDBQT 格式后进行分子对接。最后通过Pymol 软件分析对接结果并进行可视化分析,筛选出最优对接构象。
1.5 动物分组及急性肝损伤模型的建立 将小鼠随机分为6 组:正常组、模型组(LPS,10 mg/kg)、联苯双酯阳性药组(150 mg/kg)及HBOA 高、中、低剂量组(200 mg/kg、100 mg/kg、50 mg/kg),每组10 只。药物采用0.6%CMC-Na助溶,正常组和模型组小鼠用溶剂CMC-Na 灌胃,其余各组用相应药液灌胃,1 次/d,连续灌胃10 d。末次给药禁食不禁水12 h,除正常组外,其余各组均腹腔注射LPS(10 mg/kg)建立肝损伤模型。
1.6 样本采集与处理 腹腔注射LPS 6 h 后,乙醚麻醉并颈椎脱臼处死小鼠,取出肝脏并用预冷的生理盐水洗净表面,滤纸吸干表面液体,称取湿重量。切取每只小鼠的同一位置的肝脏小叶固定于4%多聚甲醛溶液中,剩下的肝脏分为4 份,保存于-80 ℃冰箱中。
1.7 肝脏LDH、GSH含量检测 将肝脏从-80 ℃冰箱取出,解冻,用预冷的生理盐水将其洗涤干净。用滤纸将黏附在组织上的生理盐水吸干后,切取适量组织,严格按照试剂盒说明书,对小鼠肝组织中LDH、GSH含量进行测定。
1.8 免疫组化法检测肝组织中IL-1β水平 肝组织切片经二甲苯脱蜡、水化后,加入柠檬酸修复液,3% H2O2灭活内源性过氧化物酶,10%山羊血清封闭,滴加一抗IL-1β(1:500),4 ℃条件下孵育过夜;次日加入二抗(1:10 000),37 ℃下孵育0.5 h,随后滴加DAB 显色液,苏木精复染,封片,置于显微镜下观察、拍照,细胞质内棕黄色颗粒表示蛋白阳性表达。用Image Pro plus 6.0 软件分析IL-1β 蛋白表达量,以平均光密度值表示蛋白的相对定量(平均光密度值=累积光密度值/阳性面积)。
1.9 Western blotting 法检测肝组织中GRP78、CHOP、Caspase-12、TNF-α 和IL-6 的表达 采用液氮从小鼠肝组织中提取出蛋白液,BCA蛋白测定试剂盒测定总蛋白浓度。按蛋白样本:SDS-PAGE 蛋白上样缓冲液(5×)=1∶4 的比例将其混匀后,沸水中煮5 min变性。蛋白样品采用10%十二烷基硫酸钠—聚丙烯酰胺凝胶进行电泳分离1.5 h,后转膜1.5 h 使蛋白转移到PVDF 膜上。将PVDF 膜置于TBST 中洗涤3 次,每次5min,然后转移到一抗中4 ℃下孵育过夜:GAPDH(1∶1 000)、GRP78(1∶1 000)、CHOP(1∶800)、Caspase-12(1∶800)、TNF-α(1∶1 000)、IL-6(1∶1 000)。孵育过夜的膜再用TBST 洗涤3 次后,放于二抗(1:10 000)中室温孵育1 h,最后再用TBST 洗涤3 次,立即用Odyssey 扫膜仪进行扫膜,用Image J2X 软件分析蛋白条带灰度值。以GAPDH 为内参,目的蛋白条带与相应内参条带灰度值的比值为蛋白相对表达量。
1.10 统计学方法 采用SPSS 21.0软件分析数据,计量资料用均数标准差()表示,多组间均数比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 分子对接结果 HBOA 与ERS 标志性蛋白GRP78 之间的结合能为-5.77 kcal/mol,HBOA 可与活性位点附近的GLU-202、ASP-35、THR-230、GLY-229、GLY-228、THR-38 这6 个氨基酸形成氢键结合到GRP78;HBOA 与TNF-α 之间的结合能为-5.83 kcal/mol,其可与活性位点附近VAL-150、LEU-93、HIS-15 这3 个氨基酸形成氢键结合到TNF-α;而HBOA与IL-1β之间的结合能为-5.48 kcal/mol,其可与活性位点附近LEU-26、LEU-82 这2 个氨基酸形成氢键结合到IL-1β;HBOA 与IL-6 之间的结合能为-5.36 kcal/mol,其可与活性位点附近VAL-154、PRO-152、LYS-85 这3 个氨基酸形成氢键结合到IL-6,见图1。
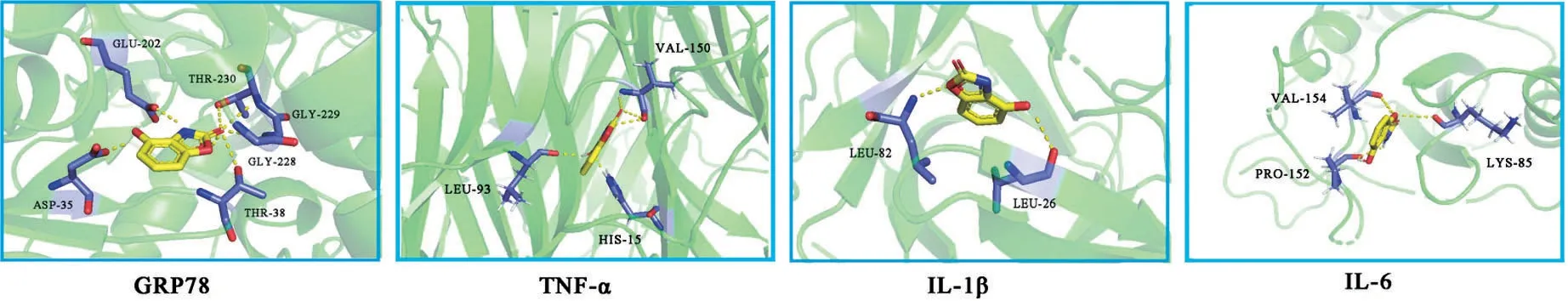
图1 HBOA与GRP78、IL-1β、TNF-α、IL-6对接后的最优构象图
2.2 HBOA 对小鼠肝组织中LDH、GSH 水平的影响 与正常组比较,模型组小鼠肝脏中LDH含量显著升高,GSH水平显著降低(均P<0.01);与模型组比较,阳性药组和HBOA 高、中剂量组中LDH 含量显著降低(P<0.01),而阳性药组和HBOA各剂量组中GSH含量显著升高(P<0.01),见表1。
表1 HBOA 对LPS 诱导的急性肝损伤小鼠肝组织LDH、GSH水平的影响,n=10
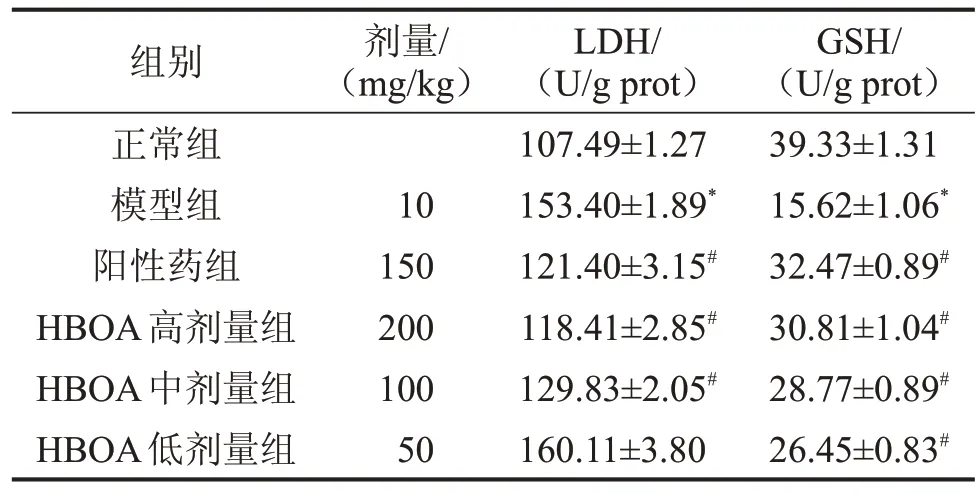
表1 HBOA 对LPS 诱导的急性肝损伤小鼠肝组织LDH、GSH水平的影响,n=10
与正常组比较,*P<0.01;与模型组比较,#P<0.01。
2.3 HBOA对急性肝损伤小鼠肝组织中IL-1β蛋白表达的影响 与正常组比较,模型组小鼠肝组织中出现大量的棕黄色颗粒,表明IL-1β 蛋白水平明显增加(P<0.01);与模型组比较,HBOA 给药组棕黄色颗粒显著减少,表明IL-1β 蛋白表达水平明显受到了抑制(P<0.01),见图2。2.4 HBOA 对急性肝损伤小鼠肝组织TNF-α、IL-6表达水平的影响 与正常组比较,模型组小鼠肝组织中TNF-α、IL-6 蛋白表达显著升高(P<0.01);与模型组比较,HBOA高、中、低剂量组小鼠肝组织中TNF-α、IL-6 蛋白表达水平显著降低(P<0.01),见图3、表2。2.5 HBOA 对急性肝损伤小鼠肝组织GRP78、CHOP和Caspase-12蛋白表达的影响 与正常组比较,模型组肝组织中的GRP78、CHOP、Caspase-12蛋白表达明显增加(P<0.01);与模型组比较,HBOA 高、中剂量组均显著降低小鼠肝组织中GRP78、CHOP、Caspase-12蛋白表达水平(P<0.01),见图4、表3。

图3 HBOA 对急性肝损伤小鼠肝组织TNF-α、IL-6 蛋白表达的影响
表2 HBOA 对急性肝损伤小鼠肝组织TNF-α、IL-6 蛋白表达的影响,n=3
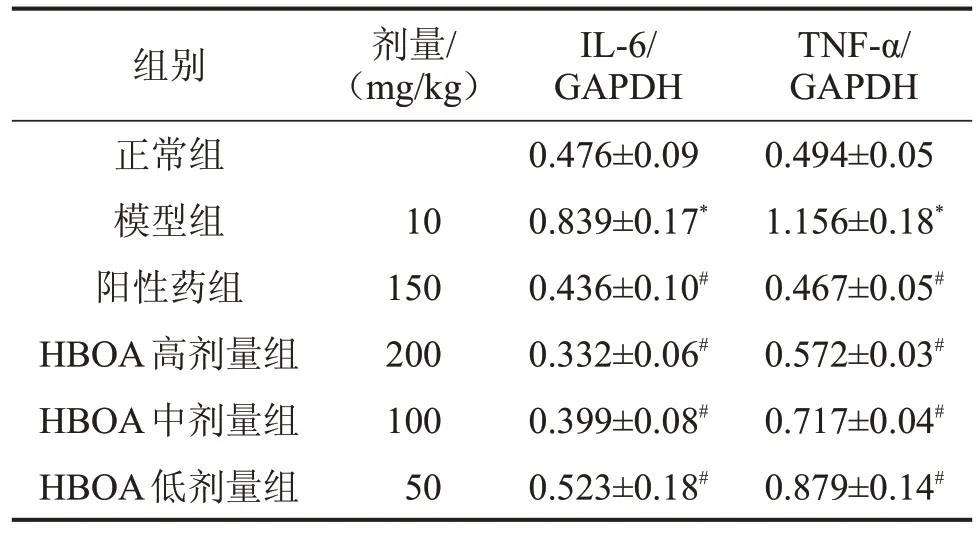
表2 HBOA 对急性肝损伤小鼠肝组织TNF-α、IL-6 蛋白表达的影响,n=3
与正常组比较,*P<0.01;与模型组比较,#P<0.01。

图4 HBOA 对急性肝损伤小鼠肝组织GRP78、CHOP、Caspase-12蛋白表达的影响
表3 HBOA对急性肝损伤小鼠肝组织GRP78、CHOP、Caspase-12蛋白表达的影响,n=3
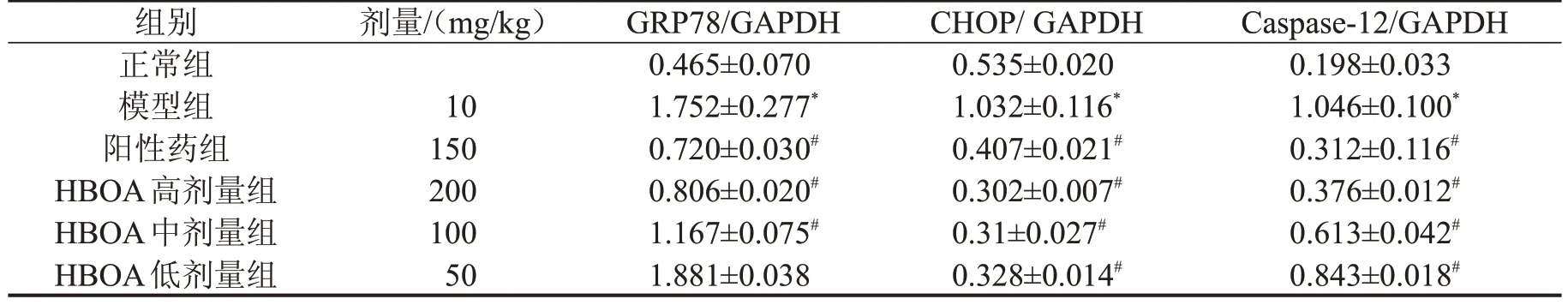
表3 HBOA对急性肝损伤小鼠肝组织GRP78、CHOP、Caspase-12蛋白表达的影响,n=3
与正常组比较,*P<0.01;与模型组比较,#P<0.01。
3 讨论
结合能反映受体与配体之间结合的可能性,结合能的高低能直接反映出受体与配体之间的亲和力和构象稳定性。一般情况下,两分子间的结合能小于0 kcal/mol时,视为有效对接。结合能越低,说明两个分子在自然状态下结合释放的能量越低,即更易于结合。分子对接结果表明,HBOA与ERS标志蛋白GRP78 和炎症相关蛋白(TNF-α、IL-1β、IL-6)之间的结合能均低于-5 kcal/mol,则具有良好的结合能力。以上提示了当炎症和ERS 发生时,HBOA 可能通过抑制GRP78、TNF-α、IL-1β、IL-6 的表达来减轻ERS 和炎症,但需要实验来进一步验证。
LPS 是革兰阴性菌外细胞壁的主要糖脂成分,通常情况下,部分释放的LPS 被门脉循环吸收,继而传递到肝脏后被迅速清除。因此,肝脏在LPS进入机体和代谢调节过程中起着中心作用。LPS可诱导急性炎症及一系列生化变化,如细胞因子和氧化应激增加,线粒体功能障碍,以及器官功能障碍等,与在人体中观察到的变化高度相似,因此LPS常被用于诱导啮齿类动物建立急性肝损伤模型[7]。
LDH水平是肝细胞毒性的一种酶标志物[8]。当肝细胞受损时,细胞膜通透性增加,导致LDH 泄漏增加,因此LDH水平高低在一定程度上反映肝脏的受损程度。本研究中,HBOA 高、中剂量可降低LDH水平,说明HBOA可以对抗LPS对肝脏的毒性作用而达到保肝效果。
抗氧化剂防御系统的损伤是LPS 诱导肝脏损伤的关键环节。有研究表明,LPS 对肝脏的损伤以特征组织病变和循环中抗氧化酶、抗氧化分子水平的变化为特征,如谷胱甘肽(GSH)。GSH 因具有清除自由基和抗氧化的特性,因此被认为是一种高效的抗氧化化合物。GSH对于活性氧具有中和作用,在多种细胞功能的调节过程中至关重要。有研究表明,持续充足的GSH水平可以减轻LPS诱导的肝损伤[9]。本研究发现,模型组小鼠肝组织中GSH 含量显著降低,表明LPS可使小鼠肝脏抗氧化能力降低;与模型组相比,HBOA 各给药组GSH 含量显著升高,提示HBOA在一定程度上逆转了LPS对肝脏抗氧化系统的损害。
LPS引起的肝损伤也与炎症介质紧密相关。据研究,LPS 可能激活转录因子NF-κB 导致许多炎症因子的激活,如TNF-α,IL-1β[10]。TNF-α、IL-1β等促炎细胞因子通过加速肝细胞凋亡而加重肝损伤,并与肝损伤的严重程度密切相关[11]。分子结果提示HBOA 可能通过与IL-1β、TNF-α、IL-6 蛋白结合,从而抑制炎症反应。免疫组化结果显示,HBOA 预处理可以降低LPS 诱导急性肝损伤小鼠肝组织中IL-1β蛋白水平;此外,Western blotting结果也表明HBOA 可降低模型组小鼠肝组织中TNF-α、IL-6 蛋白表达水平。提示HBOA 可能通过抑制炎症反应从而对肝脏起到保护作用。
当氧化应激、缺氧、细胞毒性物质等不利因素作用于细胞时,细胞内环境稳态遭受破坏,未折叠或错误折叠的蛋白积聚在内质网中,诱发ERS。ERS介导的凋亡是细胞内源性凋亡途径之一,有研究表明ERS 在急性肝损伤小鼠模型中发挥着重要的调节作用[12]。当发生ERS 时,未折叠蛋白反应(UPR)被激活以恢复内质网稳态,并降低机体损伤。适度的ERS 对细胞具有保护作用,但是,若应激信号严重或延长,内质网就会触发细胞死亡途径[13]。持续的ERS 会导致UPR 下游的促凋亡分子Caspase-12、CHOP 表达增加,引发细胞凋亡[14]。本实验中,分子对接结果表明HBOA与GRP78之间具有较强的结合力。此外,急性肝损伤小鼠肝组织中GRP78、CHOP、Caspase-12蛋白表达均上调,说明肝损伤过程中伴随着ERS的发生;而HBOA可以抑制这些蛋白的升高,提示HBOA 可以启动UPR 反应,减少未折叠或错误折叠的蛋白在ER 腔内累积,从而恢复内质网的内稳态平衡。
综上所述,HBOA 对LPS 所致的小鼠急性肝损伤具有一定的保护作用,其机制可能与恢复肝脏稳态、提高肝脏的抗氧化能力、抑制ERS、减轻炎症、减少肝细胞凋亡等相关。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- Effects of silencing NRP-1 on the growth and autophagy of cervical squamous cell carcinoma SiHa cells and the survival of tumorbearing nude mice
- 喜报:我校10项科技成果获2020年度广西科学技术奖
- miR-22-3p在妊娠期糖尿病患者胎盘外泌体中的表达及其对血管内皮细胞功能的影响*
- 黄芪甲苷对特发性胃瘫大鼠c-kit蛋白表达及Cajal间质细胞的影响*
- 杜仲黄酮对糖尿病小鼠胰腺线粒体功能的影响*
- 慢性HIV-1感染者CD8+T细胞活化和耗竭水平与病程的相关性研究*
