缺血性心肌病合并慢性肾脏病住院患者的临床特点△
2021-09-11吴泽佳蔡安平陈文中丘伟达肖小菊何旭瑜黎励文
吴泽佳,蔡安平,徐 兰,陈文中,丘伟达,肖小菊,夏 爽,何旭瑜,黎励文
[1.南方医科大学附属东莞人民医院,广东东莞 512000;2.广东省人民医院(广东省医学科学院),广州 510100;3.广东省心血管病研究所广东省人民医院(广东省医学科学院),广州 510100;4.惠州市第三人民医院,广东惠州516002]
随着社会老龄化,心力衰竭的发病率和患病率持续上升[1]。此外,冠状动脉粥样硬化性心脏病(冠心病)治疗的进展可以延长患者的生命,从而增加发生心力衰竭的可能性[2-3]。在冠心病患者中,左心室收缩功能不全是决定临床结局的一个重要因素,这可能是通过增加发生心力衰竭的可能性来实现的[4-5]。同样,严重冠心病合并左心室收缩功能不全的幸存者随后因心力衰竭住院的发生率相对较高,这与病死率显著增加有关[6-7]。日本急性冠状动脉综合征(acute coronary syndrome,ACS)患者注册研究显示,那些有心肌梗死病史的人死亡风险增加[8],这表明严重冠心病(如ACS)的复发会使长期临床结局恶化,部分原因可能是既往心肌梗死导致左心室收缩功能不全,从而导致冠心病患者发生心力衰竭的可能性增加。缺血性心肌病是由冠状动脉粥样硬化引起长期心肌缺血缺氧,心肌弥漫性纤维化导致心脏收缩和舒张功能障碍,引起心绞痛、心力衰竭、心律失常等一系列表现的综合征,是冠心病的晚期表现。据推算,缺血性心肌病患者1 年的病死率高达30%。慢性肾脏病(chronic kidney disease,CKD)是冠心病和心力衰竭患者常见的并发症,在年龄>18 岁的中国心力衰竭住院患者中CKD 的患病率为29.7%[9],国内研究证实,住院的冠心病患者中CKD 的患病率达24.8%[10],合并CKD 的患者预后更差[11-13]。在缺血性心肌病患者中,CKD患者的临床特征及其对临床决策有什么影响还不是很清楚。本研究探讨缺血性心肌病并发CKD患者的临床特点及其对临床决策、住院时间、院内死亡的影响,以提高临床医生对这类患者的认识,从而加强对这类患者的管理。
1 资料和方法
1.1 一般资料
收 集2015 年12 月1 日 至2019 年6 月30 日 于广东省人民医院住院的年龄≥18 岁的缺血性心肌病患者。缺血性心肌病定义为冠心病合并左心收缩功能不全。(1)冠心病诊断标准:既往行冠状动脉支架植入术、冠状动脉旁路移植术或冠状动脉造影显示任何心外膜冠状动脉狭窄≥50%;(2)左心收缩功能不全的诊断标准:超声心动图显示左心室射血分数(left ventricular ejection fraction,LVEF)≤45%。排除标准:妊娠女性。本研究经过广东省人民医院伦理委员会的批准,所有入组患者均签署知情同意书。
1.2 方 法
收集入选的缺血性心肌病患者的相关临床资料,包括年龄、入院时血压、心率、体质量指数(body mass index,BMI)、入院原因、入院时症状体征、吸烟史、既往心肌梗死病史、既往冠状动脉血运重建史、冠状动脉狭窄情况、器械治疗、并发症、出院带药、住院死亡情况、住院时间等。患者入院后24 h 内完成相关实验室检查:白细胞计数、血红蛋白、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDLC)、血白蛋白、肌酐、血尿酸、血钾、血钠、N 末端B型利钠肽原(N-terminal pro-B-type natriuretic peptide,NT-proBNP);心电图检查:QRS 间期、室性心律失常;彩色多普勒超声心动图检查:左心室舒张末期内径、左心室收缩末期内径、室间隔厚度、左心房内径、肺动脉内径、肺动脉压和LVEF。
1.3 相关定义
CKD定义为估计肾小球滤过率(estimate glomerular filtration rate,eGFR)<60 mL/(min·1.73 m2),eGFR 采用CKD 流行病学协作(Chronic Kidney Disease Epidemiology Collaboration,CKD-EPI)方程估算。贫血定义为成年男性血红蛋白<120 g/L;成年女性血红蛋白<110 g/L。根据2019 年欧洲血脂指南,将血脂异常定义为血脂不达标:LDL-C≥1.4 mmoL/L(极高危患者)或LDL-C≥1.8 mmoL/L(高危患者)[14]。高钾血症定义为基线血钾≥5.0 mmol/L[15]。室性心律失常定义为心电图出现室性期前收缩或室性心动过速。使用超声心动图测量心脏结构。院内死亡指患者在住院期间死亡或家属签字自动出院后当天死亡。
CKD-EPI 方程如下[16]:
女性:
当血清肌酐(serum creatinine,Scr)浓度≤0.7 mg/dL 时,eGFR=144×(Scr/0.7)-0.329×(0.993)年龄;
当Scr 浓 度>0.7 mg/dL 时,eGFR=144×(Scr/0.7)-1.209×(0.993)年龄;
男性:
当Scr 浓 度≤0.9 mg/dL 时,eGFR=141×(Scr/0.9)-0.411×(0.993)年龄;
当Scr 浓 度>0.9 mg/dL 时,eGFR=141×(Scr/0.9)-1.209×(0.993)年龄。
1.4 统计学分析
所有数据应用SPSS 26.0 软件进行分析。符合正态分布的计量资料以()表示,采用成组t检验;不符合正态分布的计量资料以[M(P25~P75)]表示,采用wilcoxon秩和检验;计数资料以[n(%)]表示,采用卡方(χ2)检验。计算双侧P值,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床基线特征比较
2015 年12 月至2019 年6 月期间,共有1 607例患者诊断为缺血性心肌病,排除8例基线无Scr 酐浓度数据的患者,最终入组1 599例缺血性心肌病患者纳入分析。由表1 可见,和非CKD 组比较,CKD 组患者年龄更大,男性患者比例、BMI 及舒张压更低;吸烟患者比例更高;运动或静息呼吸困难、夜间端坐呼吸、夜间阵发性呼吸困难、外周水肿患者比例更高;因心力衰竭入院患者比例更高,因ACS入院患者比例更低;合并心力衰竭、原发性高血压(高血压)、糖尿病、贫血、室性心动过速、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、高钾血症患者比例明显升高,差异有统计学意义(P<0.05)。两组患者收缩压、心率、运动耐量下降、夜间咳嗽、心绞痛/胸闷、心悸、颈静脉怒张、肺部啰音、既往心肌梗死、既往经皮冠状动脉介入(percutaneous coronary intervention,PCI)治疗、既往冠状动脉旁路移植术(coronary artery bypass grafting,CABG)、冠状动脉病变、血脂异常、心房颤动、脑缺血、脑出血、外周动脉疾病比较,差异无统计学意义(P>0.05)。
表1 两组患者临床基线特征比较 [,n(%)]

表1 两组患者临床基线特征比较 [,n(%)]
注:1 mmHg=0.133 kPa
2.2 两组患者实验室检查指标比较
和非CKD 组患者比较,CKD 组患者血红蛋白、白蛋白浓度明显降低,血尿酸、血钾、NT-proBNP浓度明显升高,差异有统计学意义(P<0.05);两组患者白细胞、TG、TC、LDL-C、HDL-C、血钠比较,差异无统计学意义(P>0.05),详见表2。
表2 两组患者实验室检查指标比较 [,M(P25~P75)]
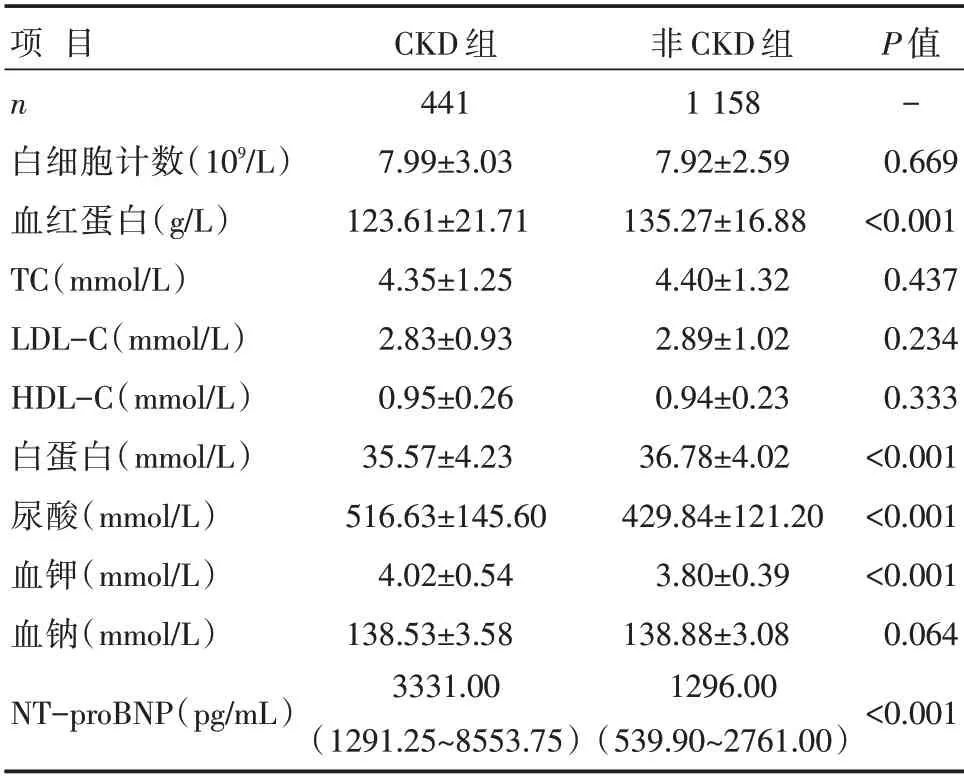
表2 两组患者实验室检查指标比较 [,M(P25~P75)]
2.3 两组患者心电图和超声心动图检查指标比较
和非CKD 组患者相比,CKD 组患者室间隔厚度、左心房大小、肺动脉压、室性心律失常和二尖瓣反流患者比例明显增加,LVEF 明显降低,差异有统计学意义(P<0.05);两组患者QRS 间期、房室传导阻滞患者比例、左心室舒张末直径比较,差异无统计学意义(P>0.05),详见表3。
表3 两组患者心电图和超声心动图检查指标比较[,n(%)]
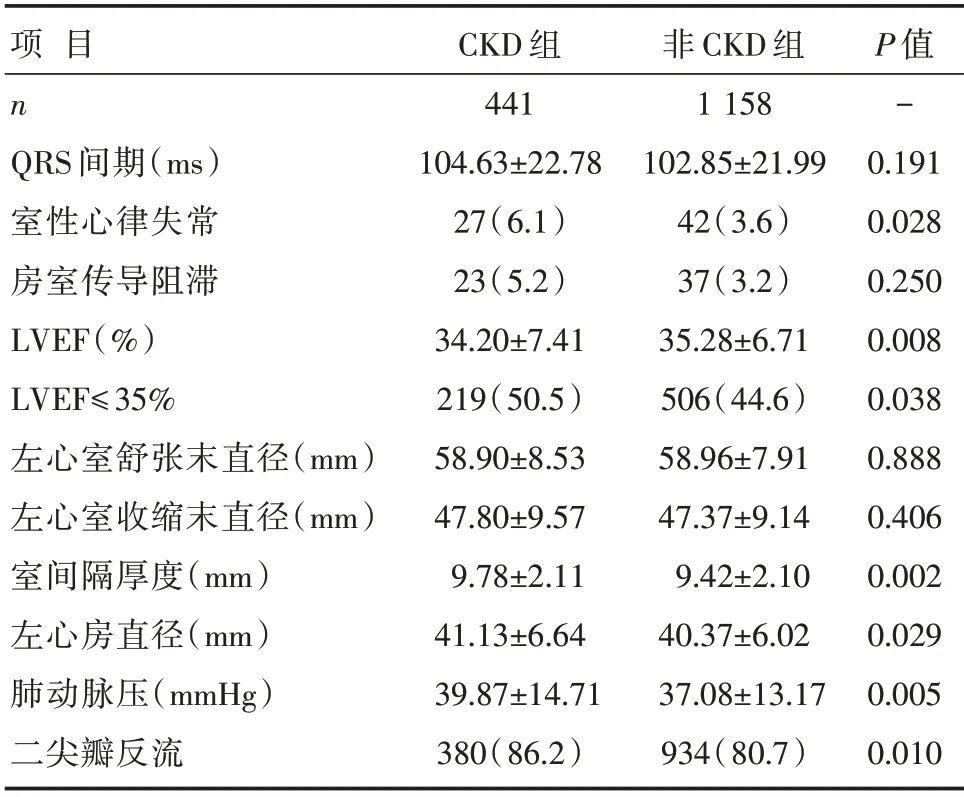
表3 两组患者心电图和超声心动图检查指标比较[,n(%)]
2.4 两组患者治疗和临床用药比较
和非CKD 组患者比较,CKD 组患者院内植入支架比例更低,院内使用静脉强心药、静脉利尿药比例更高;出院时使用利尿药、醛固酮受体拮抗剂、钙通道阻滞药、α受体阻断药、地高辛比例更高,而使用阿司匹林、氯吡格雷/替格瑞洛、血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)/血管紧张素Ⅱ受体拮抗剂(angiotensin receptor antagonist,ARB)/血管紧张素受体脑啡肽酶抑制剂(angiotensin receptor enkephalin inhibitor,ARNI)、β受体阻断药比例更低;在使用利尿药的患者中,CKD 组患者同时使用螺内酯的比例为90.0%,非CKD 组患者同时使用螺内酯的比例为94.9%(P=0.035);CKD 组患者植入植入型心律转复除颤器(implantable cardioverter defibrilla-tor,ICD)、心脏再同步化治疗(cardiac resynchronization therapy,CRT)和起搏器,出院时使用口服抗凝药比例高于非CKD 组,但两组比较差异均无统计学意义(P>0.05);CKD 组患者住院时间高于非CKD 组[6(4~9)dvs.5(3~8)d,P<0.001],院内病死率高于非CKD组,差异有统计学意义(P<0.001),详见表4。

表4 两组患者治疗和临床用药比较 [n(%)]
3 讨论
本研究发现,在缺血性心肌病患者中,与非CKD患者比较,CKD患者的年龄更大,并发症(高血压、糖尿病、贫血、室性心动过速、高钾血症、COPD)更多,心力衰竭的比例更高,相应使用利尿剂及强心药的比例更高,但是冠心病二级预防及改善心室重构药物的使用比例反而降低,住院时间延长,院内病死率增高。
本研究发现,CKD 组男性比例更低,原因可能是CKD 组患者年龄更大,与男性同龄人相比,女性在高龄时更有可能出现缺血性心脏病[17]。
心肌缺血可导致左心室收缩功能不全,左心室收缩功能不全可导致临床上明显的充血性心力衰竭。在慢性肾功能不全的早期患者中也能观察到左心室收缩功能不全[18]。中国老年CKD患者中,左心室收缩功能不全的患病率为3.1%[19]。Dounaevskaia 等[20]在一项以医院为基础的研究中报道,在晚期CKD患者中,中度至重度左心室收缩功能障碍的患病率为8.8%。心力衰竭在慢性肾脏病和终末期肾病患者中非常普遍,并且与这些患者的病死率密切相关[21]。社区动脉粥样硬化风险研究的结果发现,eGFR<60 mL/(min·1.73 m2)组患者与eGFR≥90 mL/(min·1.73 m2)组患者相比,心力衰竭的发病率高出3 倍[22]。这与本研究的发现一致:在缺血性心肌病患者中,CKD 组患者的心力衰竭患病率是非CKD 组的1.4 倍。
CKD 可导致容量超负荷、血压升高以及非血流动力学因素,如氧化应激和肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)的不适当激活,最终导致心室扩张和心力衰竭[23]。心脏功能受损导致RAAS 和交感神经系统(sympathetic nervous system,SNS)激活,从而导致血压升高和容量进一步超负荷[24];RAAS 和SNS 激活也可能导致肾小球硬化和进行性肾损害[25-26]。CKD、左心室收缩功能不全、高血压相互影响,形成恶性循环。虽然CKD患者中NT-proBNP 浓度升高主要是由于肾脏清除率降低所致,但高血压、心室肥厚、亚临床缺血或心脏重构或心肌纤维化导致的心肌壁压力增加也可导致NT-proBNP 浓度升高[27]。其他研究发现,随着肾功能的下降,LVEF亦随之降低[28]。左心房应变和左心房容积可能有助于检测3 期CKD 的心肌损害,左心房改变可能是RAAS 激活增加,导致CKD 心肌纤维化的结果。肺动脉高压的患病率随肾功能的恶化而增加[29]。这和本研究的发现一致,在CKD患者中,高血压和心力衰竭的患者比例更高,NT-proBNP 浓度更高,LVEF 更低,室间隔更加肥厚,左心房更大,肺动脉收缩压更高。
本研究发现,CKD患者血红蛋白浓度更低,贫血比例更高。贫血在慢性肾脏病患者中很常见,并与这一人群中心血管疾病风险的增加有关[30]。在“心肾贫血综合征”中,贫血与CKD 和冠心病的关系错综复杂[31]。基线贫血是CKD患者随后发生心力衰竭的一个重要且独立的危险因素[32]。我们推测,贫血导致携氧能力降低、容量超负荷,从而导致心肌缺血、心脏重构和心室扩张。此外,贫血在心力衰竭患者中很常见,并与这些患者的不良结局和高病死率有关[33]。然而,一些临床试验表明,治疗CKD患者的贫血并不能减少心血管疾病的结局,包括心力衰竭[34-36]。
多项研究证实,RAAS 抑制剂能够降低血压,具有肾脏保护作用,改善LVEF 及心力衰竭症状,降低心力衰竭患者的住院率及病死率,其获益在肾功能下降患者也可见到[37-41]。丹麦真实世界研究发现,每10 个心力衰竭患者中就有4 个会发展成高钾血症,且复发性高钾血症常见。RAAS 抑制剂、醛固酮受体拮抗剂的使用,患者合并CKD、糖尿病等均为心力衰竭患者高钾血症的主要危险因素[42]。在本研究中,CKD患者使用ACEI/ARB/ARNI的比例降低,考虑与CKD患者eGFR 降低,血钾浓度升高相关。而最新专家共识建议,对慢性或复发性高钾血症,应联合RAAS 抑制剂最大耐受剂量和降钾治疗,避免增加死亡风险,仅建议严重高钾血症(>6.5 mmol/L)患者减量或停用RAAS 抑制剂[15,43]。由于ACEI/ARB/ARNI 使用减少,CKD患者则更多使用钙通道阻滞药、α受体阻断药来进行降压治疗。由于CKD 组患者心力衰竭比例更高,相应使用强心药和利尿药的比例随之升高。CKD组患者醛固酮受体拮抗剂使用比例亦高于非CKD组,可能原因如下:第一,医生在使用利尿药时往往会同时使用醛固酮受体拮抗剂,预防低钾血症的发生;第二,CKD患者可能出现利尿药抵抗,这亦是潜在的增加醛固酮受体拮抗剂使用比例的因素。
抗血小板药物和他汀类药物是冠心病患者的基石药物。本研究发现,CKD 组患者服用抗血小板药物的比例明显低于非CKD 组。CKD患者的心血管血栓事件发生率过高,但矛盾的是,接受抗血小板药物治疗时发生大出血的风险更高。观察研究表明CKD患者对抗血小板药物的反应可能较差。某些抗血小板药物的代谢可能在CKD患者中发生改变[44]。这些原因可能限制了抗血小板药物在CKD患者中的使用。在CKD患者中,出院时使用他汀类药物有下降的趋势。Natanzon 等[45]发现,在ACS患者中,出院时他汀类药物处方与eGFR 呈负相关。Cox 回归分析显示他汀类药物在伴有ACS 的CKD患者中仍然有效。因此,无论eGFR如何,这些患者都应该接受他汀类药物治疗。
CKD 组住院时间延长,院内病死率增高,与CKD患者年龄更大,并发症更多相关。需进一步随访,研究CKD 对缺血性心肌病患者长期预后的影响。
本研究有以下的局限性:首先,这是一项横断面研究,不能确定CKD 在这些变量之间的因果关系。其次,本研究是基于单个中心进行的,还需要进一步的纵向研究,包括更多的参与者和中心,以探索CKD与长期生存的关系。另外,临床症状和体征评估是主观的,且非同一临床医师评估,导致症状和体征的评估有个体差异性。KDIGO 指南将CKD 定义为尿白蛋白排泄量持续升高(≥30 mg/g),eGFR 持续降低[eGFR<60 mL/(min·1.73 m2)],或两者兼而有之,超过3 个月[46]。本研究仅使用基线的Scr 浓度算出的eGFR 来确定患者是否患有CKD,可能会将患者误诊断为CKD 或非CKD。
总之,在缺血性心肌病患者中,CKD 组患者年龄更大,并发症(高血压、糖尿病、贫血、室性心动过速、高钾血症、COPD)更多,心力衰竭的比例更高,相应使用利尿药及强心药的比例更高,但是冠心病二级预防及改善心室重构药物的比例反而降低,住院时间延长,院内病死率增高。临床医生应该重视CKD患者并发症的识别,特别是心力衰竭的识别。加强对并发症的治疗,使用指南指导的药物治疗,从而改善CKD患者的预后。
