探究氯诺昔康诱导骨髓间充质干细胞向成骨分化的效果
2021-09-10窦仁刚吴婷婷洪永锋
窦仁刚 吴婷婷 洪永锋

摘要:目的 探究氯诺昔康诱导骨髓间充质干细胞向成骨细胞分化的表达效果。方法 取SD雄性小鼠后肢骨髓细胞,采用密度梯度离心全骨髓贴壁法分离、纯化、培养出骨髓干细胞,然后用Giemsa染色细胞在显微镜下观察不同阶段细胞形状特征,使用茜素红染色及ALP染色检测钙结节的形成与沉淀情况,并通过PCR检测三个成骨基因(BMP2、OCN 和 Runx2)的表达效果。结果 与对照组相比,加药组的钙结节数量更多(均P<0.05),且加药组的三个成骨基因(BMP2、OCN 和 Runx2)表达水平更高(均<0.05),表明氯诺昔康具有促进BMSCs向成骨分化的作用。结论 骨髓间充质干细胞在一定浓度的氯诺昔康诱导下,向成骨方向分化。
关键词:氯诺昔康 骨质疏松 骨髓间充质干细胞 成骨分化
1.引言
氯诺昔康是一种新型较低的亲脂性非甾体抗炎药,其具有系统性的镇痛、解热和抗炎作用,因为它抑制环氧合酶的作用并因此阻止了前列腺素的生物合成[1]。有研究发现氯诺昔康不但对老年患者关节置换术后康复镇痛有显著效果,而且也有相关参考文献提示在镇痛的同时有促进成骨形成的作用[2]。骨髓间充质干细胞作为一类具有自我复制能力的多潜能细胞,能够向成骨细胞、神经细胞等方向分化[3-4]。本研究利用氯诺昔康诱导骨髓间充质干细胞向成骨方向分化,为更多骨质流失疾病治疗方法提供理论研究依据,发展新思路。
2 材料与方法
2.1实验细胞及动物
选用SPF级健康的雄性SD鼠后肢骨髓腔提取骨髓间充质干细胞,小鼠体重为(100 ±10)g。
2.2 实验试剂
氯诺昔康,DMEM培养基,胎牛血清(FBS),胰蛋白酶,青霉素,链霉素,成骨诱导试剂,PCR相关试剂盒及成骨抗体,茜素红染色试剂盒
2.3 实验方法
2.3.1 大鼠骨髓间充质干细胞体外提纯和培养
选用4周龄的雄性SD小鼠,通过快速脱颈法安乐死SD小鼠,在无菌操作条件下取小鼠的双侧后肢骨髓,用培养基冲洗,直至冲净为止。然后离心后,使用含有10% FBS基础液反复吹打重悬的细胞以制备单细胞悬挂。计数后,将单细胞悬液以1×106个/mL的密度接种到25 cm2的培养皿中,在5% CO2恒温箱中于37°C培养。3天后,对半更换营养液,弃去非贴壁细胞后,当镜下细胞生长超过容量的80%聚集融合度时,行进一步传代,传至P3代用于实验。
2.3.2 氯诺昔康诱导细胞分化实验
选用P3代骨髓间充质干细胞按密度为 5×105个/mL铺种于培养皿中,当细胞融合度为80%左右时,选用不同浓度的氯诺昔康诱导21天,同时用不诱导细胞作为对照组。然后对其行PCR成骨基因检测和相关染色,将实验分为5组,(-)组(正常培养基)、(+)组(含成骨诱导液培养基)和加药组(含成骨诱导液培养基+氯诺昔康),其中加药组又包含三组不同氯诺昔康浓度组,即10-5 mmol/L组、10-6 mmol/L组和10-7 mmol/L组。
2.3.3 PCR检测特异性成骨基因表达水平
诱导21天收集细胞,用Trizol 裂解液、氯仿溶液、异丙醇按步骤进行细胞总RNA提取,然后对RNA浓度和纯度的OD值进行测定,测完值行逆转录,引物配制及聚合酶链反应,最后依据扩增产物所得的Ct值与对应标准曲线,用 2-ΔΔCt法分析,对各组mRNA 结果进行作图比较。
2.3.4 细胞染色
诱导21天后,对细胞进行洗涤,然后用Giemsa染色液,茜素红染色液避光下孵育0.5h-12h,然后PBS缓慢冲洗后,镜下拍照。
2.3.5 统计学处理
使用统计软件SPSS 19.0进行分析,结果表示为平均数±标准差(),通过方差的单向或双向进行统计学分析,对比结果以p<0.05表示具有统计学意义,该实验中所有结果均独立重复至少3次。
3 結果
3.1 骨髓间质干细胞的形态观察
倒置显微镜下观察骨髓间充质干细胞,细胞形态分散贴壁生长,大小不一,纺锤形细胞,像菌落一样聚集生长,生长状态良好,见图1。
3.2 成骨相关mRNA在不同浓度氯诺昔康组中的表达
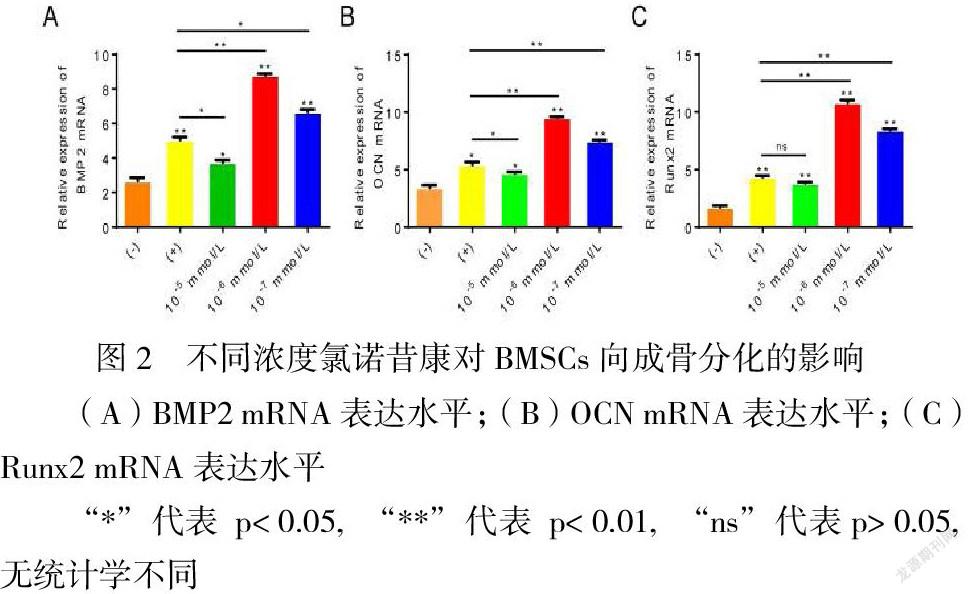
不同浓度(10-5 mmol/L、10-6 mmol/L和10-7 mmol/L)氯诺昔康与BMSCs共培养21天后,对各组成骨基因mRNA的表达情况进行比较。如图2所示,与(-)组相比,(+)组三种成骨基因的mRNA的表达水平均显著升高(P< 0.05);与(+)组相比,三个浓度梯度氯诺昔康组三种mRNA表达水平呈增高态势;不同浓度组组间比较,其中10-6 mmol/L浓度组表达最明显。
3.3 茜素红染色
为了验证PCR成骨基因表达结果,进一步行细胞成骨染色,共培21天后,观察不同组别茜素红染色结果,如图3所示,结果可见,与(-)组相比,(+)组钙结节表达水平较高(p<0.05);不同浓度的氯诺昔康组组间比较,其中10-6 mmol/L浓度组钙结节表达量最多(p< 0.05),与以上实验结果一致。
4 讨论
氯诺昔康作为新型NSAIDs可主要通过抑制环氧化酶活性而降低前列腺素合成, 调节内啡肽等物质分泌, 实现镇痛效果[5]。研究发现在某种情况下在镇痛同时具有促进成骨作用,具体机制现在还不清楚。
本研究利用氯诺昔康的特殊作用方式,根据干细胞具有多向分化性,通过体外诱导骨髓间充质干细胞转化成骨是可行的[6]。首先用氯诺昔康进行诱导干细胞21天,检测相关成骨基因表达效果,然后行茜素红染色,结果显示经氯诺昔康诱导21天后,成骨相关标基因的表达及成骨染色结果效果显著。由此可见,骨髓间充质干细胞在氯诺昔康的诱导下,向成骨方向分化。
5参考文献
[1]Helmy HS, El-Sahar AE, Sayed RH, et al.Therapeutic effects of lorno xicam -loaded nanomicellar formula in experimental models of rheumatoid arthritis[J].Int J Nanomedicine, 2017, 12: 7015-7023.
[2]杨云丽, 魏辉明, 张承华, 等.氯诺昔康对老年患者全髋置换术后舒芬太尼皮下自控镇痛效果的影响[J].中国临床药理学与治疗学, 2014, 19(02): 190-195.
[3]Wang B, Wen H, Smith W, et al.Regulation effects of melatonin on bone marrow mesenchymal stem cell differentiation.J Cell Physiol, 2019, 234(2): 1008-1015.
[4]顾珊,赵高平, 李 喜.小分子化合物诱导细胞重编程研究进展[J].生物技术通报, 2018, 34(1): 79-83
[5]郑镇伟, 王忱, 吴涛.氯诺昔康对大鼠神经性疼痛发生过程中背根神经节内GAP-43和NGF表达的影响[J].中国医师杂志, 2013, 15 (6): 767-771.
[6]Akbulut AC, Wasilewski GB, Rapp N, et al.Menaquinone-7 Supplementation Improves Osteogenesis in Pluripotent Stem Cell Derived Mesenchymal Stem Cells[J].Front Cell Dev Biol, 2020, 8: 618760.
基金項目:T 细胞介导的微环境促进干细胞在骨组织工程中应用研究,编号:81600845。
第一作者:窦仁刚,男,安徽六安人,在读硕士研究生。
通讯作者:洪永锋,男,安徽黄山人,博士,主任医师,副教授,硕士研究生导师。E-mail:hy_feng@ 163.com
(1.安徽医科大学第二附属医院康复医学科 安徽合肥 230601;2.安徽医科大学附属口腔医院正畸科 安徽合肥 230031)
