鱿鱼眼中透明质酸的提取工艺
2021-09-10沈兰王婷婷
沈兰 王婷婷
摘要:透明质酸是一种存在于生物体内的大分子聚合物,化学成分为粘多糖,广泛存在于动物和人体结缔组织及细胞外基质中,具有特殊的生理作用和极强的保湿能力。可广泛应用于医药、临床医学等领域。本文对鱿鱼眼透明质酸的提取方法进行了研究,实验采用水提醇沉、等电点法脱蛋白质与超滤相结合的加工工艺,运用正交试验法对提取工艺参数进行了优化,并对产品的质量指标进行了检验。
关键词:透明质酸;鱿鱼眼;提取工艺;鉴定
1 前言
透明质酸(Hyaluranic acid,简称HA),广泛存在于动物结缔组织,是一种由β-D-N-乙酰基葡萄糖和β-D-葡萄糖醛酸为结构单元以β-1,4-糖苷键缩合而成的一种酸性粘多糖,属于糖胺聚糖。1934年,Meyer 和Palmer [1]从牛眼中最先分离出此种物质,发现透明质酸是由相同的二糖单体重复排列而形成的无支链的直链多聚物,无定型固体,无臭、无味,溶于水而不溶于有机溶剂,水溶液比旋度为-70°~80°[2]。
透明质酸兼具有高分子和大分子体积的特性,由葡萄糖醛酸-乙酞氨基葡萄糖为双糖单位组成的直链高分子多糖,除了亲水性外,透明质酸较强的保湿性和粘弹性,在眼科、外科手术中有特殊的功效和较高的医学临床价值,。经过半个多世纪的研究,人们对透明质酸的结构、理化性质和生理功能已有了明确的认识,其研究领域不断扩展,透明质酸已成为细胞生物、病理、免疫学等领域的研究热点[3]。
本研究以鱿鱼(illex argentinus)加工下脚料--鱼眼为原料,研究了鱿鱼眼透明质酸的提取工艺,并对产品的理化性质进行了初步分析鉴定,使鱿鱼资源得以合理开发利用,利于提高其加工的综合效益及经济附加值,变废为宝。
2 实验方法
2.1 工艺流程
魷鱼眼→预处理→浸提→盐析→脱蛋白质→离心→浓缩→乙醇沉淀→超滤→干燥→成品
2.2 操作要点
鱿鱼眼预处理
将冷冻着的鱿鱼眼睛放置在实验容器中溶解。
浸提
准确称取50 g鱿鱼眼置于DS-1型高速组织捣碎机中进行组织捣碎,用去离子水浸提1-3次,将浸提液合并贮存于容器内待用。
盐析
向浸提液中加入去离子水配制成500 mL溶液,再加入5.85 g氯化钠搅拌至溶解,使其溶液最终NaCl浓度为0.2 mol/L,静置半小时。
脱蛋白质
根据等电点法除蛋白质法,用1:10的稀盐酸加入溶液中,并轻微搅拌,使溶液pH调节至4.0左右,达到沉淀量最大。
脱蛋白工艺确定:等电点法、三氯乙酸法[4]、Sevage法[4]
离心
脱蛋白的溶液通过DL-5低速大容量离心机离心,转速5000 r/min,离心时间为45 min,去沉淀取上清液。
浓缩
上清液通过A-1000S水循环真空泵进行真空浓缩,温度控制在40~50℃最后使溶液浓缩到适宜浓度即可。
乙醇沉淀
在浓缩后的溶液中加入其3倍体积的无水乙醇进行醇沉,然后离心取沉淀,复溶置于容器中。
超滤
用截留分子量为10000 Da的millipore labscale TFF system 超滤膜装置超滤。
干燥
将超滤后的溶液进行冷冻后,通过LGJ-10冷冻干燥机进行真空冷冻干燥得到的白色粉末即为透明质酸粉末。
3 透明质酸的分析
3.1 理化分析
3.1.1葡萄糖醛酸含量的测定[5]
实验步骤:
标准曲线绘制:精确吸取0、0.1、0.2、0.4、0.6、0.8、0.9、1 mL葡萄糖醛酸标准溶液于带塞试管中,各管加水至1 mL,在冰水浴中各管加入3 mL试剂A,摇匀后,于沸水浴中保持10 min,取出后冷至室温,各管加0.2 mL试剂B,于沸水浴中保持15 min,取出冰水浴中冷却。在室温下,测定光吸收值(530 nm),以浓度对光吸收作标准曲线。
样品测定:准确称取15.0mg的样品,定量于50 mL的容量瓶中,取1 mL样品溶液于带塞试管中,在冰水浴中各管加入3 mL试剂A,其余步骤同标准曲线制备操作。由所测得的光吸收值通过标准曲线求出相应葡萄糖醛酸量。
3.1.2 氨基葡萄糖含量的测定[6,7,8]
实验步骤:
氨基葡萄糖的鉴定
精取样品加适量4 moL/L盐酸使成为8 mg/mL封安瓶中于100℃烘箱中水解14 h。取0.75 mL稀释至10 mL。
低温乙酰丙酮反应:测光吸收(530 nm)为AL。
高温乙酰丙酮反应:测吸光度(530 nm)为AH。
AH/AL≈1,为半乳糖胺 AH/AL﹥1,为葡糖糖胺
标准曲线绘制:分取盐酸葡萄糖胺0、0.5、1.0、1.5、2.0 mL于带塞试管中,各加水至5mL,加1 mL乙酰丙酮试液(B),置沸水中25 min,用迅速冷却后,各管加无水乙醇3 mL及对二氨基苯甲醛试液1 mL,强力振摇,20~25 ℃下放置1 h,以0 mL为空白,测吸光度(530 nm)。
样品测定:取样品2 mg左右,置50 mL容量瓶中,加6 moL/L盐酸1.5 mL,沸水浴中水解1 h,冷却后用NaOH中和至中性,用水稀释至刻度,取2 mL样液,加水至5 mL其他操作同上。
3.2 光谱分析
3.2.1紫外光谱分析[9]
样品配成1 mg/mL透明质酸溶液,UV-240紫外可见分光光度计扫描,扫描范围为190~300 nm。
3.2.2红外光谱分析[10]
透明质酸微量样品KBr压片后,用Nicolet Nexus 5DXC FT-IR红外光谱仪在4000-500 cm-1区域内进行红外扫描。
3.3 透明质酸提取率和得率的计算
透明质酸提取率=透明质酸含量(g)/鱿鱼眼睛质量(g)×100%,以干基(扣除鱿鱼眼睛原料水含量)计。葡萄糖醛酸测量值除以46.32%[13],即可得到HA的含量。
透明质酸得率=提取的透明质酸质量(g)/鱿鱼眼睛质量(g)×100%,以干基计。
4 结果与分析
4.1透明质酸提取的正交实验及结果
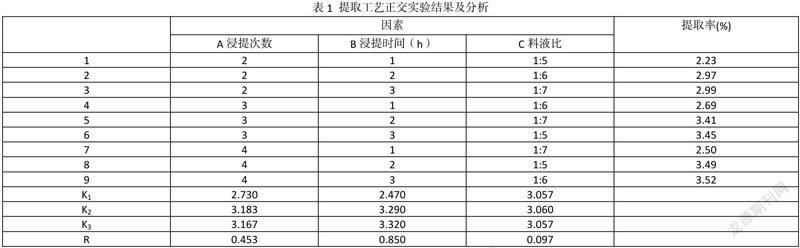
根据上述单因素实验结果,选择浸提次数、浸提时间、料液比三因素,采用L9(33)正交表进行正交实验,结果见表1。
在实验设定的范围内,最佳方案为A2B3C2,即提取3次,浸提时间3 h,料水比1:6。
在以上得到的优化工艺参数条件下,重复多次,透明质酸的平均提取率为3.58%,。
4.2脱蛋白工艺的确定
实验中发现,从鱿鱼眼睛中提取的透明质酸溶液含有较多的蛋白质杂质,因此,脱蛋白成为整个提取工艺的关键之处。当pH值为4时脱蛋白效果最好,同时,在实验过程中,也发现pH值=4时上清液澄清。所以,用等电点法除蛋白质,适宜pH值应取4。
4.3透明质酸的质量指标
根据上述工艺,所制备的产品主要为透明质酸,每千克鱿鱼眼睛干原料可获29.6g产品,产品的总得率达2.96%,产品纯度为72.21%。
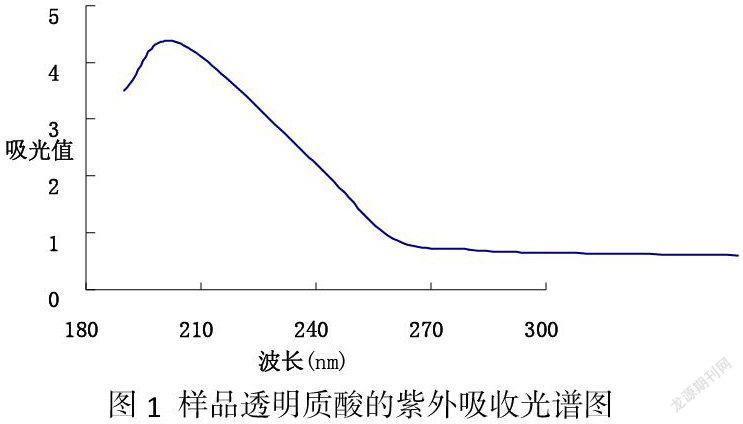
4.4紫外光谱分析
从紫外吸收光谱(见图1)分析得,样品在201~207 nm有很强的多糖吸收峰,而在280、260 nm处无强烈的吸收峰,说明制品透明质酸中蛋白质和核酸含量极少。
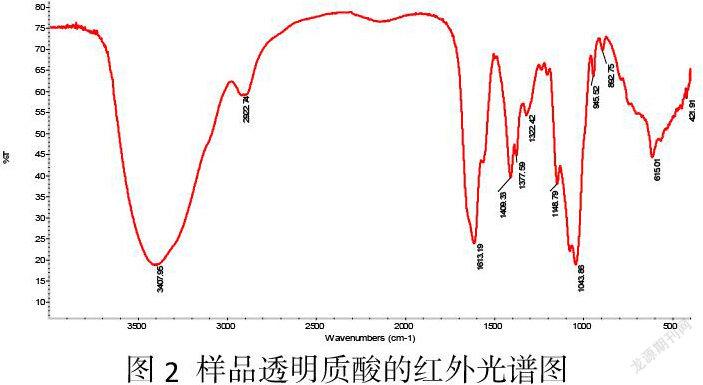
4.5红外光谱分析
如图2的红外光谱图谱所示,3407.95 cm-1出现强烈的O-H伸缩振动,表明存在多羟基结构;在2922.72 cm-1处出现的-CH伸缩振动,1613.19 cm-1和1409.33 cm-1强锐峰为羧基的反对称及对称伸缩振动峰;1409.33 cm-1和1322.42 cm-1有-C-O-的伸缩振动和-OH的弯曲振动偶合产生的两个吸收峰,表明存在着糖醛酸上解离羧基和多羟基结构;1148.79 cm-1、1043.86 cm-1、945.52 cm-1左右的吸收峰为糖的特征吸收峰。以上情况与文献[11]报道的标准品谱图相吻合,表明产品样呈较典型的透明质酸红外光吸收。
5 结论
鱿鱼眼睛中透明质酸的最佳提取工艺参数:浸提次数为3次,浸提时间为3 h,料液比为1:6;等电点除蛋白质的最佳pH值为4。在此提取条件下,产品的总得率为2.96%,纯度为72.21%。
本实验采用等电点法脱杂蛋白,操作简单,污染较少,成本较低,效果较佳。
参考文献:
[1] Meyer K, Palmer J W. The polysaccharide of the vitreous houmor[J].J Biol Chem,1934,107: 629~633.
[2] 潘红梅.透明质酸的研究现状综述[J].四川食品与发酵,2003,2(1):5~9.
[3] 阎家麒,贾定武,赵敏.透明质酸生产菌菌种诱变选育及发酵工艺研究[J].中国医药工业志,1994,25(4):145~147.
[4] 虞菊萍,高向东.透明质酸精制方法的比较[J].药学与临床研究,2007,15(4):300~302.
[5] 李薇,佟爱东,邓兆勇.透明质酸化学定量分析方法的研究[J].中国生化药物杂志,1994,15(2):96~99.
[6] 张惟杰.复合多糖生化研究技术[M].上海:上海科学技术出版社,1987:283~290.
[7] 肖凯军,李琳.鲨鱼软骨粘多糖及其分离纯化和应用[J].上海水产大学学报, 1999,11(2):163~169.
[8] 李建武.生物化学实验原理和方法[M].第二版.北京:北京大学出版社,1994:125~165.
[9] 罗曼,蒋立科,奚俊.牛眼透明质酸的分离及性质测定[J].生物化学与生物物理进展,1999,26(6):596~600.
[10] 樊东辉,吴蓓蓓,徐政,等.透明质酸钠的光谱学分析[J].中国生化药物杂志,2006,27(01):22~25.
[11] 史鵬. 发酵法生产透明质酸下游提取工艺方法的研究[D].西北大学,2005.
杭州市余杭区食品药品监测中心 浙江杭州 311199
