槲皮素治疗心力衰竭的分子机制:基于网络药理学与分子对接方法
2021-09-10陈永锋李小荣王其一康品方王洪巨
谭 鑫,鲜 维,陈永锋,李小荣,王其一,康品方,王洪巨
蚌埠医学院1第一附属医院心血管内科,2心脑血管病研究中心,3生理学教研室,安徽 蚌埠233000
心力衰竭(HF)为临床上严重的心血管疾病之一,与冠状动脉粥样硬化、高血压、糖尿病和心肌梗死等疾病相关[1-2]。最新的国内HF指南提出,目前治疗HF药物主要以β受体阻滞剂、血管紧张素转换酶抑制剂或血管紧张素Ⅱ受体拮抗剂和螺内酯为主[3]。上述治疗HF的口服药物虽然均有一定的治疗作用,但是也存在一定的副作用。因此,寻找直接针对HF病理生理改变的药物并研究其深一层次的作用机制,具有重要意义。所以近年来在新药的研发中,天然药物化学成分治疗相关疾病引起了越来越多的学者重视[4]。
槲皮素在自然界蔬菜水果中存在及其广泛,并且多种中药包含槲皮素。由于槲皮素具有抑制低密度脂蛋白氧化、减少粘附分子和其他炎症标志物、预防神经元氧化和炎症损伤以及血小板抗聚集作用,槲皮素治疗潜力被广泛报道研究。据报道,槲皮素在HF、冠心病、心肌缺血再灌注、高血压和心肌炎动物模型上均显示出明显的治疗效果,但是槲皮素治疗HF仍缺乏体外以及临床研究,因此有必要系统的深入研究槲皮素治疗HF的分子机制[5,6]。网络药理学作为一种新型的药物疾病研究方法,为药物和疾病之间的具体分子机制提供充足的证据[7]。因此本研究基于网络药理学筛选出槲皮素治疗HF的靶点,并对交集靶点进行GO和KEGG分析,明确槲皮素治疗HF核心靶点以及潜在的分子机制,并在HF细胞模型上面进行了初步验证,为未来的临床应用和基础研究提供新的见解及依据。
1 材料和方法
1.1 槲皮素靶点的获取
利用中药系统药理学分析平台(TCMSP)(http://tcmspw.com/),以“quercetin”为关键词检索槲皮素中的作用靶点,下载其mol2 格式并上传到PharmMapper(http://www.lilab-ecust.cn/pharmmapper/)网站,靶点种类设定为HumanProtein Targets Only,其他默认[8,9]。(检索日期:2021.4.1)
1.2 HF相关靶点的获取
通过CTD(http://ctdbase.org)、GeneCards(https://www.genecards.org/)数据库,以“Heart Failure”为关键词检索相关的基因[10,11]。将搜集到的靶点合并剔除重复项,获得疾病靶点。
1.3 槲皮素和HF交集靶点蛋白质互作(PPI)网络的构建
将筛选过的靶点上传至在线韦恩图(http://bioinformatics.psb.ugent.be/webtools/Venn/),得到槲皮素与HF的交集基因。将交集基因导入String数据库[12](https://string-db.org/cgi/input.pl)构建蛋白质之间的PPI,将PPI 网络导入Cytoscape3.7.2 软件(http://www.cytoscape.org/)进行调整以及利用cytoHubba插件得到关键靶点。
1.4 GO分析和KEGG通路和槲皮素-主要通路-心力衰竭网络构建
进一步了解交集基因的功能与信号通路中作用,将基因简写(Symbol)转化为基因ID(EntrezID),通过R语言包对结果进行可视化分析,以及对上述交集基因进行基因本位(GO),GO分析可以进一步解释交集基因在分子功能,生物过程和细胞组成抗HF的过程。京都基因与基因组百科全书(KEGG),KEGG富集分析则是研究交集基因涉及的主要抗HF信号通路。同时构建“槲皮素-主要通路-心力衰竭”核心靶点网络。
1.5 槲皮素与HF分子对接
将已知的关键靶点与槲皮素进行分子对接,得到对接亲和力反映其稳定性。PDB数据库下载核心蛋白分子结构,PUBCHEM 下载槲皮素的结构,将蛋白和槲皮素结构导入PyMol 2.4.0和Auto Dock Tools软件进行处理后进行分子对接,PyMol 2.4.0 进行可视化[13,14]。
1.6 药品及试剂
槲皮素(Sigma),戊巴比妥钠(中国西亚试剂),CCK8试剂盒(Biosharp),DMEM高糖培养基(GIBICO),二甲基亚砜(DMSO),BSA(Biofroxx)。AKT1(Abcam),Phospho-AKT(Ser473)(CST),eNOS(CST),MMP9(Abcam),Caspase-3(CST),β-actin(Biosharp),羊抗兔(Biosharp),羊抗鼠(Biosharp)。
1.7 H9C2心肌细胞培养
本研究选用大鼠H9C2心肌细胞(FUBIO细胞株),细胞培养使用10%胎牛血清培养基,将心肌细胞均匀种于96孔板上(每孔约5000个),给予槲皮素0、25、50、75、100、125、150、200 μmol/L干预4 h后加入CCK8,从而获得槲皮素最佳用药浓度。将H9C2心肌细胞分为正常组(N)、正常组+槲皮素组(N+Q)、心力衰竭组(HF)和心力衰竭+槲皮素组(HF+Q),放于37 ℃、5%CO2培养箱中。槲皮素溶解于DMSO中,最终浓度为100 mmol/L待用。培养24 h后换液加入无血清DMEM同步化处理12 h后,N组和HF组换液为无血清培养基,N+Q组和HF+Q组加入无血清培养基配制的槲皮素,在培养箱中培养4 h后进行HF细胞模型造模[15]。
1.8 戊巴比妥钠诱导H9C2细胞心衰模型
已有研究证实细胞模型可作为研究HF的模型之一[16],将戊巴比妥钠溶于无血清高糖培养基(现用现配),配置成0.1%备用。将干预好的细胞用PBS冲洗2次,清除残留槲皮素,除N 组和N+Q 组外将HF 组和HF+Q组加入等体积无血清0.1%戊巴比妥钠培养基,放于培养箱干预0.5 h后,观察梭形心肌细胞变细并有部分细胞变成圆形,少部分细胞已漂浮,则心衰细胞模型建立成功。
1.9 CCK-8活性检测
将H9C2心肌细胞按照细胞5000/孔均匀种于96孔板中,按照上述条件进行分组干预培养后,依据试剂盒说明书进行操作,利用Biotok酶标仪检测吸光度A450nm。
1.10 蛋白免疫印迹检测
将各组心衰细胞蛋白提出后进行定量、变性并计算上样量,电泳、转膜后5%脱脂牛奶室温封闭2 h,其中Phospho-AKT使用5%BSA封闭2 h,依次加入AKT1、Phospho-AKT、eNOS、MMP9、Caspase-3、β-actin 等抗体4 ℃摇床孵育12 h,第2 天将膜取出在摇床上给予TBS-Tween洗膜,5 min 3次后给予室温孵育二抗2 h,然后TBS-Tween洗膜10 min 3次后曝光(VIVILBER机器),利用Image J统计分析条带灰度值。
1.11 统计学方法
数据采用GraphPad Prism 9.0统计学处理,所有数据均以均数±标准差表示。各组间采用单因素方差分析,两两比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 槲皮素潜在靶点信息
通过TCMSP、PharmMapper 数据库最终得到槲皮素的潜在靶点共380个,将靶点名称上传到UniProt数据库(http://www.uniprot.org/),限定物种为“Homosapiens”,校正靶点名称并剔除得分较低的靶点,最终得到316个靶点。
2.2 HF相关靶点获取
在CTD、GeneCards数据库共筛选出84117(70494+13623)个基因,通过筛查剔除CTD和GeneCards中关联得分较小的基因,分别筛选出555、425个相关度得分较高的基因,将其合并剔除重复基因,得到821个高分靶点。
2.3 槲皮素-心力衰竭的共同靶点
将槲皮素潜在靶点信息与HF高分靶点取交集得到槲皮素中与HF相关发病机制的80个作用靶点基因,包括AKT1、EGFR、TTR、MAPK等。交集靶点韦恩图见图1。
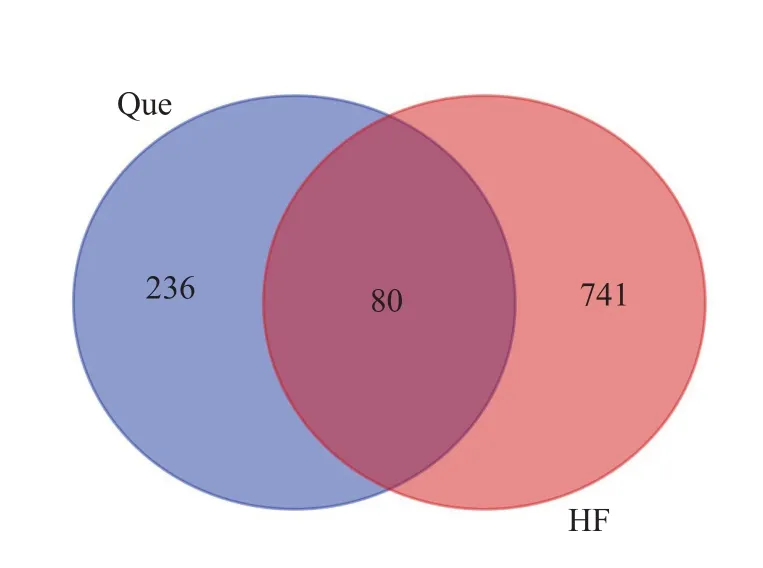
图1 槲皮素与HF韦恩图Fig.1 Venn diagram of Que and HF.
2.4 PPI网络及槲皮素治疗HF的关键靶点
将槲皮素与HF交集靶点导入String数据库,物种限定为人,得到蛋白互作网络,将其进一步导入Cytoscape进行可视化分析(图2),网络中共有80个节点,715条边,利用cytoHubba插件得到Degree排名前5治疗HF的关键靶点AKT1、CASP3、MAPK1、MMP9、MAPK8,关键靶点详情信息见表1。
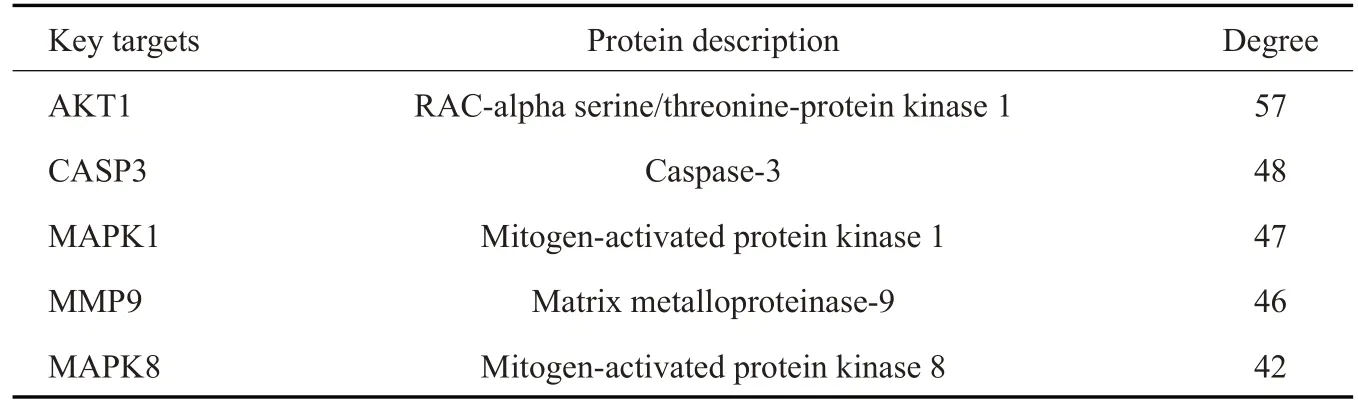
表1 槲皮素治疗HF的关键靶点信息表Tab.1 Key target information table of QUE in the treatment of HF
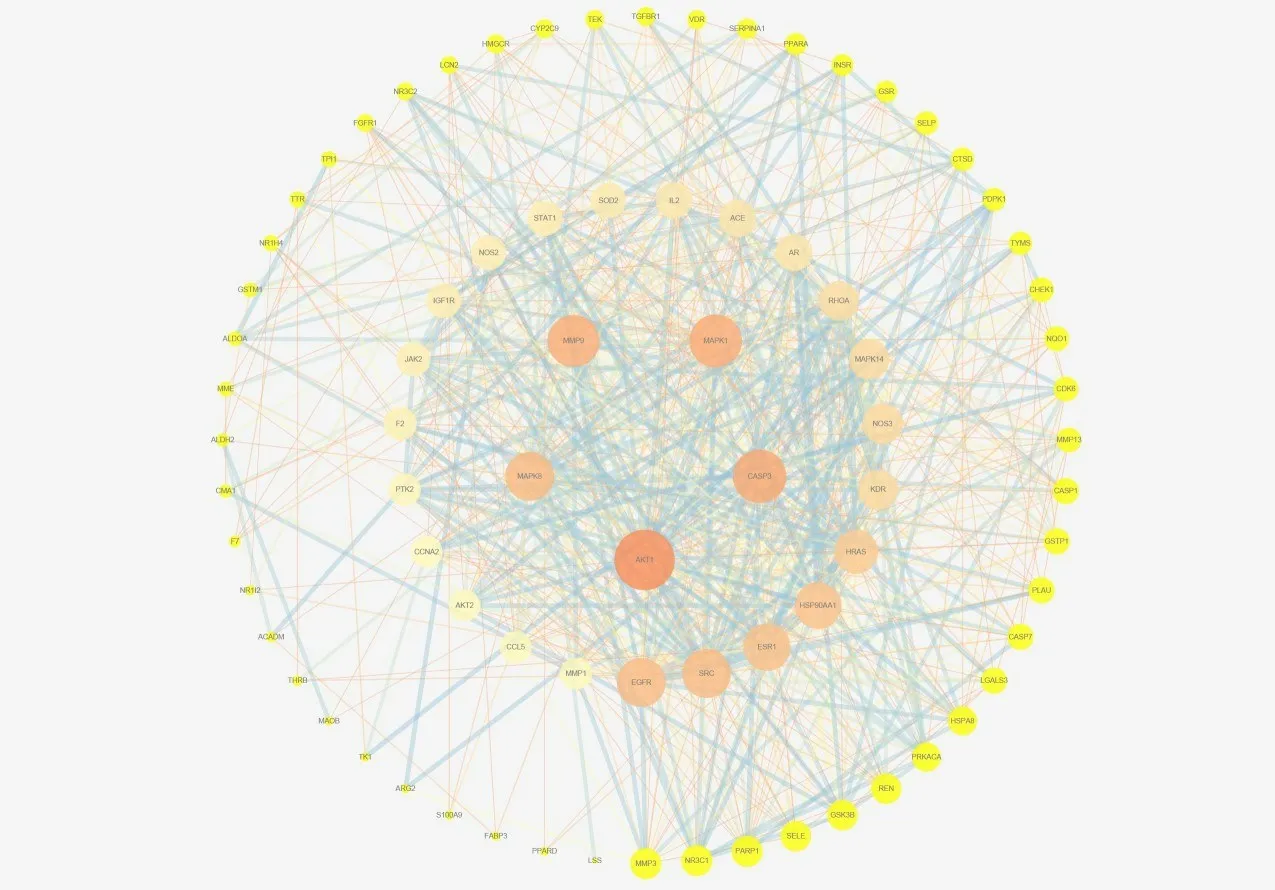
图2 核心PPI网络Fig.2 Core protein-protein interaction network.
2.5 GO功能分析结果
槲皮素治疗HF的GO功能结果提示(图3),生物过程主要集中在:对脂多糖的反应、对细菌来源分子的反应、炎症反应的调节、对肽类激素的反应、磷脂酰肌醇介导的信号传导;细胞组成主要集中在:膜筏、膜微区、膜区、囊腔、分泌颗粒腔;分子功能主要集中在:内肽酶活性、羧酸结合、有机酸结合、RNA聚合酶II特异性DNA结合转录因子结合、核受体活性。

图3 GO功能分析结果Fig.3 Results of GO function analysis.
2.6 KEGG通路富集分析结果
KEGG通路富集筛选结果共有154个富集项,其中前30是最具有显著性的通路(图4),其中脂质与动脉粥样硬化通路、癌症中的蛋白多糖、PI3K-AKT信号通路、糖尿病心肌病、MAPK信号通路等可能为重要的通路。“槲皮素靶点-主要通路-心力衰竭”网络见图5,其中槲皮素治疗HF可能的重要通路PI3K-AKT详细信号通路见图6,其中通路图中红色区域为信号上调。

图4 KEGG通路富集分析结果Fig.4 Results of KEGG pathway enrichment analysis.
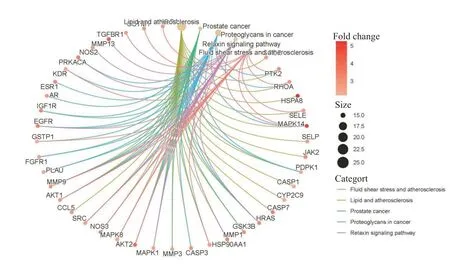
图5 槲皮素靶点-主要通路-心力衰竭Fig.5 Quercetin target-major pathway-heart failure.
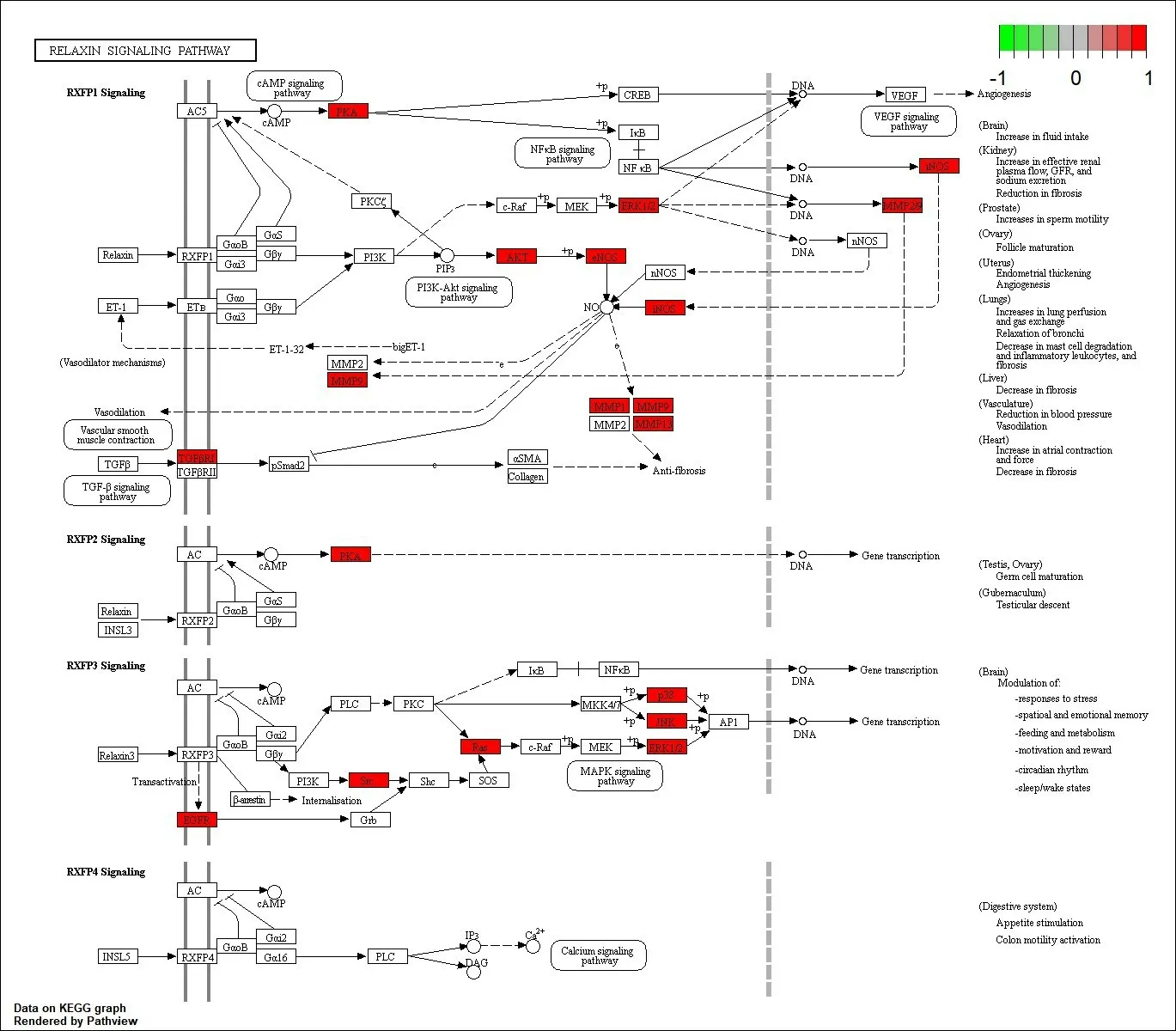
图6 槲皮素治疗心力衰竭的信号通路靶点Fig.6 Targets of quercetin in the treatment of heart failure.
2.7 分子对接分析
将槲皮素与上述关键靶点进行分子对接,平均对接亲和力为6.58 kcal/moL(表2),与各关键靶点对接详细图见图7。
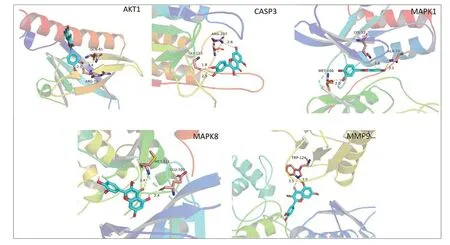
图7 槲皮素与关键靶点分子对接模式图Fig.7 Docking pattern of quercetin with the key target molecules.

表2 分子对接结果Tab.2 Molecular docking results
2.8 不同槲皮素浓度对H9C2细胞的影响
为了进一步明确槲皮素治疗心衰细胞的最佳浓度,给予0、25、50、75、100、125、150、200 μmol/L槲皮素处理H9C2细胞4 h。CCK-8结果显示,125、150、200会显著降低细胞活性,即100 μmol/L为最佳用药浓度(图8),HF细胞模型造模成功(图9)。

图8 不同槲皮素浓度对H9C2细胞的影响Fig.8 Survival rate of H9c2 cells treated with different concentrations of quercetin for 4 h determined with cell counting kit-8(n=3,Mean±SD).*P<0.05,**P<0.01,***P<0.001 vs 0 μmol/L.

图9 H9C2心肌细胞心衰模型的建立Fig.9 Establishment of a heart failure model in H9c2 cardiomyocytes.
2.9 CCK-8检测各组心肌细胞活力变化
与正常组N组比较,N+Q组细胞活力无明显变化,而HF模型组细胞活力明显下降。与HF模型组比较,HF+Q组细胞活力明显升高(图10)。
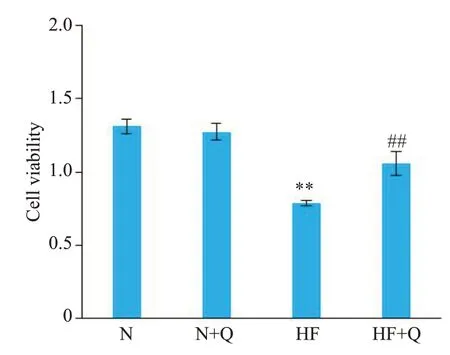
图10 各组心肌细胞活力变化Fig.10 Changes in cardiomyocyte viability in each group.**P<0.01 vs N group,##P<0.01 vs HF group.
2.10 槲皮素通过AKT1-eNOS-MMP9通路调控心衰细胞的凋亡
根据关键通路的调控靶点,100 μmol/L槲皮素干预后,检测各组关键通路蛋白AKT1、Phospho-AKT、eNOS、MMP9,同时检测各组Caspase-3 凋亡蛋白活性。免疫印迹分析结果提示,槲皮素可明显降低HF组中AKT1、Phospho-AKT、eNOS、MMP9水平(图11A),并明显降低HF细胞的Caspase-3活性(图11B)。
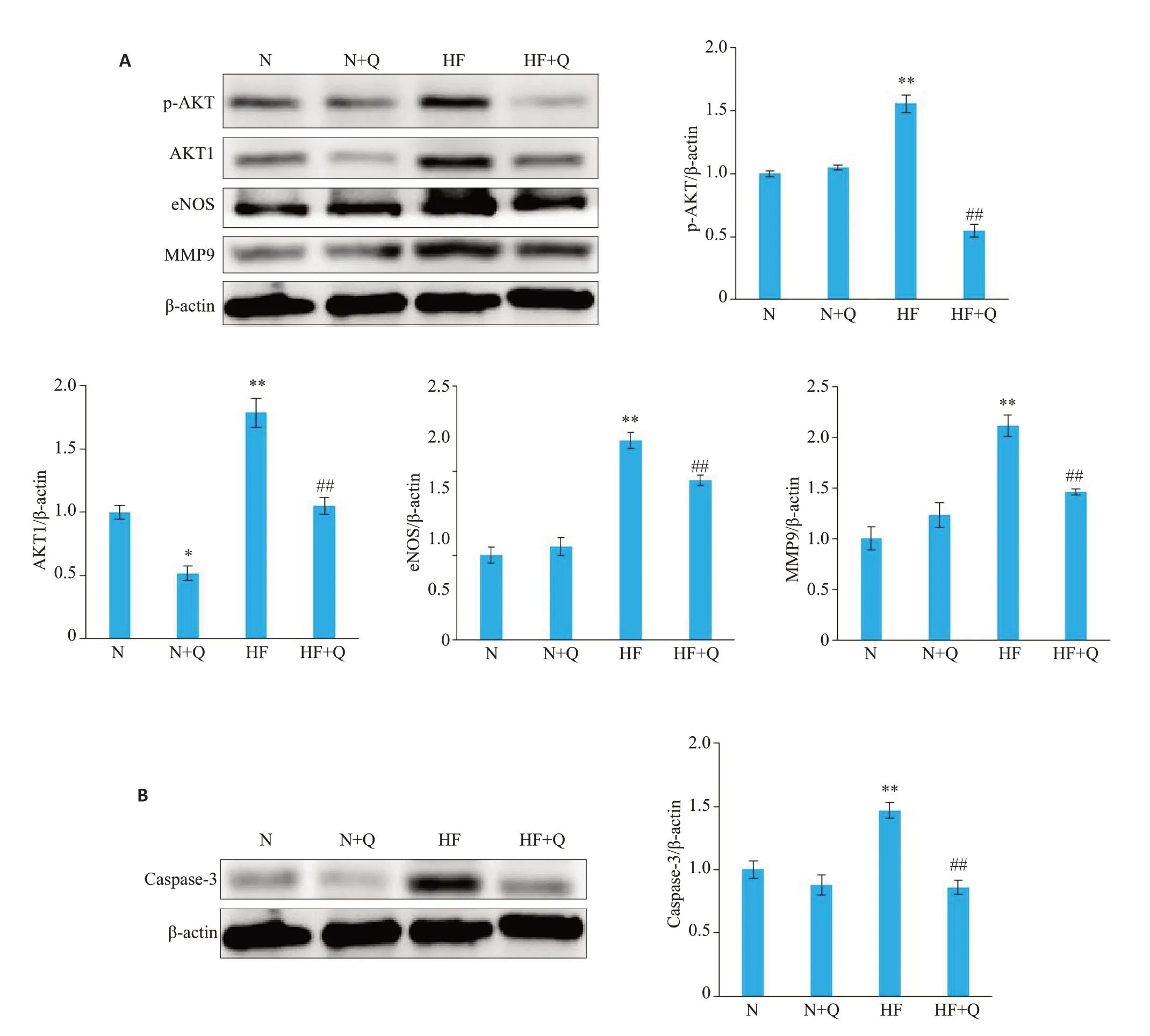
图11 槲皮素降低心衰细胞P-AKT、AKT1、eNOS、MMP9表达水平并降低Caspase-3蛋白表达Fig.11 Quercetin decreases the expression of P-AKT,AKT1,eNOS,MMP9(A)and caspase-3(B)in heart failure cell models detected by Western blotting(n=3,Mean±SD).*P<0.05,**P<0.01 vs N group;#P<0.05,##P<0.01 vs HF group.
3 讨论
HF中医发病机制是以心肾为本,五脏相因,水饮瘀血,相兼为患,心衰患者常见数脏同病,虚实错杂,但以心肾气虚、阴阳俱虚为主。槲皮素是黄酮类化合物的6个亚类之一,摄入较多的槲皮素可以降低心血管疾病的发病率和死亡率,槲皮素具有抗氧化、抗凋亡、抗炎和免疫调节等功能[17-23],体内实验具有抗HF作用[5]。本研究共获得80 个槲皮素治疗HF 的靶点,其中AKT1、CASP3、MAPK1、MMP9 和MAPK8 为治疗的核心靶点。已有研究证明,氯沙坦通过调节HF患者外周血内皮祖细胞中的PI3K/AKT/eNOS通路可促进内皮祖细胞的增殖和迁移,并减少内皮祖细胞的凋亡[24]。本研究在HF心肌细胞模型中发现,槲皮素可通过调节AKT1/eNOS/MMP9通路抗HF心肌细胞的凋亡。
GO分析显示,槲皮素治疗HF生物过程集中在对脂多糖的反应,其中还涉及对肽类激素的反应、磷脂酰肌醇介导的信号传导、对细菌来源分子的反应和炎症反应的调节等。KEGG结果表明,槲皮素治疗HF主要通路富集在PI3K-AKT信号通路、脂质与动脉粥样硬化通路、癌症中的蛋白多糖、糖尿病心肌病、MAPK信号通路、前列腺癌、松弛素信号通路、流体抗剪应力和动脉粥样硬化等。研究表明槲皮素具有抗凋亡和抗氧化等功能,对HF中的心室重构具有一定的保护作用[5,22],PI3KAKT信号通路能调节细胞生长、代谢、凋亡等活动,具有广泛生物学功能[25]。在糖尿病心肌病导致HF中发现降低PI3K/AKT和ERK1/2活化,可增加心肌氧化应激和抗凋亡能力,进一步减缓HF的疾病进展[26]。我们通过筛选PI3K-AKT关键通路中的上调靶点,发现通路中的AKT1-eNOS-MMP9在槲皮素治疗HF中起到关键作用。
本研究得出槲皮素治疗HF有80个靶点,核心靶点如前所述。有研究表明抑制AKT1信号通路表达可以改善HF心肌细胞自噬和凋亡[27,28]。MMP9是基质金属蛋白酶(MMPs)中的一种,MMPs影响细胞炎症过程、凋亡、新生血管生成、分化和生长等功能,抑制其表达可以改善HF心脏功能障碍和重塑[28,29]。CASP3主要参与凋亡半胱氨酸蛋白酶的激活级联反应,在凋亡过程中起重要的作用,多项研究证实通过降低CASP3活性可减少活性氧的产生并抑制凋亡来预防HF[30,31]。血管内皮一氧化氮是由L-精氨酸在血管内皮一氧化氮合成酶的催化下合成的,对维持循环平衡和调节血管张力具有重要作用[32],内皮一氧化氮的产生主要取决于一氧化氮合成酶的活性,其活性与PI3K/AKT通路密切相关[33]。本研究在HF细胞模型中使用100 μmol/L槲皮素进行干预,发现可明显降低核心靶点中AKT1、MMP9 和CASP3的蛋白表达,分子对接提示槲皮素与核心靶点具有较好的结合作用。关键通路中的eNOS经槲皮素干预后表达降低。以上结果表明,槲皮素可通过调控AKT1-eNOS-MMP9通路减少HF细胞模型凋亡蛋白的表达。
综上所述,通过网络药理学系统的分析明确槲皮素治疗HF的关键靶点,GO和KEGG分析以及筛选得到了核心信号通路及分子机制。利用分子对接技术进行槲皮素与关键靶点的结合验证,并通过在HF细胞模型上验证,发现槲皮素可能通过调控AKT1-eNOS-MMP9通路抗凋亡进一步改善HF的病理生理改变。因此本研究可为基础临床深一步的研究提供依据,以及药物研发提供新的思路和方法。
