石蒜鳞茎膨大过程中碳水化合物代谢相关基因的差异表达研究
2021-09-10许俊旭李青竹杨柳燕张永春蔡友铭
许俊旭 李青竹 李 叶 杨柳燕 张永春 蔡友铭
(1上海市农业科学院林木果树研究所,上海 201403;2上海市金山区廊下镇农业技术推广服务站,上海 201516)
石蒜[Lycoris radiata(L’Her.) Herb.]是具有较高观赏和药用价值的鳞茎类植物,常用于生产鲜切花、盆花以供应城市园林绿化,也可栽植于林下打造成独特的林下景观[1]。另外,石蒜鳞茎中提取出的生物碱被证明具有抵抗病毒、炎症、肿瘤和癌症的作用[2]。然而,由于石蒜鳞茎的自然膨大过程很慢,从种子萌发到进入商品阶段需4—5年,无法满足商业化生产的需求。为了满足这种需求,石蒜自然栖息地遭到大量破坏性开采,极大地缩减了我国的野生石蒜资源[3]。因此,研究如何加速石蒜鳞茎的膨大具有重要意义。
淀粉是石蒜鳞茎膨大的物质基础。有研究表明,随着石蒜鳞茎的膨大,淀粉含量逐渐积累[4]。前人对换锦花(Lycoris sprengeriComes ex Baker.)种球膨大过程进行研究后发现,随着换锦花鳞茎的膨大,淀粉粒积累明显,淀粉和蔗糖含量逐渐上升[3]。因此,石蒜属植物鳞茎膨大过程中鳞茎主要以淀粉的形式储存营养物质,这对于其后续的生长发育都是必要的。
淀粉的积累和代谢过程受一系列基因的调控,这些基因也被证明与变态根茎的膨大密切相关。在甘薯[Ipomoea batatas(L.) Lam.]中,腺苷二磷酸葡萄糖焦磷酸化酶基因(glucose-1-phosphate adenylyltransferase,AGPase)、颗粒结合型淀粉合成酶基因(granule-bound starch synthase,GBSS)、可溶性淀粉合成酶基因(soluble starch synthase,SSS)、淀粉分支酶基因(starch branching enzyme,SBE)等与淀粉合成密切相关,直接决定了甘薯块根中淀粉的含量,从而调控块根的膨大[5]。另外,在蔬菜变态根茎的发育过程中,淀粉的合成和积累受编码淀粉脱支酶(isoamylase,ISA)、SBE、GBSS 以及α-淀粉酶和β-淀粉酶等相关基因的调控[6]。然而,关于这些基因在石蒜鳞茎膨大过程中的调控作用还有待进一步揭示。
此外,糖也在石蒜鳞茎膨大过程中起关键调控作用,能够为鳞茎的形态建成和发育提供能量[7-8],并可能通过加速细胞分裂的方式促进鳞茎的膨大[4]。在其他植物的研究中,糖合成、代谢及运输相关基因都参与调控变态根茎的发育过程[6]。其中,蔗糖合酶基因(sucrose synthase,SUS) 被证明可能是调节萝卜(Raphanus sativusL.)肉质根蔗糖水平、控制肉质根库活性的关键基因[9];蔗糖转化酶基因(invertase,INV)被证明正向调控芜菁(Brassica rapaL.)肉质根内果糖和葡萄糖含量,从而加快根中生物量的积累[10],然而这些基因是否参与调控石蒜鳞茎的膨大还鲜见相关报道。另外,糖转运蛋白(sugar transporter protein,SUT)作为一种糖转运载体,也能在植物生长发育等生理过程中发挥重要作用[11]。目前,关于糖转运蛋白在调控果实发育方面的研究较多,其与果实的发育、成熟以及糖积累等过程密切相关,如葡萄(Vitis viniferaL.)[12]、杏(Armeniaca vulgarisLam.)[13]、 番茄(Solanum lycopersicumMill.)[14]等,然而关于SUT 在鳞茎发育过程中的研究还较少。
本研究中以前期构建的同一遗传背景下石蒜自然膨大的鳞茎为材料,利用转录组测序的方式,筛选并研究此过程中碳水化合物相关基因的表达变化,并结合分析淀粉、可溶性糖、蔗糖含量,蔗糖合酶、淀粉合成酶以及淀粉分解酶活性的变化,探讨碳水化合物代谢与石蒜鳞茎膨大调控的关系,以期为后续利用分子生物学等手段提高碳水化合物合成、代谢速率,从而加速石蒜鳞茎的膨大提供理论依据。
1 材料与方法
1.1 试验材料
试验材料为前期构建的同一遗传背景下膨大程度不同的石蒜小鳞茎,这些小鳞茎起源于同一个母球,通过在不同的时间点进行切割后扦插繁殖获得[1]。于2019年1月,当石蒜处于营养生长期时,分别挖取月龄为3、6、12、24 个月4 个不同生长阶段的未分球的鳞茎,并分别编号为S1、S2、S3 和S4,每个生长阶段取6个大小一致的鳞茎(2 个为1 次重复,设3 次重复),去叶、去根、去除鳞茎褐色皮膜,清洗干净晾干后,记录鳞茎直径、周径和鲜重,液氮速冻,-80℃冻存。
1.2 碳水化合物含量测定
采用蒽酮比色法[15]测定石蒜鳞茎中淀粉含量、蔗糖含量以及可溶性糖含量。称取约0.5 g 样品,在液氮中磨成粉末后加入4 mL 80% (v/v)乙醇,在80℃下萃取30 min,8 000×g离心20 min。取上清液用活性炭脱色后用于蔗糖和可溶性糖含量测定;沉淀物依次用9.2 mol·L-1和4.6 mol·L-1的HClO4溶液重悬浮,去除乙醇可溶性糖残留物后用于淀粉含量测定。
1.3 碳水化合物代谢相关酶活性测定
1.3.1 蔗糖合酶(SUS) 称取约0.5 g 样品,在液氮中磨成粉末后加入2 mL pH 值7.5 的提取液进行萃取,萃取液组分为:50 mmol·L-14-羟乙基哌嗪乙磺酸{2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid,HEPES },2.5 mmol · L-1二硫苏糖醇(dithiothreitol,DTT),5 mmol·L-1MgCl2,0.05% (v/v)Triton X-100,1 mmol·L-1乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),0.1% (w/v) BSA,2% (w/v)聚乙烯聚吡咯烷酮(polyvinylpyrrolidone,PVP);4℃、8 000×g离心15 min,收集上清液,参考赵智中等[16]的方法测定分解方向SUS 活性。
1.3.2 淀粉合成酶 称取约0.5 g 样品,在液氮中磨成粉末后加入5 mL 提取液[100 mmol·L-1pH 值7.5的HEPES-NaOH,8 mmol·L-1MgCl2,2 mmol·L-1EDTA,50 mmol·L-1β-巯基乙醇,12.5% (v/v)甘油,1% (w/v) PVP-40],4℃、8 000×g离心15 min,收集上清液,参考Nakamura 等[17]和Wu 等[18]的方法测定AGPase、SSS 和GBSS 活性。
1.3.3 淀粉分解酶 称取约0.5 g 样品,在液氮中磨成粉末后加入5 mL 蒸馏水,室温提取15 min,8 000×g离心10 min,收集上清液,参考王学奎[19]的方法测定α-淀粉酶和β-淀粉酶的活性。
上述酶活性均用对应样品中可溶性蛋白的含量进行换算,而可溶性蛋白含量的测定参考Bradford[20]的方法。
1.4 碳水化合物代谢相关基因的筛选及差异表达分析
根据前期已获得的石蒜鳞茎4 个生长阶段的转录组测序结果[1],在七大公共数据库中对Unigene 序列进行注释,包括NR、NT、Swissprot、KEGG、KOG、Pfam和GO 数据库,根据注释结果筛选碳水化合物代谢相关基因,包括糖代谢及运输、淀粉合成及代谢相关Unigene。
对已筛选得到的Unigene 进一步筛选生物学重复样品间的差异表达基因,Unigene 的表达水平基于FPKM(fragments per kilobase million)值来进行计算,其筛选条件则为FDR (false discovery rate)<0.05 以及|log2 foldchange |≥1。
1.5 石蒜鳞茎RNA 的提取、反转录及qRT-PCR
石蒜鳞茎总RNA 的提取利用MiniBEST Plant RNA Extraction Kit[宝生物工程(大连)有限公司]试剂盒进行,提取步骤参考试剂盒说明书。对提取出的总RNA 进行质量检测,将检验合格后的RNA 利用PrimeScriptTMRT Reagent Kit with gDNA Eraser[宝生物工程(大连)有限公司]试剂盒反转录成cDNA。
将新合成的cDNA 母液稀释10 倍后用作实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)分析,反应体系的配置参照TB GreenTMPremix Ex TaqTMⅡ[宝生物工程(大连)有限公司]试剂盒进行,反应体系中所需各基因引物序列如表1 所示,随后的qRTPCR 反应利用ABI 7500 荧光定量PCR 仪(美国ABI公司)进行。

表1 用于qRT-PCR 分析的引物序列Table 1 Primers used for qRT-PCR analysis
2 结果与分析
2.1 石蒜鳞茎膨大过程中碳水化合物含量的变化
随着石蒜鳞茎的膨大,鳞茎中蔗糖和可溶性糖含量不断升高,而淀粉含量呈现先升高后降低的趋势(图1)。
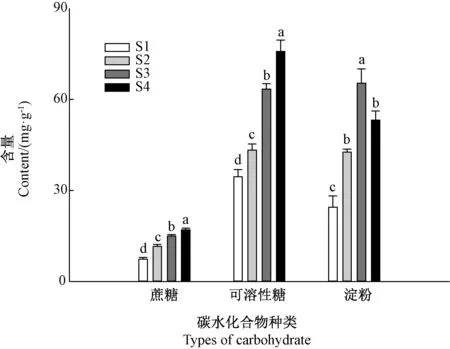
图1 石蒜鳞茎膨大过程中碳水化合物含量的变化Fig.1 Changes in carbohydrate contents in Lycoris radiata bulbs at different stages
2.2 石蒜鳞茎膨大过程中碳水化合物代谢相关酶活性的变化
对石蒜鳞茎膨大过程中蔗糖合酶SUS(分解方向),淀粉合成酶AGPase、SSS 和GBSS,淀粉分解酶α-淀粉酶和β-淀粉酶活性的变化进行检测,发现随着石蒜鳞茎的膨大,鳞茎中碳水化合物代谢相关酶的活性都有升高的趋势(图2),但除SUS 外,同一类型酶活性的变化存在一定差异。在淀粉合成相关酶中,以AGPase 活性的变化更为明显,其次是SSS 和GBSS;而在淀粉分解酶中,β-淀粉酶活性的变化比α-淀粉酶更为明显。

图2 石蒜鳞茎膨大过程中碳水化合物相关酶活性的变化Fig.2 Changs in the activity of carbohydrate metabolism enzymes in Lycoris radiata bulbs at different stages
2.3 糖运输相关差异基因的表达模式
对糖运输相关差异基因进行了筛选,发现至少在1 个比较组中鉴定到10 个差异基因,包括糖转运蛋白(sugar transport protein)STP基因、糖外排转运蛋白(sugars will eventually be exported transporters)SWEET基因以及蔗糖转运蛋白(sucrose transport protein)SUT基因(图3)。除SWEET2a(CL11105_C1)和SUT3(Uni_24278)外,其他8 个基因的表达水平都在石蒜鳞茎膨大过程中上调,尤其以STP6(CL8401_C4)、SWEET13(CL1771_C2)和SUT2(CL4350_C1)基因的表达变化更为明显。

图3 各比较组中糖运输相关基因的差异表达模式Fig.3 Differential expression patterns of genes related to sugar transport in three comparisons
2.4 蔗糖代谢相关差异基因的表达模式
植物体内蔗糖的分解主要有两种途径,并分别由蔗糖合酶SUS 和蔗糖转化酶INV 催化[21]。SUS 可以催化蔗糖转化为UDP-葡萄糖(uridine diphosphate glucose,UDPG)和果糖;INV 可以水解蔗糖为葡萄糖和果糖[22],且其中的中性转化酶(neutral invertase,NI)被证明是促进果糖积累的关键酶[23]。
在SUS 代谢途径中,编码SUS 的SUS1、SUS2、SUS4 基因和尿苷二磷酸葡萄糖焦磷酸化酶(UDPglucose pyrophosphosphprylase,UGP)的UGPA基因基本都在石蒜鳞茎膨大过程中表达上调,尤其以SUS1(Uni_12780)、SUS2(Uni_5817)和UGPA(Uni_22303)基因的表达变化更为明显(图4)。
然而,与INV 途径相关的基因中,除编码碱性/中性转化酶(也被称为胞质转化酶)(alkaline/neutral invertase,cytoplasmic invertases,CINs)的CIN4 基因以及编码己糖激酶(hexokinase,HK)的HK1 和HK2(CL10879_C2)基因外,编码这两个酶的其他基因以及编码果糖激酶(fructokinase,FRK)的FRK基因和编码磷酸葡萄糖变位酶(phosphoglucomutase,PGM)的PGM基因基本都在石蒜鳞茎膨大过程中表达下调(图4)。上述结果表明,SUS 途径可能是石蒜鳞茎膨大过程中催化蔗糖分解的主要途径。

图4 各比较组中蔗糖代谢相关基因的差异表达模式Fig.4 Differential expression patterns of genes related to sucrose metabolism in three comparisons
2.5 淀粉合成相关差异基因的表达模式
对淀粉合成相关基因进行了筛选,包括编码AGPase 大小亚基的AGPL1、AGPL2 和AGPS1、AGPS2基因,编码SSS 的SS2、SS3 基因,编码GBSS 的GBSS1基因以及编码SBE 的SBE1、SBE2、SBE3 基因,这些基因大多在石蒜鳞茎膨大过程中表达上调,但同一类型不同Unigene 之间的表达模式存在一定差异(图5)。

图5 各比较组中淀粉合成相关基因的差异表达模式Fig.5 Differential expression patterns of genes related to starch synthesis in three comparisons
在编码AGPase 大小亚基的相关基因中,AGPS1和AGPL1 基因表达的上调主要在S4/S1 比较组中更为明显,而AGPS2 和AGPL2 基因在整个石蒜鳞茎膨大过程中都表达上调。另外,编码SSS 和SBE 的相关基因中,除SS2(CL4231_C1)、SBE1(Uni_16598)外,其他基因都在石蒜鳞茎膨大过程中表达上调。然而,与SS和SBE相关基因的表达模式相反,GBSS基因中除GBSS1(Uni_27930)在此过程中表达上调外,其他4 个GBSS1 基因都表达下调。
2.6 淀粉代谢相关差异基因的表达模式
淀粉代谢相关基因中,包括编码α-淀粉酶和β-淀粉酶的AMY和BAMY基因以及编码异淀粉酶(isoamylase)的ISA基因,各同源基因的表达模式有所不同。其中,AMY3、BAMY7、BAMY8、BAMY9 以及2 个ISA2 基因都在石蒜鳞茎膨大过程中表达上调,而AMY1、AMY2、BAMY1、BAMY2、ISA1 和最后1 个ISA2 基因在此过程中表达下调(图6)。
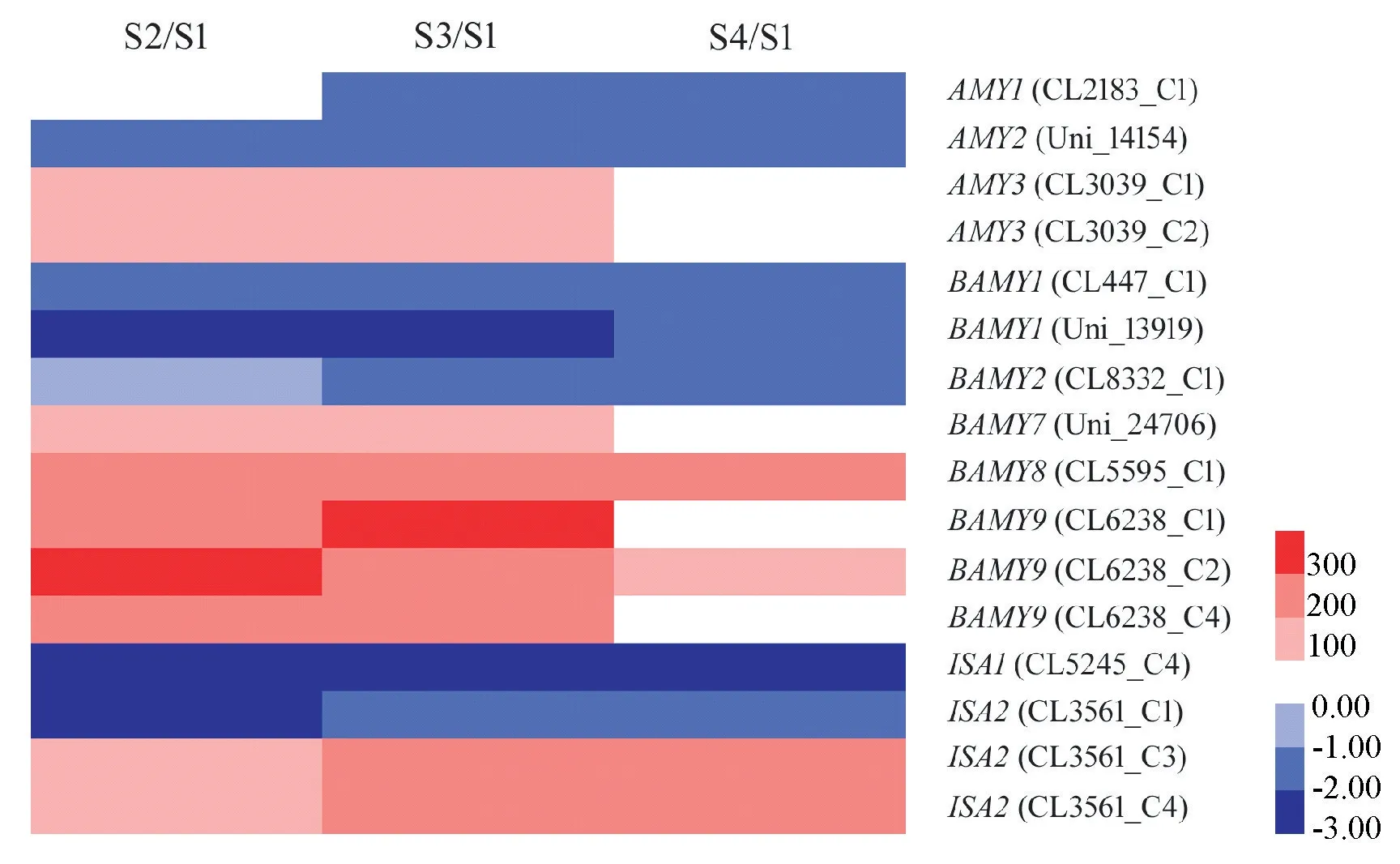
图6 各比较组中淀粉分解相关基因的差异表达模式Fig.6 Differential expression patterns of genes related to starch metabolism in three comparisons
2.7 相关差异基因表达的qRT-PCR 验证
基于转录组数据,在碳水化合物代谢相关基因中选择了6 个具有代表性的基因,在石蒜鳞茎膨大过程中对这些基因的表达变化进行qRT-PCR 验证(图7),包括蔗糖运输基因SUT2(CL4350_C1)、编码蔗糖合酶SUS 的SUS2(Uni_5817)基因、分别编码AGPase 大小亚基的AGPL2(CL3324_C5)和AGPS2(Uni_18445)基因,以及编码SSS 的SS3(CL11774_C2)和编码GBSS的GBSS1(Uni_27930)基因。结果显示这些基因的表达模式与转录组中基因的差异表达规律较为一致,表明转录组所得的结果是比较准确可靠的。

图7 石蒜鳞茎膨大过程中碳水化合物代谢相关基因的相对表达量变化Fig.7 Changes in the expression levels of several genes involved in carbohydrate metabolism in Lycoris radiata bulbs at different stages
3 讨论
随着石蒜鳞茎的膨大,淀粉含量呈现先升高后降低的趋势,这与之前的研究结果相似[4]。在百合中,淀粉能够被分解为可溶性糖,为植株叶片与花芽的形成以及鳞茎发育等形态建成过程提供碳源和能量[24]。本研究中石蒜鳞茎膨大过程中,淀粉酶活性不断升高,表明淀粉分解加剧,这可能是导致后期鳞茎中淀粉含量降低的一个重要原因。另外通过分析淀粉分解相关差异基因的表达变化后发现,石蒜鳞茎膨大过程中α-淀粉酶和β-淀粉酶活性的升高可能主要由编码α-淀粉酶的AMY3 基因和编码β -淀粉酶的BAMY7、BAMY8、BAMY9 基因所调控。
另外,本研究还发现随着石蒜鳞茎的膨大,除淀粉分解速率加快外,淀粉合成速率也明显加快,表现为3种淀粉合成相关酶AGPase、SSS 和GBSS 的活性都不断升高,尤其以AGPase 活性的变化最为明显。AGPase 是淀粉合成的关键酶,它催化淀粉合成的第一步关键反应[25]。植物AGPase 由两个大亚基和两个小亚基组成[26],在玉米(Zea maysL.)和小麦(Triticum aestivumL.)中,过表达编码AGPase 大小亚基的基因能够显著提高其籽粒中淀粉的含量,从而增加粒重[27-28]。另外,在唐菖蒲(Gladilolus hybridus)的研究中发现,利用VIGS(virus-induced gene silencing)技术沉默AGPase 大小亚基基因GhAGPL1 和GhAGPS1,使其表达受抑制后,唐菖蒲种球淀粉的合成受阻,导致新球重量和籽球数目显著降低[29]。因此,石蒜鳞茎中AGPase 活性的增强可能与淀粉的积累以及鳞茎的膨大密切相关,而AGPase 的活性可能主要由编码其大小亚基的基因所调控,如AGPL2 和AGPS2 等。另外,编码其他淀粉合成酶SSS、GBSS 和SBE 的相关基因也在此过程中表达上调,如SS2、SS3、GBSS1、SBE1、SBE2、SBE3 等,从而提高了其对应淀粉合成酶的活性,这些淀粉合成酶协同作用,加快了石蒜鳞茎中淀粉的积累。新合成的淀粉一方面作为一种“库”储藏在鳞茎中,另一方面在淀粉分解相关酶的作用下分解成可溶性糖,并在STP6、SWEET13 等糖转运基因的调控作用下运输至各个鳞茎发育的部位,为细胞分裂、伸长等生理活动提供能量,从而加快石蒜鳞茎的膨大。
除由淀粉分解后得到的麦芽糖和葡萄糖外,蔗糖也在鳞茎发育过程中起重要作用。在百合和其他球根花卉鳞茎中,蔗糖是可溶性糖的主要形式,占可溶性糖含量的70%[30]。在本研究中,随着石蒜鳞茎的膨大,蔗糖含量不断升高,同时蔗糖转运相关基因SUT的表达量也显著提高。SUT 蛋白在蔗糖的转运甚至积累过程中起着重要的作用[31],且SUT 的转录水平已被证明能够受外源糖含量的升高而表达上调[32]。因此,在石蒜鳞茎膨大过程中,SUT基因表达量的升高可能受蔗糖含量上升所引起的反馈调节作用,这也促进了蔗糖向鳞茎发育部位的转运,为鳞茎的后续膨大过程提供能量。
有研究表明,蔗糖分解后的产物可作为淀粉合成的直接底物[33],因此蔗糖含量的升高也可以在一定程度上促进淀粉的合成。在本研究中,石蒜鳞茎中蔗糖向淀粉合成转变的起始主要在蔗糖合酶SUS 的催化下进行,并随后在UGP 的作用下被进一步分解为淀粉合成的中间产物葡萄糖-1-磷酸(Glucose-1-P,Glc-1-P),这一过程可能主要由编码SUS 的SUS1、SUS2、SUS4 和编码UGP 的UGPA基因所调控。随后,中间产物Glc-1-P 分别在AGPase、SSS、GBSS 以及SBE 等淀粉合成酶的作用下,逐渐合成淀粉,而这一过程也与上述淀粉合成过程的研究结果相对应。
4 结论
本研究通过分析石蒜鳞茎膨大过程中碳水化合物含量、相关酶活性和碳水化合物代谢相关基因的表达变化,发现随着石蒜鳞茎的膨大,蔗糖含量不断升高,蔗糖转运相关基因SUT的表达也显著上调,并随后在蔗糖代谢酶SUS 以及淀粉合成酶AGPase、SSS 和GBSS 活性增强的作用下,加速合成淀粉,这一过程受到编码蔗糖代谢及淀粉合成相关酶基因的调控,如SUS1、SUS2、SUS4、UGPA、AGPS2、AGPL2、SS2、SS3、GBSS1、SBE1、SBE2、SBE3 等。另外,淀粉分解酶的活性也在分别编码α-淀粉酶和β-淀粉酶的AMY3 和BAMY7、BAMY8、BAMY9 基因的正向调控作用下不断升高,从而加速淀粉的分解,促进可溶性糖含量的积累,并可能在糖转运相关基因STP6 和SWEET13 等的作用下加快向鳞茎发育部位的转运,为鳞茎的膨大提供能量。
