花生黑腐病抗病品种筛选及抗病相关酶活性测定
2021-09-10袁汇涛张云霞向梅梅董章勇
袁汇涛 张云霞 向梅梅 罗 梅 董章勇
(1仲恺农业工程学院植物健康创新研究院,广东 广州 510225;2仲恺农业工程学院农业与生物学院,广东 广州 510225)
花生黑腐病(peanut black rot)是由花生黑腐病菌(Calonectria ilicicola,冬青丽赤壳,无性阶段为寄生柱帚霉Cylindrocladium parasiticum)引起的花生毁灭性病害。该病于1966年首次在美国乔治亚州的花生产区被发现[1],随后扩散到日本、韩国和澳大利亚等国家[2-6]。2009年,我国首次发现花生黑腐病,部分花生产区发病率高达50%[7];随后,还发现了由花生黑腐病菌引起的大豆红冠腐病,该菌对华南地区的优质大豆品种具有极强的侵染力,个别地块发病率高达80%[8]。潘汝谦等[9]根据国际植物检疫措施标准规定的有害生物风险性分析程序,评估得出花生黑腐病菌在中国属于高度风险性有害生物,对花生和大豆等作物的生产构成严重威胁。我国修订的《中华人民共和国进境植物检疫性有害生物名录》将花生黑腐病菌列为新外来入侵检疫性病菌[10]。
花生黑腐病菌的侵染力强,寄主范围广,能以微菌核的形式在土壤中存活很长时间,可通过种子、带菌土壤、病残组织等多种途径传播[9,11-12]。一旦侵染发病,可引起花生的果针、荚果和根系变黑腐烂,最终导致患病植物萎焉和死亡,造成损失一般在10%以上,受害严重时损失率高达50%[1,6]。杀菌剂虽然可以有效减少苗期病害的产量损失[6,13-14],但筛选和培育抗病品种是防治病害最为经济、有效和环保的途径[15-19]。蓝国兵等[20]用苗期接种法对广东推广种植的15 个主要花生品种的花生黑腐病抗性水平进行了鉴定,筛选到2 个抗病品种,1 个高感品种。但该研究筛选的花生品种数量较少,且未对其抗性机制进行探究。
本研究拟通过幼芽水培接种方法对128 个花生品种进行花生黑腐病的抗性鉴定,通过盆栽接种方法进行检验,并测定花生接种病原菌后抗病相关酶活性的变化,以期为花生黑腐病抗病育种及品种的田间应用提供理论依据。
1 材料与方法
1.1 试验材料
花生黑腐病菌菌株Ci14017 分离自广东省梅州市花生田间病株,由仲恺农业工程学院植物病理重点实验室保存。128 个供试花生品种(或材料)由仲恺农业工程学院郑奕雄教授惠赠。
1.2 抗病性评价标准
根腐等级参照Dong 等[21]的方法划分为5 级,分级标准描述如下:0 级:没有症状;1 级:茎基部轻微变褐;2 级:茎基部变黑,主根变黑长度小于50%;3 级:茎基部变黑,主根变黑长度大于50%,有少许次生根存在;4 级:主根完全变黑并开始腐烂,次生根腐烂掉落;5 级:主根完全变黑腐烂,植株萎蔫甚至死亡。
病情指数=∑(各级发病株数×各级代表数值)/(调查总数×最高病情级数)×100。
免疫(Ⅰ):病情指数=0;高抗(HR):0<病情指数≤10;中抗(MR):10<病情指数≤20;中感(MS):20<病情指数≤30;高感(HS):病情指数>30。
1.3 水培花生的抗病性测定
选取健康的花生种子放入培养皿中,加无菌水放置于30℃培养箱中黑暗催芽2 d。每隔12 h 换一次水。选取胚根1~2 cm 长的幼芽用于试验。
将花生黑腐病菌接种于马铃薯葡萄糖(potato dextrose,PD)培养液中,25℃、180 r·min-1培养5 d。用灭菌纱布过滤菌液,刮取菌丝,吸干水分后称取5 g 菌丝加入1 L 无菌水中匀浆备用。幼芽以0.5%菌丝悬浮液浸泡10 min 接种,保湿2 d 后水培,25℃光照培养室中生长10 d 后观察。对128 份花生品种进行抗病性鉴定,以无菌水为对照,每个品种3 次重复,每个重复10 株。
1.4 盆栽花生的抗病性测定
称取30 g 燕麦粒煮沸30 min,装入100 mL 组培瓶中灭菌,将花生黑腐病菌接种至燕麦粒培养基上,25℃培养7 d,晾干备用。
将T09、AS09、P562、桂花35、云花生1 号等5 个花生品种催芽,以带菌燕麦粒拌土接种法进行温室盆栽抗性试验,接种浓度为0.5%,每次品种3 次重复,每次重复10 株。25℃恒温光照培养室中培养30 d 后观察。
1.5 抗病相关酶的提取和活性测定
以T09 和P562 两个花生品种为研究对象,采用上述幼芽水培的方法进行病原菌接种。每个处理3 次重复,每次重复15 粒种子。分别于接种后0、0.25、0.5、1、3、5、7、9 d 取样,提取粗酶液进行酶活性的测定。
过氧化物酶(peroxidase,POD)、苯丙氨酸解氨酶(phenylalaninammo-nialyase,PAL) 和多酚氧化酶(polyphenoloxidase,PPO)提取和活性测定参照范兰兰等[22]的方法;超氧化物歧化酶(superoxide dismutase,SOD)的提取和活性测定参照王辉[23]的方法。
1.6 数据处理
数据的统计分析使用Excel 软件与DPS 进行。
2 结果与分析
2.1 水培花生的抗病性评价
由表1 可知,病情指数大于30 的品种有72 个,病情指数为20~30 的品种有43 个,病情指数为10~20品种有13 个,病情指数在10 以下的品种有1 个。由此可知,128 个花生品种中,对花生黑腐病表现出免疫、高抗、中抗、中感、高感的品种分别有0、1、13、42 和72 个,分别占供试花生品种的0、0.8%、10.2%、33.7%和56.3%。其中,T09 的病情指数最低,为8.0,发病率为36.7%;P562 的病情指数最高,为46.0,发病率为100%。

表1 128 个花生品种抗花生黑腐病的病情统计Table 1 Disease statistics of 128 peanut varieties resistant to peanut black rot
2.2 盆栽花生的抗病性评价
以水培测试后确定不同抗性的T09(HR)、AS09(MR)、P562(HS)、桂花35(HS)、云花生1 号(MS)为研究对象,以带菌燕麦粒拌土接种法进行花生盆栽抗性试验。接种30 d 后观察发现,接种花生黑腐病菌的花生植株全部发病,根部基本变黑或腐烂死亡,而对照花生根茎健康无病症(图1)。其中,P562 花生发病最为严重,植株死亡率为41.1%,部分植株茎基部已经长出红色子囊果;桂花35 发病程度次之,植株死亡率为25%,亦有部分死亡植株茎基部长出子囊果;而云花生、AS09、T09 发病程度较轻,死亡率分别为15%、13.3%和11.1%(表2)。由此可见,T09 最抗病,P562最感病。盆栽试验的结果与幼芽水培接种试验的结果一致。
2.3 抗病相关酶活性的变化
2.3.1 PAL 活性的变化 由图2 可知,T09 和P562两个品种接种花生黑腐病菌后,PAL 活性均升高。其中,高抗品种T09 的PAL 活性在接种后0.5 和5 d 分别出现高峰,而高感品种P562 在接种后1 d 出现高峰。T09最大峰值为451.09 U·g-1·h-1FW,P562最大峰值为318.37 U·g-1·h-1FW。抗病品种在接种病原菌后PAL 活性峰值出现较早,峰值出现的次数也较多;感病品种在接种病原菌后PAL 活性峰值出现较晚,峰值出现的次数较少。
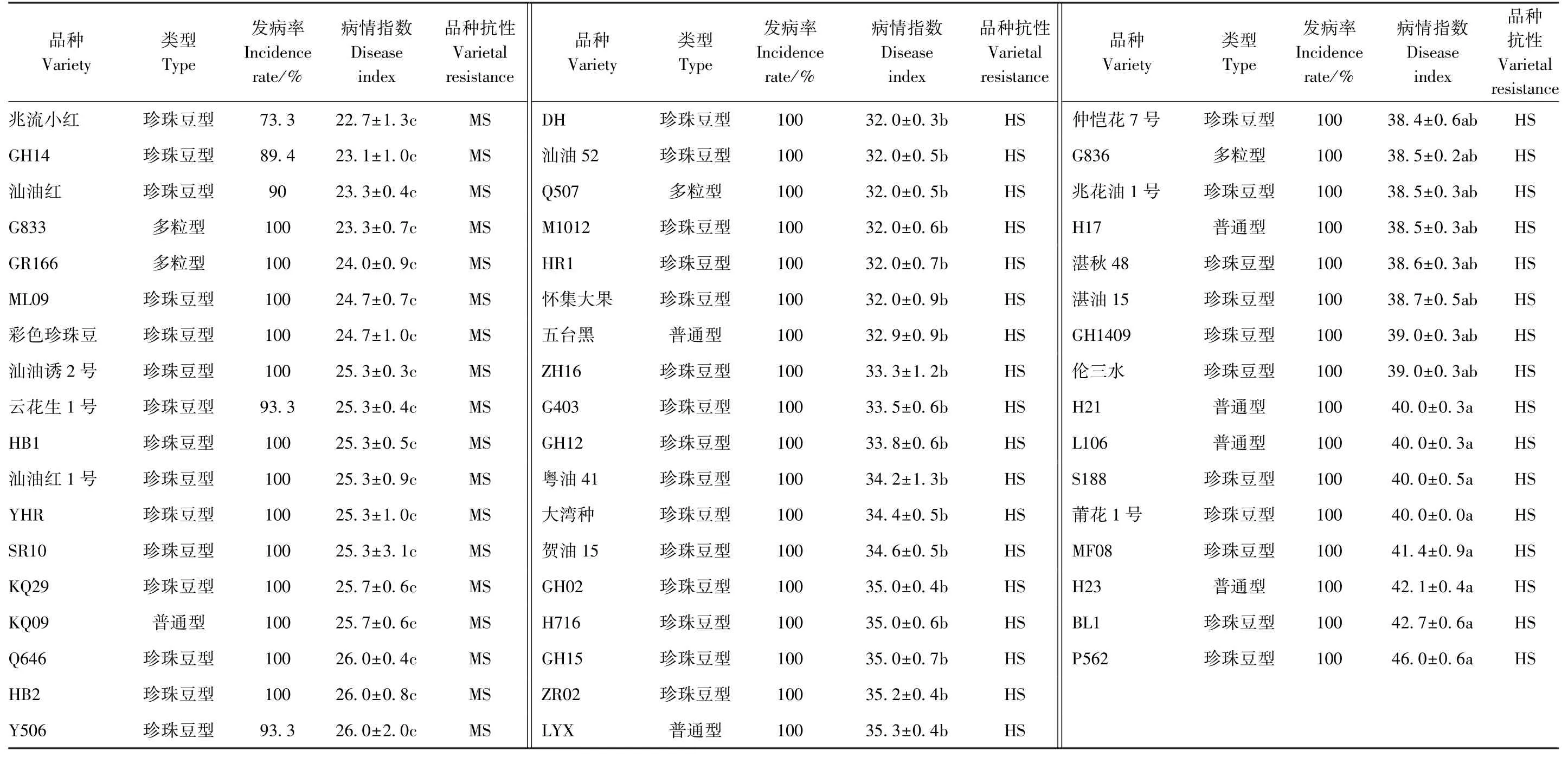
表1(续)
2.3.2 PPO 活性的变化 由图3 可知,T09 和P562 两个品种接种花生黑腐病菌后PPO 活性均升高,高抗品种T09 的PPO 活性在接种后0.5 d 出现峰值,最大峰值为271.67 U·g-1·min-1FW;高感品种P562 在接种后1 d出现峰值,最大峰值为160.02 U·g-1·min-1FW。高抗品种接种病原菌后其酶活性出现峰值较早且峰值大,而高感品种接种病原菌后其酶活性出现峰值较晚且峰值较小。
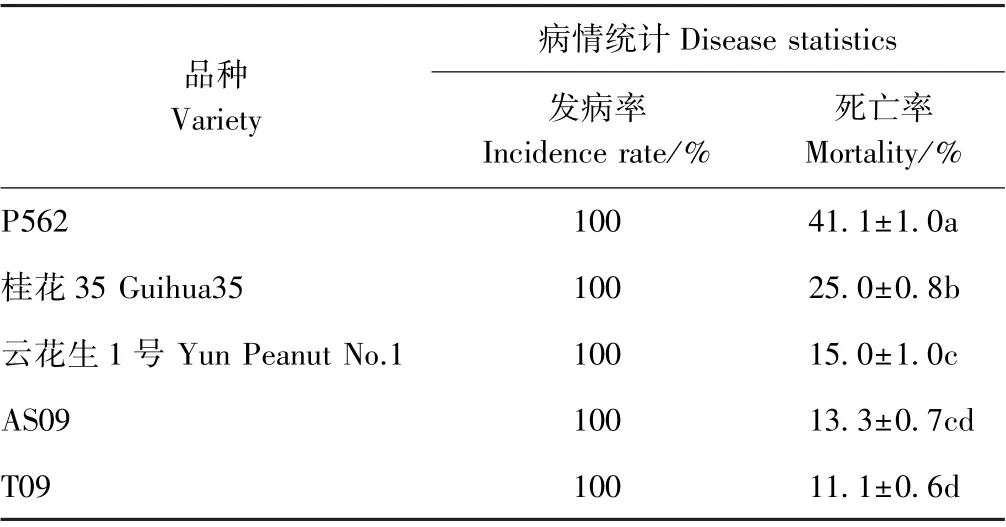
表2 不同花生抗性品种室内盆栽试验花生黑腐病的发病情况Table 2 Incidence of black rot of peanut in laboratory pot experiment of different peanut resistant varieties
2.3.3 POD 活性的变化 由图4 可知,两个品种接种花生黑腐病菌后POD 活性均升高,其中,高抗品种T09的POD 活性在接种后0.5 d 出现高峰,最大峰值为239.23 U·g-1·min-1FW,高感品种P562 均在接种后0.25 d 出现高峰,最大峰值为135.75 U·g-1·min-1FW。高抗品种接种病原菌后其酶活性虽出现峰值较晚但峰值较高,而高感品种接种病原菌后其酶活性虽出现峰值较早但峰值较低。
2.3.4 SOD 活性的变化 由图5 可知,两个品种接种花生黑腐病菌后SOD 活性均升高,其中,高抗品种T09 在接种后的第7 天出现高峰,最大峰值为28.08 U·g-1·h-1FW;高感品种P562 在接种后的第3 天出现高峰,最大峰值为16.79 U·g-1·h-1FW。
3 讨论
本研究使用幼芽水培接种的方法对128 个花生品种的抗性进行筛选,通过带菌燕麦粒拌土接种的方法对不同抗性水平的5 个品种进行检验,结果与幼芽水培接种鉴定的结果一致。关于花生黑腐病抗性鉴定方法有田间自然诱发鉴定和温室人工接种鉴定两种[20]。然而,田间影响花生黑腐病发生的因素有很多,因此田间自然诱发的鉴定结果稳定性不高,试验重复性较差。温室人工接种鉴定方法有微菌核拌土接种法和麦粒菌种拌土接种法,但微菌核拌土接种最少需要12 周,麦粒菌种拌土接种最少需要7 周,试验周期较长[21,24]。本研究所建立的菌丝悬浮液浸泡幼芽,保湿后水培的花生黑腐病抗性鉴定方法简便、高效,10 d 即可获得结果,且所得结果稳定性好、重复性高,非常适合应用于苗期抗病品种的大规模筛选。
本研究的128 个花生品种对黑腐病表现出抗病和感病的品种分别为14 和114 个,占11%和89%。蓝国兵等[20]对15 个花生品种进行抗性水平鉴定,获得抗病和感病品种分别为9 和6 个,占60%和40%。抗感品种的比例有较大差别,原因可能有以下三点:首先,使用的花生品种不一样,难以直接对比;其次,接种方法和抗性标准不同也可能会造成鉴定结果的差异;再次,其他研究选择的是致病力中等的菌株进行抗病性鉴定,而本研究所用的Ci14017 菌株则是高致病力菌株,虽然没有直接比较两者之间的致病力差异,但使用的菌株不同也可能是造成鉴定结果的比例有差异的原因。本研究尽管没有筛选出对花生黑腐病免疫的品种,但只要扩大筛选范围,将会继续丰富抗病品种的数量,为花生品种的推广和布局提供更充足的依据。
本研究所鉴定的128 份品种多数为农家种和外引材料,未涉及非近缘种和野生种。抗性鉴定结果表明,虽然不同遗传背景花生品种对黑腐病的抗性存在差异,但大部分为感病品种,高抗花生黑腐病型材料严重缺乏。本研究结果表明,表现中抗的品种大部分为农家种,因此应重视和加强对农家种、野生种和非近缘种的筛选鉴定。同时,要特别重视材料水平抗性的鉴定和筛选,确保材料抗病性的稳定和适用范围。
PAL、PPO、POD 和SOD 被认为和抗病性密切相关[25-28],在抗病花生品种中酶的活性会显著升高[22,29]。本研究选用高抗品种T09 以及高感品种P562 测定PAL、PP、 POD 和SOD 活性。在接种花生黑腐病菌之前,T09 的4 种酶活性都比P562 的高,说明这些酶都不同程度地参与了花生的抗病性,并且在抗病品种中参与程度更高。在接种花生黑腐病菌之后,T09 的4 种酶活峰值比P562 的更高,表明在病原菌的胁迫下,抗病品种的防御相关酶得到充分的诱导,更多抗性物质被调用,形成保护屏障,抵抗病原微生物的侵害。
4 结论
本研究128 个花生品种对花生黑腐病表现出抗病和感病的品种分别14 和114 个,占11%和89%;其中T09 为高抗品种,P562 为感病性最高的高感品种。在接种花生黑腐病菌之前,T09 的PAL、PPO、POD 和SOD 四种酶活性都比P562 的高;在接种花生黑腐病菌之后,T09 的四种酶活峰值均比P562 的更高。本研究为后续深入探讨花生黑腐病的抗病机制及花生高抗品种的选育奠定了基础。
