驼乳脂对CIA模型大鼠血清炎症因子及关节滑膜中炎症基因表达的影响
2021-09-09佟臻昊斯仁达来
伊 丽,李 磊,王 昆,佟臻昊,何 静,斯仁达来
(1 内蒙古农业大学乳品生物技术与工程教育部重点实验室 呼和浩特 010018 2 内蒙古骆驼研究院 内蒙古阿拉善盟 737300)
类风湿关节炎(Rheumatoid arthritis,RA)是一种以损害关节滑膜、软骨和骨骼为特征的慢性炎症性疾病[1-2]。RA 主要发病部位为手、腕、足等小关节。该病易反复发作,常为双手、双腿同时发病,呈对称性分布。患病早期有关节红肿热痛和功能障碍表现,到晚期时,关节可出现不同程度的僵硬畸形,并伴有骨损伤和骨骼肌萎缩,极易致残。RA影响到全世界1%的人口,其发病率和死亡率也一直较高。迄今为止,类风湿性关节炎尚无特效疗法[3],治疗主要以镇痛、消炎,防止或减缓关节变形及损伤,增加关节活动度为主。临床上治疗的药物主要有非甾体类抗炎药、糖皮质激素、改善病情的抗风湿药等。虽然能够缓解疾病进程,但是也存在着严重的不良反应、毒副作用、耐药性以及高额的药物治疗成本等缺点,结果都难以令人满意[4-5]。鉴于西药的缺陷,赵静[6]利用弗氏佐剂与胶原蛋白混合液构建类风湿关节炎模型,发现青藤碱可以有效缓解类风湿关节炎的作用。甘可[7]研究发现雷公藤可以显著抑制胶原诱导关节炎小鼠关节炎症,还能抑制破骨细胞分化激活。林兵[8]通过动物体内药效学实验证实了豆豉姜提取物的抗类风湿关节炎作用。古丽巴哈尔·卡吾力等[9]、Li 等[10]和Lu 等[11]研究发现食用含有ω-3 的不饱和脂肪酸可以预防类风湿性关节炎及骨质疏松症等。
早在20世纪60年代,部分东南亚地区就有利用驼乳脂涂抹伤口的先例[12]。《本草纲目》上记载,驼脂具有主治顽痹风骚、恶疮毒肿、肌肉僵硬等症状,有润燥、祛风、活血、消肿等功效[13]。Arab等[14]研究发现将驼乳灌胃可有效缓解大鼠类风湿关节炎。目前,Ⅱ型胶原诱导型关节炎(Collageninduced arthritis,CIA)模型是最为常用的RA 模型,该模型具有与人类RA 相似的免疫学与病理学特征,且模型稳定,是筛选治疗RA 药物的理想模型[15-18],本试验采用Wistar 大鼠建造CIA 模型,通过为期30 d 的驼乳脂涂抹干预,观察大鼠的临床表现、血清中的炎性因子、滑膜组织病理学切片和基因的相对表达量,探讨驼乳脂对类风湿性关节炎大鼠的影响,为研究类风湿性关节炎提供一定的理论依据。
1 材料与方法
1.1 动物、材料与试剂
4~6 周雌性Wistar 大鼠32 只,体质量(150±20)g,清洁级,由北京维通利华实验动物中心提供。
弗氏完全佐剂、Ⅱ型胶原蛋白,美国Sigma 公司;扶他林,北京诺华制药有限公司;定量酶联检测试剂盒,上海酶联生物科技有限公司。
1.2 仪器与设备
SIGMA 3-18K 高速台式冷冻型离心机、BSA223S-CW 电子精密天平,德国Sartorius 公司;SQ2125 石蜡切片机,Leica 公司;实时荧光定量PCR 仪,ABI 公司;全自动核酸提取仪,Taco 公司。
1.3 方法
1.3.1 驼乳脂的制备 从阿拉善右旗采集自然放牧3~6 岁成年双峰驼乳样,采集后迅速用冰袋冷冻保存,试验前缓慢解冻,至于离心机中5 000 r/min 离心30 min 上层即为乳脂。
1.3.2 CIA 大鼠模型的制备 将大鼠随机分为4组:正常组、模型组、扶他林组、驼乳脂组,每组8只。先用0.1 mol/L 醋酸充分溶解的牛Ⅱ胶原蛋白配制成质量浓度为2 mg/mL 的溶液于4 ℃冰箱保存,与弗氏完全佐剂等体积混合充分乳化。除正常组外,分别于大鼠左后足皮下注射0.1 mL 致炎,14 d 后改为尾巴根部同等剂量注射再次免疫。
二次免疫7 d 后,扶他林组涂抹扶他林,驼乳脂组涂抹驼乳脂,每组每天涂抹3 次,连续30 d。
1.3.3 CIA 大鼠外形评价 建模后,观察大鼠的情绪、活动量、采食量、体质量以及足爪肿胀度的变化。
1.3.4 大鼠关节炎指数评价 关节炎指数是判断大鼠患病的重要的外观检验指标,主观的对关节炎病情的严重程度进行定量评价,对病情的变化有着参考价值。
从建模开始每隔7 d 判定一次,采用大鼠类风湿关节炎评分标准,对大鼠两只后足进行评分,并求出每只大鼠后足关节炎评分的平均值,再根据每只大鼠关节炎评分算出每组大鼠关节炎评分平均值并记录。大鼠类风湿关节炎评分标准如下:0 分,后足没有关节炎表现;1 分,1~2 个关节发红,软组织发生肿胀;2 分,3~4 个关节发红,软组织发生肿胀;3 分,后足5 个或更多关节发红,软组织发生肿胀;4 分,后足严重关节炎。每只大鼠两肢评分相加总分为关节炎指数,最高8 分[19]。
1.3.5 大鼠体质量指标 体质量变化是动物对不利条件产生的首个机体适应性变化,可以直观地反映机体的健康状态,是动物病理实验普通考察的指标之一,每隔4 d 对大鼠体质量进行测定。
1.3.6 大鼠左后足爪肿胀度 建模开始后每隔4 d 利用电子游标卡尺测定大鼠左后足厚度。
1.3.7 大鼠关节影像学观察 处死前,乙醚麻醉大鼠,对大鼠足趾及膝关节进行X 光拍摄。
1.3.8 大鼠肝、脾、肾脏器指数 试验结束后,心脏采血处死大鼠,常规无菌操作,采取大鼠肝、脾、肾脏,称重并记录数据。
1.3.9 滑膜组织病理学检查 心脏釆血处死大鼠,取大鼠滑膜组织,利用4%多聚甲醛固定,10%EDTA 脱钙,常规脱水,石蜡包埋,切片。
1.3.10 血清中细胞因子含量的测定 心脏釆血,收集血液静止后离心机离心,-20 ℃低温保存,按照试剂盒的操作说明书进行白介素-10 (IL-10)、白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)检测。
1.3.11 滑膜组织中相关炎症因子mRNA 表达的检测 打开关节腔后,完整的剥离大鼠滑膜组织,于-80 ℃冰箱保存待测。提取滑膜组织的RNA,并逆转录为cDNA,根据各组的平均CT 值,计算出每个基因的相对表达量[20]。
1.4 数据处理
采用SPSS 20.0 对数据进行统计分析;并利用GraphPad 进行了图片绘制和相关性分析。
2 结果与分析
2.1 CIA 大鼠外形的变化
二次免疫后,大鼠出现明显的关节炎特征,精神状态不佳,饮食量下降,体质量明显下降,情绪易怒,活动能力有所下降,足爪红肿疼痛不能着地,尾巴有溃烂现象。扶他林组和驼乳脂组大鼠上述现象都有所减缓,大鼠后足爪肿胀程度有一定缓解和消失。其中,扶他林组大鼠效果明显;驼乳脂组大鼠原发性肿胀并没有消失,但继发性的红肿得到了抑制,活动量、饮食量都有所增加,精神状态良好;从外观来看,与空白组大鼠相比,驼乳脂有很好的效果。
2.2 驼乳脂对大鼠关节炎指数的影响
试验观察了大鼠从建模开始到涂抹处理结束过程中驼乳脂对CIA 大鼠关节炎指数的影响。由图1可知,除空白组外,二次免疫前(第14 天)各组关节炎指数以一定速率迅速升高。开始涂抹时,模型组关节炎指数还有增长的趋势,大约35 d后,由于大鼠自身的抵抗能力,关节炎指数开始下降,但最终关节炎指数(7.80±0.45)显著高于扶他林组和驼乳脂组关节炎指数(P<0.05);扶他林(3.60±0.55)对类风湿性关节炎的缓解效果大于驼乳脂(4.80±0.45)。

图1 驼乳脂对大鼠关节评分的影响Fig.1 Effect of camel milk fat on rat joint score
2.3 驼乳脂对大鼠体质量的影响
从建模前到涂抹处理完成,对整个过程大鼠体质量的变化进行了测试。结果显示,空白组大鼠体质量随着周龄的增加以一定的速率增加;第0天,由于大鼠周龄比较小,代谢比较旺盛,各组大鼠体质量迅速增加,第14 天为二次免疫时间,模型组、扶他林组和驼乳脂组大鼠体质量开始下降且有显著性差异(P<0.05)。第21 天开始,由于模型组大鼠自身也有抵抗力,所以模型组大鼠体质量也有增长的趋势,然而扶他林组和驼乳脂组大鼠体质量增长值显著大于模型组大鼠体质量(P<0.05),伴随着大鼠精神状态改善,食欲增加等现象。
表1 驼乳脂对大鼠体质量的影响(±s,n=8)Table 1 Effect of camel milk fat on rat body weight (±s,n=8)
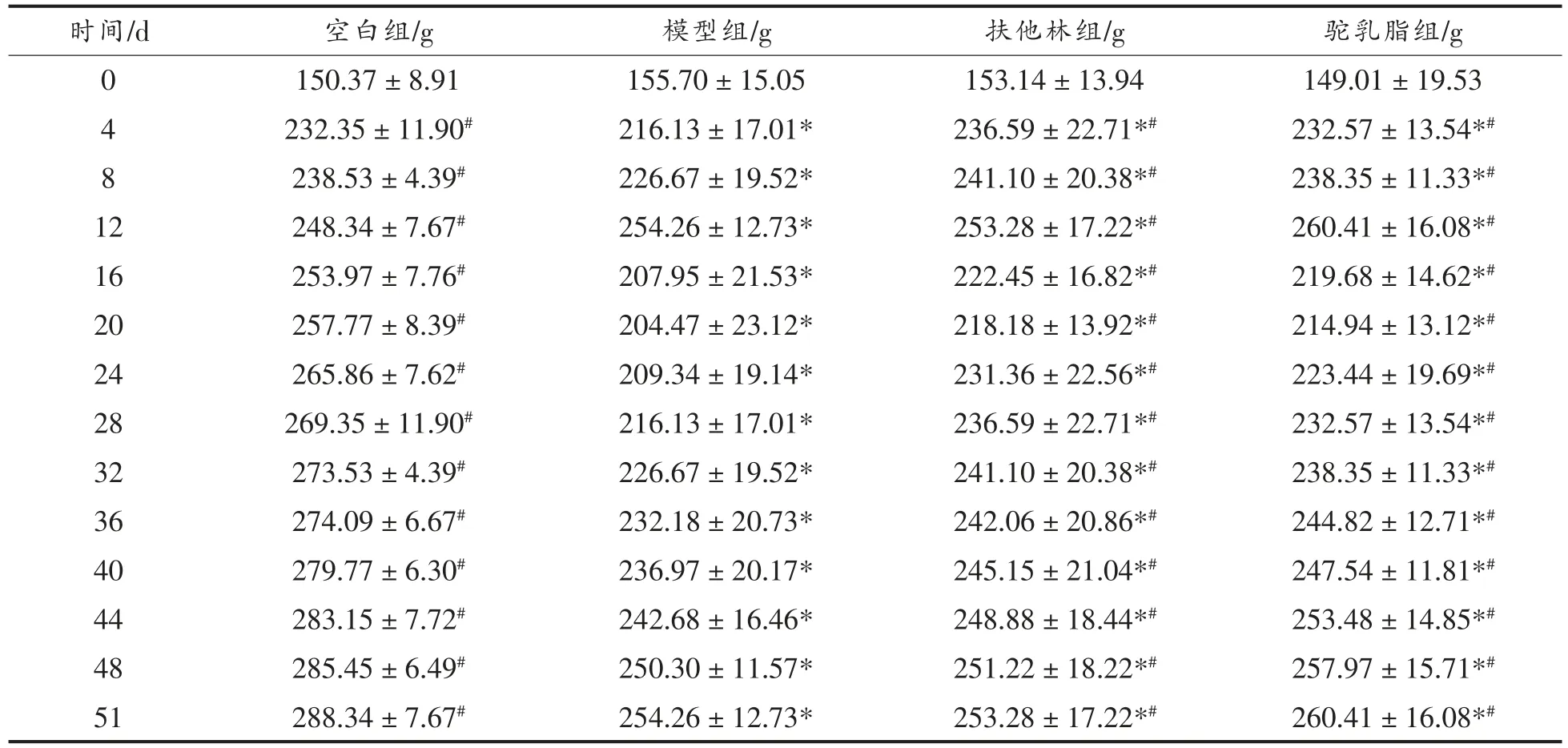
表1 驼乳脂对大鼠体质量的影响(±s,n=8)Table 1 Effect of camel milk fat on rat body weight (±s,n=8)
注:*.与空白组相比差异显著(P<0.05),#.与模型组相比差异显著(P<0.05)。
时间/d 空白组/g 模型组/g 扶他林组/g 驼乳脂组/g 0 150.37±8.91 155.70±15.05 153.14±13.94 149.01±19.53 4 232.35±11.90# 216.13±17.01* 236.59±22.71*# 232.57±13.54*#8 238.53±4.39# 226.67±19.52* 241.10±20.38*# 238.35±11.33*#12 248.34±7.67# 254.26±12.73* 253.28±17.22*# 260.41±16.08*#16 253.97±7.76# 207.95±21.53* 222.45±16.82*# 219.68±14.62*#20 257.77±8.39# 204.47±23.12* 218.18±13.92*# 214.94±13.12*#24 265.86±7.62# 209.34±19.14* 231.36±22.56*# 223.44±19.69*#28 269.35±11.90# 216.13±17.01* 236.59±22.71*# 232.57±13.54*#32 273.53±4.39# 226.67±19.52* 241.10±20.38*# 238.35±11.33*#36 274.09±6.67# 232.18±20.73* 242.06±20.86*# 244.82±12.71*#40 279.77±6.30#7.72#236.97±20.17* 245.15±21.04*# 247.54±11.81*#44 283.15±242.68±16.46* 248.88±18.44*# 253.48±14.85*#48 285.45±6.49# 250.30±11.57* 251.22±18.22*# 257.97±15.71*#51 288.34±7.67# 254.26±12.73* 253.28±17.22*# 260.41±16.08*#
2.4 驼乳脂对大鼠原发性肿胀度的影响
对大鼠足趾注射牛Ⅱ蛋白乳浊液引起的直接性肿胀,称为原发性足肿胀。本试验所指的原发性肿胀为大鼠左后足肿胀度,可以直接表示关节炎的病情严重程度。结果显示,空白组肿胀度一直保持在3 mm 左右。建模后,各组大鼠左后足爪肿胀度迅速增长,第20 天左右,关节炎肿胀达到高峰,从涂抹处理开始,肿胀度逐渐减缓。由于模型组大鼠自身也有抵抗能力,大约从第24 天足爪肿胀度也有一个下降的趋势,但肿胀度显著高于扶他林组和驼乳脂组(P<0.05)。表2可直观的看到扶他林组和驼乳脂组对CIA 关节炎大鼠足爪原发性肿胀有一定的抑制作用;但从第28 天开始,扶他林组大鼠足爪肿胀度显著低于驼乳脂组肿胀度(P<0.05);这说明扶他林对CIA 关节炎大鼠足爪原发性肿胀的抑制作用高于驼乳脂。
表2 驼乳脂对大鼠原发性肿胀度的影响(±s,n=8)Table 2 Effect of camel milk fat on primary swelling degree in rats(±s,n=8)
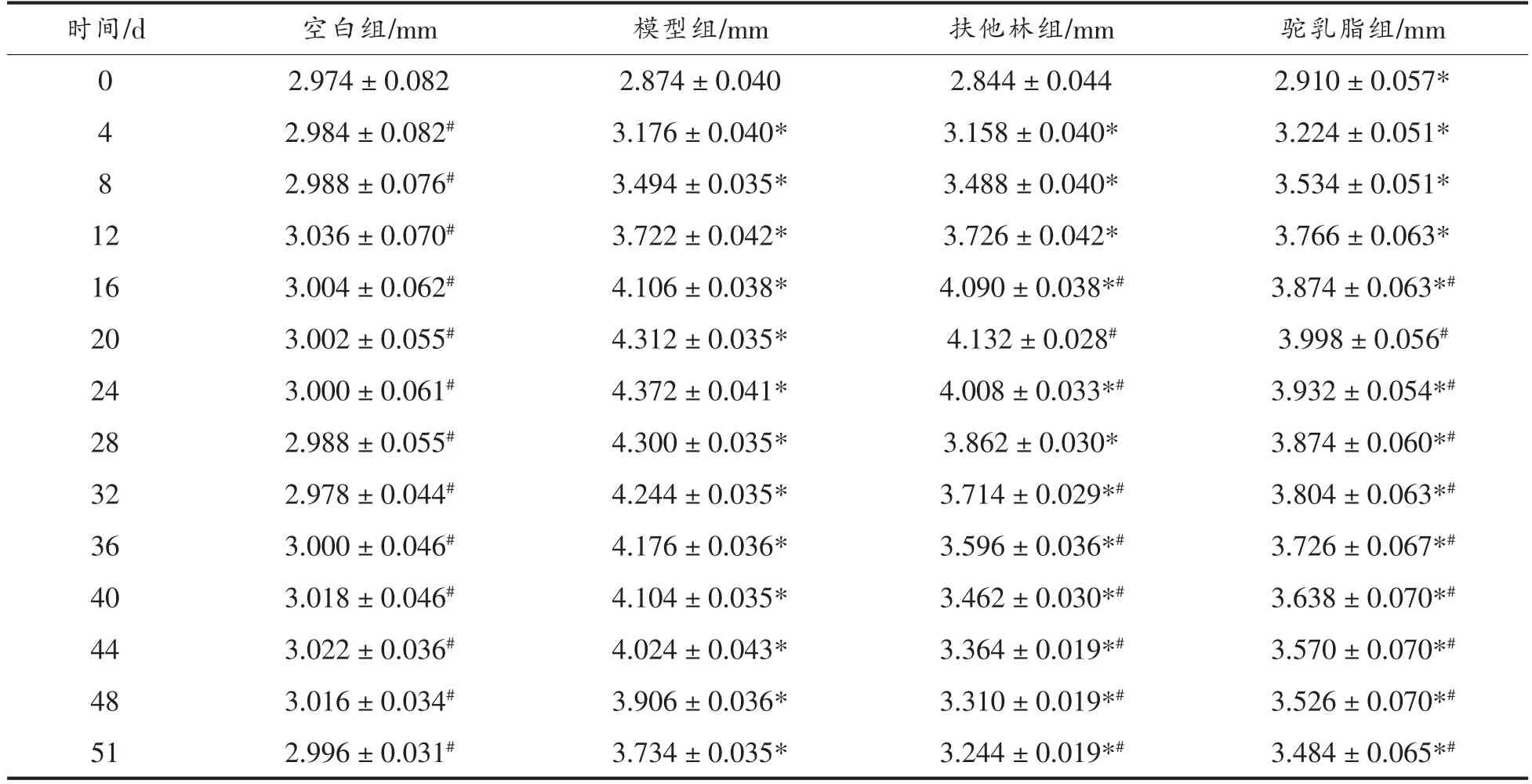
表2 驼乳脂对大鼠原发性肿胀度的影响(±s,n=8)Table 2 Effect of camel milk fat on primary swelling degree in rats(±s,n=8)
注:*.与空白组相比差异显著(P<0.05),#.与模型组相比差异显著(P<0.05)。
?时间/d 空白组/mm 模型组/mm 扶他林组/mm 驼乳脂组/mm 0 2.974±0.082 2.874±0.040 2.844±0.044 2.910±0.057*4 2.984±0.082# 3.176±0.040* 3.158±0.040* 3.224±0.051*8 2.988±0.076# 3.494±0.035* 3.488±0.040* 3.534±0.051*12 3.036±0.070# 3.722±0.042* 3.726±0.042* 3.766±0.063*16 3.004±0.062# 4.106±0.038* 4.090±0.038*# 3.874±0.063*#20 3.002±0.055# 4.312±0.035* 4.132±0.028# 3.998±0.056#24 3.000±0.061# 4.372±0.041* 4.008±0.033*# 3.932±0.054*#28 2.988±0.055# 4.300±0.035* 3.862±0.030* 3.874±0.060*#32 2.978±0.044# 4.244±0.035* 3.714±0.029*# 3.804±0.063*#36 3.000±0.046# 4.176±0.036* 3.596±0.036*# 3.726±0.067*#40 3.018±0.046# 4.104±0.035* 3.462±0.030*# 3.638±0.070*#44 3.022±0.036# 4.024±0.043* 3.364±0.019*# 3.570±0.070*#48 3.016±0.034# 3.906±0.036* 3.310±0.019*# 3.526±0.070*#51 2.996±0.031# 3.734±0.035* 3.244±0.019*# 3.484±0.065*#
2.5 驼乳脂对大鼠关节的影响
X 射线影像可观察到周围软组织的变化,例如肿胀、增厚、关节间隙增大、骨侵蚀、骨变形等情况。由图2和3 可知,空白组大鼠足爪骨骼轮廓清晰,关节间隙较小,膝关节骨密度坚实,滑膜组织没有增厚现象;模型组大鼠足爪骨骼轮廓严重模糊,关节间隙被炎性细胞填充,膝关节骨侵蚀现象严重,滑膜组织严重增厚。扶他林组大鼠足爪轮廓明显缓解,骨骼较清晰,膝关节骨侵蚀现象消失,软组织明显变薄;驼乳脂组足爪关节肿大现象明显减轻,足趾间隙明显缓解,膝关节软组织也有很大的改善。

图2 大鼠足爪光学检测Fig.2 Optical detection of rat paws
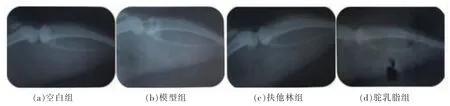
图3 大鼠膝关节光学检测Fig.3 Rat knee joint optical detection
2.6 驼乳脂对大鼠脏器指数的影响
实验动物的内脏器官质量和脏器系数是其主要的生物学特性之一,实验动物脏器的质量及其系数能反映动物所处的生长发育阶段和生理状况[21]。由图4可知,模型组各脏器指数显著高于其它组(P<0.05)。经过涂抹处理后,扶他林组和驼乳脂组各脏器指数低于模型组,且扶他林组脏器指数更接近空白组。

图4 驼乳脂对大鼠免疫器官指数的影响Fig.4 Effect of camel milk fat on immune organ index in rats
2.7 驼乳脂对大鼠化膜组织病理学变化的影响
HE 染色结果显示,正常组大鼠关节面光滑无破坏,滑膜组织结构完成,细胞排列整齐,未见炎性细胞浸润及血管增生,未见异常(图5a);模型组大鼠滑膜组织表现出许多与RA 相似的典型病理特征,如:细胞增生,纤维组织增生,炎症细胞浸润等(图5b);扶他林和驼乳脂可以不同程度地缓解CIA 大鼠的这些变化(图5c 和图5d);其中驼乳脂对CIA 大鼠滑膜组织有着较好的效果。

图5 大鼠滑膜组织切片(200×)Fig.5 Rat synovial tissue section (200×)
2.8 驼乳脂对大鼠血清中炎症因子水平的影响
与空白组比较,模型组大鼠血清中抗炎因子IL-10 的含量显著降低(P<0.05),炎症因子IL-1β 和IL-6 的含量显著升高(P<0.05)。经30 d 涂抹处理后,与模型组比较,扶他林和驼乳脂组均能显著提高抗炎因子IL-10 的含量(P<0.05),降低炎症因子IL-1β 和IL-6 的含量(P<0.05)(图6)。模型组大鼠血清中的TNF-α 含量较空白组高,但各组之间无显著差异,无统计学意义。

图6 大鼠血清中炎性因子的含量Fig.6 Content of inflammatory factors in rat serum
2.9 驼乳脂对大鼠滑膜组织中炎症因子水平的影响
由图7可知,各组间IL-1β 基因表达量都有显著性差异,模型组的相对表达量显著高于其它组(P<0.05);模型组大鼠滑膜组织中TNF-α 基因的相对表达量稍高,但各组间并没有统计学意义,导致这一结果的原因可能是建模并没有影响这一基因的变化。模型组大鼠滑膜组织中IκB、IKK 和RIP1 基因的表达量均高于其它组,其中扶他林组的表达量要显著低于驼乳脂组(P<0.05),说明扶他林的作用效果高于驼乳脂。

图7 大鼠滑膜组织中基因表达Fig.7 Gene expression in rat synovial tissue
3 讨论
RA 是一种表现为慢性、侵蚀性关节炎为主要特点的自身免疫性疾病,若不及时的干预治疗可引起关节畸形或强直,进而可引起机体关节功能丧失导致残疾[22-23]。近些年来,RA 的发病率逐年上升,且其存在治疗后反复发作、致残率高等特点[23-25]。RA 的主要治疗手段包括糖皮质激素,生物疗法和抗风湿药物(DMARDs)[26]。然而,长期服用这些药物会产生不良作用且治疗成本过高,因此急需研究副作用少的RA 治疗剂。
大量研究表明,促炎因子TNF-α,IL-1β 和IL-6 在RA 发展过程中起关键作用[27-30]。IL-1β 是最强的骨吸收剂,能够调节免疫细胞,还可以使滑膜细胞合成和释放前列腺素E2(PGE2),造成关节损伤[30-31]。TNF-α 主要由纤维滑膜细胞和单核巨噬细胞产生,可以促进滑膜细胞中PGE2 的释放,抑制骨保护素(OPG)的表达,导致滑膜增生和骨代谢异常[32]。IL-6 是一种多效促炎细胞因子,通过诱导新血管生成,炎性细胞浸润和滑膜增生来促进滑膜炎[33]。IL-1β 和TNF-α 能够诱导IL-6 的合成,促进IL-6 的分泌,提高滑膜细胞和成骨细胞中NF-κB 活化因子配体的释放,从而促进破骨细胞生成因子的表达[34]。IL-10 可作为抗炎信号,减弱激活的巨噬细胞和嗜中性粒细胞释放促炎细胞因子,但有研究发现,RA 患者体内IL-10 水平较低[35]。因此,抑制这些促炎因子的产生可以有效的控制炎症反应,缓解关节症状。
本研究选用CIA 模型,探究了驼乳脂对类风湿关节炎的保护作用。结果显示,经驼乳脂涂抹处理30 d 后,RA 大鼠采食量、足肿胀度、关节炎指数、体质量和关节骨表面均有明显的改善,该结果与郭强[36]和朱玉芳等[37]的研究结果一致。通过测定RA 大鼠血清中炎症因子发现,驼乳脂涂抹可以有效的提高抗炎因子IL-10 的含量,显著降低IL-6、IL-1β 的含量(P<0.05),该结果与朱阳春[38]的研究结果一致。驼乳中脂肪酸的组成随其来源而变化,例如我国双峰驼乳中饱和脂肪酸的含量为54.14%[39],沙特单峰驼乳中饱和脂肪酸的含量为65%[40]。众所周知,饮食中的饱和脂质会增强促炎性细胞因子的表达[41]。在驼乳饱和脂肪酸中棕榈酸含量最高,且棕榈酸已被确定为促炎性物质[42]。研究表明,驼乳对健康的有益之处归因于其油酸、共轭亚油酸、ω-3 脂肪酸,短链和中链脂肪酸以及其它生物活性化合物[43]。驼乳中短链脂肪酸的含量比牛、羊、绵羊和水牛少6~8 倍[44]。鉴于此,驼乳脂缓解炎症反应可能是饱和和不饱和脂肪酸的协同作用所致,该推测与Al-Nasseri 等[45]的研究结果一致。
RA 的发病机理中涉及NF-κB 通路的激活,该通路在RA 的炎症、痛觉过敏和组织损伤中起着重要作用[46]。在正常情况下,NF-κB 与IκB 形成复合物,以无活性的形式存在于细胞浆中。当受刺激后,IKK 激酶被激活,使IκB 发生磷酸化,随后被泛素化酶识别,导致IκB 被蛋白酶体降解,释放与IκB 结合的NF-κB 转录因子,使其移位到细胞核以调控下游炎症因子的转录与表达,诱发和加重炎症反应[47-49]。Arab 等[14]的研究发现,使用驼乳灌胃能够显著降低佐剂诱导关节炎大鼠软组织中的TNF-α,环氧合酶-2(COX-2),一氧化氮合酶(iNOS)及上游效应物NF-κB 的表达,并增强抗炎因子IL-10 的表达。Al-Nasseri 等[45]的研究表明,驼乳脂能够下调NF-κB 和核苷酸结合寡聚化结构域样受体3(NLRP3)等关键炎症因子的表达,增强IL-10,白介素-1 受体拮抗剂(IL-1Ra)和TET甲基胞嘧啶双加氧酶2(TET-2)等抗炎因子的表达以缓解糖化血清白蛋白(gBSA)诱导的巨噬细胞炎症。本研究发现,驼乳脂可显著降低RA 大鼠滑膜组织中炎症因子IL-1β、IκB、IKK 和RIP1 mRNA 的表达(P<0.05)。由此推测驼乳脂对滑膜组织的保护作用是通过抑制NF-κB 通路降低炎症因子表达而实现的。
4 结论
综上所述,驼乳脂可有效改善大鼠的活动量、采食量、肿胀程度,增加体质量等;也可降低外周血清IL-1β、IL-6 的含量,促进IL-10 含量上升,降低NF-κB 通路的表达来减轻炎症反应。尽管这些脂质介导其活性的确切机制尚待证实,但本研究提供的数据阐明了驼乳脂对关节炎和其它炎症性疾病有益的潜在机制。今后,需要进一步证实驼乳脂对NF-κB 信号通路及其相关基因功能的直接作用。
