LINC00339通过吸附miR-873-5p上调COMP的表达调控结肠癌细胞增殖、侵袭和凋亡
2021-09-09杜记涛万相斌
杜记涛,曹 建,赵 稳,万相斌,李 智
(郑州大学附属肿瘤医院普外科,河南 郑州 450003)
结肠癌(colon cancer,CC)是最常见和最具侵袭性的恶性肿瘤之一,占全世界癌症死亡率第二位[1]。环境和遗传因素被认为是影响CC发病的主要因素,从治疗效果来看,个体差异性比较明显[2]。
近年来越来越多的长链非编码RNA(long non coding RNA,LncRNA)被发现与恶性肿瘤的各种生物学行为密切相关[3]。LINC00339是一种新近发现的LncRNA,在许多恶性肿瘤中异常表达[4]。例如,研究发现LINC00339在胃癌组织中表达增加,促进胃癌细胞的增殖、迁移和侵袭[5]。但是LINC00339在CC中的作用机制尚未完全明确,这也是本研究重点关注的问题。
研究表明,在肿瘤组织中microRNAs(miRNAs)的表达与肿瘤的侵袭、转移、预后和耐药性等有关[6]。miRNAs在CC中的差异表达受到了广泛的关注。miR-873-5p已被证实在包括CC在内等多种肿瘤中异常表达[7-8]。过表达miR-873-5p可抑制CC细胞的增殖、集落形成和侵袭[9]。软骨寡聚基质蛋白(cartilage oligomeric matrix protein,COMP),是一种由多种细胞表达的可溶性五聚糖蛋白,以往有研究表明,COMP高表达能够促进CC细胞增殖、集落形成、抗凋亡能力和肿瘤生长[10]。
本研究借助靶向关系预测网站发现了miR-873-5p和LINC00339和COMP之间的靶向关系,并且设计了一系列实验探讨LINC00339/miR-873-5p/COMP轴在CC发生发展中的作用。希望为对CC的诊断和治疗提供新的依据。
1 材料与方法
1.1 材料与试剂CC细胞系(RKO、HCT-116、HCT-8、SW620)和人正常肠上皮细胞系HIEC细胞均购自美国ATCC细胞库;DMEM培养基(90113)、逆转录试剂盒(T2240)和细胞裂解液(R010)购自北京索莱宝生物科技有限公司;LipofectamineTM3000试剂盒(L3000015)、荧光原位杂交试剂盒(QVT0519)、CCK-8试剂盒(PA5-32348)和Annexin-V-FITC/PI试剂盒(V13242)购自Thermo Fisher Scientific;双荧光素酶报告基因检测试剂盒(ab228530)来自Abcam;RNA pull down试剂盒(Bes5102)购自广州伯信生物科技有限公司;胎牛血清(C0227)、TRIzol试剂盒(R0011)、TBST缓冲液(P0231)、多聚甲醛(P0099)、结晶紫染液(C1021)和ECL液(P0018FS)为碧云天产品。
1.2 仪器显微镜(CX43)为OLYMPUS产品;离心机购自德国Sigma公司;荧光定量PCR系统购自美国Roche公司;流式细胞仪(Attune Nxt)购自美国Thermo Fisher。
1.3 生物信息学预测在Gene Expression Omnibus(GEO)数据库以“colon cancer”为关键词检索CC相关的基因表达芯片,选择GSE136735进行后续分析。筛选差异基因并绘制差异基因表达热图,差异基因筛选条件为adj.P.Value<0.05和|LogFoldChange|>1。通过Targetscan(http://targetscan.org/vert_72/)、Starbase(http://starbase.sysu.edu.cn)和miRWALK(http://mirwalk.umm.uni-heidelberg.de)3个miRNA-mRNA关系在线预测工具对能调控差异基因的miRNA进行预测,并用Venny2.1分析比较。lncRNASNP2数据库(http://bioinfo.life.hust.edu.cn/lncRNASNP#!/)筛选与miRNA存在靶向关系的LncRNA。dbDEMC网站(http://picb.ac.cn/dbDEMC/index.html)预测miR-873-5p在结肠癌中的表达。LncRNA SNP2网站(http://bioinfo.life.hust.edu.cn/lncRNASNP#!/)预测LINC00339在CC中的表达。
1.4 研究对象从我院2018年6月至2020年6月期间的CC手术患者中采集43例CC组织及癌旁正常组织(距肿瘤边缘2-5 cm)。入组患者经病理诊断为CC,术前未接受任何放疗或化疗。患者均签署知情同意书,本研究得到本院伦理委员会的批准。
1.5 细胞培养RKO、HCT-116、HCT-8、SW620和HIEC细胞。细胞在含有10%FBS的RPMI 1640培养基中在37 ℃的含5% CO2的细胞培养箱中培养,取对数生长期的细胞用于实验,待细胞融合度达到60%-70%后弃上清液,进行后续转染,稳定转染24 h后进行相关实验。
1.6 细胞转染与分组用lipofectamine 3000试剂转染miR-873-5p模拟物、抑制剂或其阴性对照。针对LINC00339设计并合成si-RNA及其阴性对照。构建COMP的过表达载体pcDNA3.1-COMP。
分组如下:Blank组(空白对照组)、si-LINC00339组(细胞+ si-LINC00339)、si-NC组(细胞+ LINC00339阴性对照)、miR-NC组(细胞+miR-873-5p阴性对照)、miR-mimic组(细胞+miR-873-5p模拟物)、miR-inhibitor组(细胞+miR-873-5p抑制剂)、si-LINC00339+miR-NC组(细胞+si-LINC00339+miR-NC)、si-LINC00339+miR-inhibitor组(细胞+si-LINC00339+miR-inhibitor)、si-LINC00339+vector组(细胞+si-LINC00339+空白载体)和si-LINC00339+COMP组(细胞+si-LINC00339+pcDNA3.1-COMP)。
1.7 CCK-8细胞以每孔5×103个接种在96孔板中。分别在24、48和72 h添加100 μL CCK-8溶液。在450 nm处用微板阅读器测量吸光度。
1.8 Transwell法检测细胞的侵袭能力将细胞与20 μg基质凝胶在4 ℃条件下混合过夜。D2用无血清培养基按1 ∶3的比例稀释细胞,并加入Transwell室的上室(50 μL/孔)。小室保持平衡孵育30 min后分离细胞,用无血清培养基洗涤并计数,制备成细胞悬液,用无血清培养基冲洗一次,用无血清培养基接种3×108个/L的细胞悬液。将含10%胎牛血清的培养基加入下室,在37 ℃孵育24 h,用PBS洗涤Transwell室,每次5 min,用5%戊二醇固定,0.1%结晶紫染色30 min,PBS洗涤2次,显微镜下观察。通过基质凝胶的细胞数被用作评估细胞侵袭能力的指标,ImageJ软件对细胞侵袭数目进行定量。
1.9 流式细胞术取对数生长期的细胞,按1×106个/L以2 mL接种于6孔板内,800 r·min-1离心5 min,收集细胞沉淀,弃上清,用预冷PBS洗涤两次,加入预冷75%乙醇,于4 ℃固定4 h以上。吸取100 μL细胞悬液置于新管中,加入5 μL Annexin V-FITC和5 μL PI,轻轻混匀后在室温避光条件下孵育15 min。最后用流式细胞仪进行检测。
1.10 双荧光素酶报告实验将野生型(WT)或突变体(MUT)LINC00339结合miR-873-5p亚克隆到pGL3基本载体中。miR-873-5p与10 μg pLUC-LINC00339-WT或pLUC-LINC00339-MUT共转染到CC细胞。将野生型(WT)或突变型(MUT)COMP与miR-873-5p结合,亚克隆到pGL3碱基载体中。miR-873-5p与10 μg pLUC-COMP-WT或pLUC-COMP-MUT共转染48 h后,用双荧光素酶检测系统检测荧光素酶活性。
1.11 RNA pull-down应用RNA pulldown试剂盒进行RNA免疫沉淀分析。细胞用完全裂解缓冲液裂解。将细胞提取液与抗AGO2或抗IgG抗体偶联的磁珠孵育6 h,用RT-qPCR分析纯化RNA。
1.12 荧光原位杂交将CC细胞置于载玻片上用PBS清洗,用4%甲醛固定30 min。用70%乙醇渗透一晚后,用PBS冲洗两次。细胞在37 ℃下用LINC00339探针培养过夜。细胞用DAPI染色10 min,用柠檬酸盐钠洗涤,并用荧光显微镜拍摄。
1.13 qRT-PCR用TRIzol试剂提取组织和细胞中的总RNA,并逆转录合成cDNA,操作步骤均依据试剂盒说明书进行。qRT-PCR采用实时荧光定量PCR系统进行。用2-ΔΔCt法计算基因的相对表达水平。具体操作方法参照文献进行,以GAPDH作为LINC00339和COMP的内参。以U6作为miR-873-5p的内参,引物序列如下:
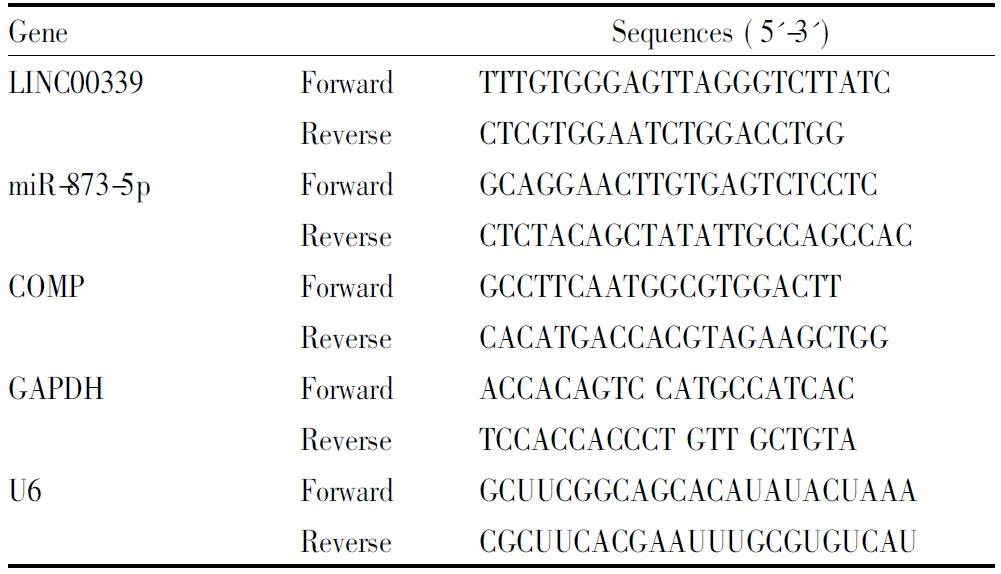
Tab 1 RT-PCR primer sequences
2 结果
2.1 生物信息学方法预测CC潜在分子作用机制根据adj.P.Value<0.05和|LogFoldChange|>1筛选差异基因,在GSE136735中找到差异表达基因,绘制了前10个差异基因表达热图(Fig 1A)。发现与癌旁组织相比,COMP在CC组织中呈高表达且差异显著。经查阅发现COMP在CC中已有研究,COMP在CC组织中呈高表达,可促进癌细胞的增殖和侵袭。为进一步探究COMP可能参与的分子作用机制,通过Targetscan、Starbase和miRWALK 3个miRNA-mRNA关系在线预测工具筛选能调控差异基因的miRNA,绘制Venn图发现交集miRNA为hsa-miR-2355-3p、hsa-miR-676-3p和hsa-miR-873-5p(Fig 1B)。其中在dbDEMC数据库查阅发现miR-873-5p在结肠腺癌(COAD)中低表达(Fig 1C),以往研究证实,过表达miR-873-5p可抑制结肠癌细胞的增殖、集落形成和侵袭,因此本研究推测miR-873-5p通过靶向COMP来参与CC细胞生物学行为的调控。

Fig 1 Differentially expressed genes and miRNAs screened from bioinformatics tools
2.2 miR-873-5p靶向结合COMP靶向关系在线预测网站显示COMP和miR-873-5p存在特异性结合位点(Fig 2A)。双荧光素酶报告实验表明,相对于miR-NC和COMP-WT共转染组,miR-873-5p mimic和COMP-WT共转染组荧光素酶活性被抑制(Fig 2B)。RNA pull-down进一步证实了二者间的相互作用关系(Fig 2C)。接下来采用qRT-PCR检测了miR-873-5p和COMP在CC组织和细胞中的相对表达水平,发现miR-873-5p在CC组织和细胞中表达降低,而COMP表达升高(Fig 2D-G)。二者在CC组织中的表达水平呈负相关(Fig 2H)。与对照组相比,miR-873-5p模拟物可降低COMP的表达水平,miR-873-5p抑制剂可提高COMP的表达水平(Fig 2I)。以上结果提示miR-873-5p能够特异性结合并下调COMP的表达。
2.3 LINC00339竞争性结合miR-873-5p且在CC中高表达为了进一步探究miR-873-5p和COMP在CC中的作用机制,通过RNA22在线预测网站筛选出了可能在上游调控miR-873-5p的LINC00339(Fig 3A)。lncRNASNP2数据库中显示LINC00339在CC组织中表达上调(Fig 3B)。荧光原位杂交实验结果显示LINC00339在细胞质和细胞核中均有表达(Fig 3C)。双荧光素酶报告实验结果显示相对于miR-NC和LINC00339-WT共转染组,miR-mimic和LINC00339-WT共转染组荧光素酶活性显著降低(P<0.05)(Fig 3D)。此外,使用生物素化miR-185-5p(bio-miR-185-5p)探针的LINC00339表达水平高于bio-miR-NC探针(Fig 3E)。如Fig 3F-I所示,LINC00339在CC组织和细胞系中较癌旁组织和正常细胞表达升高(均P<0.05)。与miR-873-5p表达呈负相关(r=-0.317 3,P=0.038 1),与COMP表达正常相关(r=0.352 9,P=0.020 3)。以上结果表明,LINC00339与 miR-873-5p存在靶向关系并且在CC中表达上调。

Fig 2 Validation of miR-873-5p with a targeted relationship with COMP

Fig 3 Validation of LINC00339 with a targeted relationship with miR-873-5p
2.4 敲低LINC00339抑制CC细胞增殖和侵袭,促进细胞凋亡选取LINC00339表达最显著的RKO细胞进行后续分析。首先通过qRT-PCR检测LINC00339的敲低效率,如Fig 4A所示,si-LINC00339组LINC00339的表达水平较si-NC组显著降低,说明LINC00339敲低成功。如Fig 4B所示,与si-NC组相比,si-LINC00339组的细胞活力明显降低(P<0.01)。如Fig 4C,D所示,Transwell结果显示,与si-NC组相比,si-LINC00339组的细胞侵袭能力明显减弱(P<0.01)。流式细胞术分析显示,敲低LINC00339诱导的细胞凋亡率上升(P<0.01)(Fig 4E,F)。以上结果表明下调LINC00339在CC细胞中的表达可对CC细胞的恶性生物学行为起抑制作用。
2.5 miR-873-5p下调可部分逆转敲低LINC00339对CC的影响首先检测了各组细胞中miR-873-5p的表达水平,结果显示,相对于si-NC组,敲低LINC00339的表达能够上调miR-873-5p的表达(Tab 2)。如Tab 2、3所示,与si-NC组相比,si-LINC00339组的细胞活力和细胞侵袭能力均显著降低,细胞凋亡率明显升高(均P<0.01)。转染miR-873-5p抑制剂组可部分逆转si-LINC00339对细胞活力、侵袭和凋亡的影响。结果表明,LINC00339通过调节miR-873-5p的表达对CC细胞的生物学进行调节。
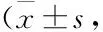
Tab 2 Expression of miR-873-5p and effect of si-LINC00339 or miR-inhibitor on invasion and apoptosis of CC cells n=3)
2.6 COMP上调可部分恢复LINC00339下调对CC细胞增殖、侵袭和凋亡的作用首先检测了各组细胞中COMP的表达水平,结果显示敲低LINC00339后,COMP的表达被抑制(P<0.01)(Tab 4)。如Fig 4,Tab 5所示,与si-NC组相比,si-LINC00339组的细胞活力和细胞侵袭能力均降低,细胞凋亡率明显升高(均P<0.05)。转染COMP过表达组可部分逆转si-LINC00339对细胞活力、侵袭和凋亡的影响。结果表明,LINC00339通过上调COMP的表达促进CC的恶性进展。
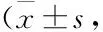
Tab 3 Effect of si-LINC00339 or miR-inhibitor on proliferative activity in each group at different time points n=3)
Tab 4 Expression of COMP and effect of si-LINC00339 or COMP overexpression on invasion and apoptosis of CC cells n=3)
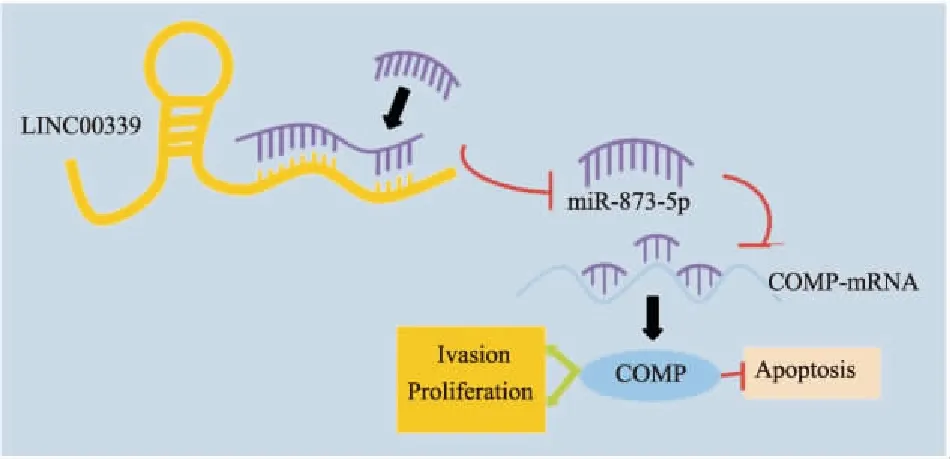
Fig 5 LINC00339/miR-873-5p/COMP axis regulates proliferation, invasion and apoptosis of CC cells
Tab 5 Effect of si-LINC00339 or COMP overexpression on proliferative activity in each group at different time points n=3)
3 讨论
CC作为常见的消化道肿瘤,目前尚没有完全行之有效的治疗方法,因此,明确其发病机制以及从分子生物学角度探究治疗CC的有效靶点十分重要。
有研究报道LINC00339在许多癌症中异常表达。例如,LINC00339的表达水平在卵巢癌中升高[11],通过调节miR-148a-3p/ROCK1轴促进卵巢癌细胞的增殖、迁移和侵袭。LINC00339通过抑制miR-377-3p而上调DCP1A的表达,从而促进胃癌的进展[12]。本研究发现LINC00339在CC组织和细胞中表达升高,敲低LINC00339能够抑制CC细胞的增殖和侵袭能力,诱导细胞凋亡。这表明LINC00339在CC进展中可能充当促癌因子。
LncRNA通过调节miRNA来调控蛋白质翻译,本研究选定miR-873-5p作为研究对象。miR-873-5p是一种具有抑癌作用的miRNA,在宫颈癌[13]、胃癌[14]和胶质瘤[15]等多种肿瘤的进展中均被报道作为抑癌因子发挥作用。且已有研究证明,miR-873-5p在结直肠癌中表达下调,能够抑制癌细胞的增殖和转移[16];此外,miR-873-5p在CC中的作用也得到了初步明确,miR-873-5p过表达能够抑制CC细胞增殖、侵袭和转移,促进细胞凋亡[9]。与以往研究一致,我们在CC组织中检测得到miR-873-5p表达下调。并通过生物信息学网站预测和双荧光素酶报告实验及RNA pull-down实验确定了miR-873-5p和LINC00339的相互作用关系。miR-873-5p与LINC00339在CC中表达呈负相关,LINC00339能够负调控miR-873-5p在CC组织中的表达水平。si-LINC00339与miR185-5p抑制剂共转染可逆转si-LINC00339对细胞增殖、侵袭和凋亡的影响。这些结果提示LINC00339可能通过调节miR-873-5p促进CC的生长。
COMP是一种细胞外基质蛋白,属于血栓反应蛋白家族,COMP的活性与CC的发病机制密切相关,已有研究发现COMP在CC中显著上调,且能促进CC细胞的侵袭[17]。在本研究发现,COMP在CC组织中表达升高,这与以往研究一致。此外,COMP作为miR-873-5p的靶基因能够被miR-873-5p抑制剂上调表达水平,被miR-873-5p模拟物和si-LINC00339下调表达水平,提示LINC00339能够通过抑制miR-873-5p调控COMP水平。COMP过表达能够部分挽救si-LINC00339对CC细胞增殖、侵袭和凋亡的影响。这些数据表明LINC00339通过竞争性结合miR-873-5p上调COMP的表达进而促进CC的发生发展。
综上所述,我们的研究初步解释了LINC00339在CC细胞生物学行为中的调控作用,并且证实了其通过对miR-873-5p/COMP轴进行调控进而影响CC细胞的增殖、侵袭、凋亡(Fig 5),但本研究也存在一定缺陷,如缺乏动物实验佐证等。因此,有必要进行进一步的实验,为今后的研究提供更为深刻的证据。
