PDK1基因shRNA慢病毒载体构建及干扰效应鉴定
2021-09-08农德勇林俊浩黄桂海李锡明
郝 南,农德勇,李 钻,林俊浩,黄桂海,李锡明,李 伟
肿瘤是一种全球范围内威胁人类健康的疾病。一项发表在Lancet杂志上的研究报告指出,恶性肿瘤是中国城乡居民第三大死亡原因[1]。肿瘤增殖失控、侵袭和远处转移等恶性生物学行为是导致患者预后不良的主要原因[2]。3-磷脂酰肌醇依赖的蛋白激酶-1(3-phosphoinositide dependent protein kinase-1,PDK1)是环磷腺苷(cyclic adenosine monophosphate,cAMP)和环磷鸟苷(cyclic guanosine monophosphate,cGMP)依赖的激酶和蛋白激酶c家族的重要成员,其可通过调控细胞增殖、凋亡、分化、成熟等参与胃癌、乳腺癌及卵巢癌的发生、浸润、转移和复发的过程[3-5]。本课题组的前期研究[6]发现,沉默PDK1可抑制前列腺癌细胞的增殖、侵袭和转移,提示PDK1可能是前列腺癌治疗的新靶标。鉴此,本研究旨在构建PDK1基因的短发夹RNA(short hairpin RNA,shRNA)慢病毒载体并鉴定其干扰效应。
1 材料与方法
1.1主要实验材料 本研究实验所用主要材料见表1。

表1 实验主要材料
1.2PDK1-shRNA干扰序列的设计与合成 在GenBank数据库(https://www.ncbi.nlm.nih.gov/genbank/)中检索PDK1基因序列,根据shRNA引物序列设计原则,设计并合成PDK1-shRNA序列。见表2。

表2 PDK1、PDK1-shRNA、转录产物和重组质粒序列
1.3LV3-PDK1-shRNA载体构建
1.3.1 载体酶切和去磷酸化 应用限制性内切酶BamH I和EcoR I剪切载体质粒LV3,加入50 μl虾碱性磷酸酶(shrimp alkaline phosphatase,SAP)体系去磷酸化,切胶回收目的载体。
1.3.2 shRNA序列退火 将合成的shRNA序列用pH=8.0的TE缓冲液(Tris-EDTA buffer solution)溶解,浓度为100 μM。取相应的正义链和反义链寡核苷酸(oligo)序列溶液进行退火反应。退火后,将模板溶液稀释50倍,终浓度为200 nM,用于后续的连接反应。
1.3.3 连接反应 将载体LV3线性化的酶切产物与shRNA序列进行定向连接。
1.3.4 连接产物转化感受态细胞 使用制备感受态细胞试剂盒将293T细胞制备成感受态细胞并保存于-80 ℃备用。实验时,将装有感受态细胞的离心管置于冰上解冻,加入10 μl连接产物,复苏感受态细胞,加入100 μl细胞悬液均匀涂布于含50 μg/ml氨苄青霉素的LB平板,培养16 h。从平板上挑取克隆菌落,小抽质粒,将抽提好的质粒进行EcoR I单酶切鉴定,1 h后通过电泳鉴定阳性克隆,将阳性克隆菌群置于装有5 ml LB培养基(含50 μg/ml氨苄青霉素)的试管中培养16 h,取200 μl阳性克隆对应的菌液送测序,测序由南宁维尔凯生物科技有限公司进行。将测序结果与目的基因序列进行比对,结果符合后将甘油中保存菌种进行扩增培养,进行大量质粒抽提以获得足够量的重组质粒。
1.4LV3-PDK1基因干扰慢病毒的包装和纯化 本研究采用第3代四质粒慢病毒包装系统。将293T细胞接种于10 cm细胞培养皿(每个平皿接种细胞数约为2.0×106~2.5×106),当细胞密度达60%~70%时进行质粒转染。将慢病毒包装质粒和磷酸钙混合,加入培养皿中。培养6~8 h后弃去培养液,加入含10%胎牛血清的DMEM培养液,继续培养48 h。收集含有病毒颗粒的培养液,离心,过滤沉淀。以25 000 r/min超速离心2 h获得病毒沉淀。随后使用预冷的DMEM重悬病毒沉淀。参考相关研究[7],采用氯化铯(CsCl)密度梯度离心法进行纯化,保存于-80 ℃。
1.5慢病毒滴度测定 解冻病毒原液,将病毒原液按10倍稀释三个梯度,使用逐孔稀释滴度测定法对慢病毒滴度进行测定。通过荧光显微镜计数荧光细胞。参考相关研究[8]采用如下公式进行计算:病毒滴度(TU/ml)=(转导细胞数×荧光百分数×稀释因子)/(转导体积(ml),结合稀释倍数计算病毒滴度。
1.6慢病毒感染PC-3细胞 (1)第1天,准备细胞。取对数生长期PC-3细胞接种于24孔培养板中,每个孔内接种5×104个细胞,铺板时细胞的融合率为50%左右,每孔RPMI 1640培养基体积为100 μl。进行病毒感染时细胞的融合度约达70%。(2)第2天,感染细胞。取出4 ℃保存的慢病毒液,使用台式离心机离心20 s。从培养箱中取出生长状态良好的PC-3细胞,将LV3-PDK1基因干扰慢病毒以5×感染复数(multiplicity of infection,MOI)感染PC-3细胞,加入浓度为8 μg/ml的凝聚胺(polybrene)以提高病毒的感染效率,混匀后放于细胞培养箱(37 ℃,5% CO2)孵育过夜。(3)第3天,更换培养液。将含有慢病毒的培养液更换为普通完全培养液。观察感染后细胞生长状态良好,之后每8~12 h更换培养液继续培养至第6天。(4)第6天,感染效率检测。在倒置荧光显微镜下观察细胞荧光,估计慢病毒感染目的细胞的效率。参考相关研究[9]报道的方法筛选、收集稳定感染细胞,保存于-80 ℃用于后续实验。
1.7real-time RT-PCR法检测慢病毒感染细胞PDK1-mRNA表达水平 采用TRIzol法提取细胞总RNA并检测纯度。逆转录反应体系:RNA 400 ng、5×PrimeScriptTMBuffer 2 μl,以RNase-Free的焦碳酸二乙酯(diethylpyrocarbonate,DEPC)-H2O补足体积至10 μl。实验采用的逆转录条件为37 ℃ 15 min,85 ℃ 5 s,4 ℃ 10 min。实验所用real-time RT-PCR反应体系为2×Premix ExTaqTM12.5 μl,10 μmol/L PCR上游引物(序列:5′-TGAACTCACCTTCCCACAT-3′)1 μl,10 μmol/L,PCR下游引物(序列:5′-TGAAGCAGCACTGAACACC-3′)1 μl,cDNA 2 μl,以ddH2O补足体积至25 μl。real-time RT-PCR反应条件为94 ℃预变性1 min,94 ℃ 30 s、55 ℃ 30 s、72 ℃ 45 s,共35次循环,反应结束后再72 ℃延伸10 min。以β-肌动蛋白(β-actin)作为内参,通过2-△△Ct法分析mRNA的表达水平。
1.8统计学方法 应用SPSS16.0统计软件进行数据分析。采用单因素方差分析比较各处理组间PDK1 mRNA表达水平的差异,以LSD-t检验法进行组间两两比较。P<0.05为差异有统计学意义。
2 结果
2.1LV3-PDK1-shRNAs质粒鉴定结果 连接产物转化后,挑选6个菌落进行菌落PCR,凝胶电泳后在目的条带大小的对应区域有酶切得到的条带。提取阳性克隆质粒进行DNA测序,结果显示目的序列与预期序列一致,证实载体构建成功。测序结果见图1。
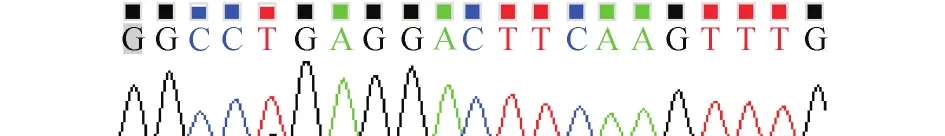
图1 重组质粒目标序列测序结果图
2.2LV3-PDK1-shRNA慢病毒滴度检测结果 经检测,LV3-PDK1-shRNA慢病毒滴度为1×108TU/ml。见图2。
ⓐ原液;ⓑ稀释10倍;ⓒ稀释100倍;ⓓ稀释1 000倍图2 LV3-PDK1-shRNA慢病毒感染293T细胞72 h荧光显微镜观察所见(20×)
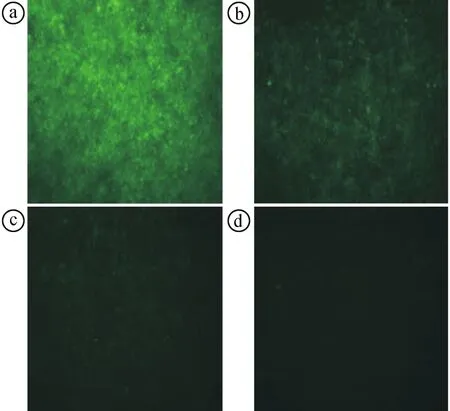
2.3慢病毒稳定感染PC-3细胞 以MOI值为5的慢病毒感染PC-3细胞,在倒置荧光显微镜下观察细胞荧光。LV3-NC、LV3-PDK1-shRNA慢病毒感染PC-3细胞的效率均超过85%。见图3。

ⓐLV3-NC慢病毒液感染细胞(未显示荧光);ⓑLV3-NC慢病毒液感染细胞(显示荧光);ⓒLV3-PDK1-shRNA慢病毒液感染细胞(未显示荧光);ⓓLV3-PDK1-shRNA慢病毒液感染细胞(显示荧光)图3 LV3-NC、LV3-PDK1-shRNA慢病毒感染PC-3细胞荧光显微镜观察所见
2.4LV3-PDK1-shRNA慢病毒感染PC-3细胞对PDK1 mRNA表达的抑制作用 real-time RT-PCR结果显示,与空白对照组比较,LV3-NC慢病毒感染PC-3细胞对PDK1 mRNA表达影响不显著(P>0.05)。LV3-PDK1-shRNA慢病毒感染PC-3细胞可显著抑制PC-3细胞PDK1 mRNA的表达,其表达水平低于空白对照组和LV3-NC慢病毒感染组,差异有统计学意义(P<0.05)。见图4。
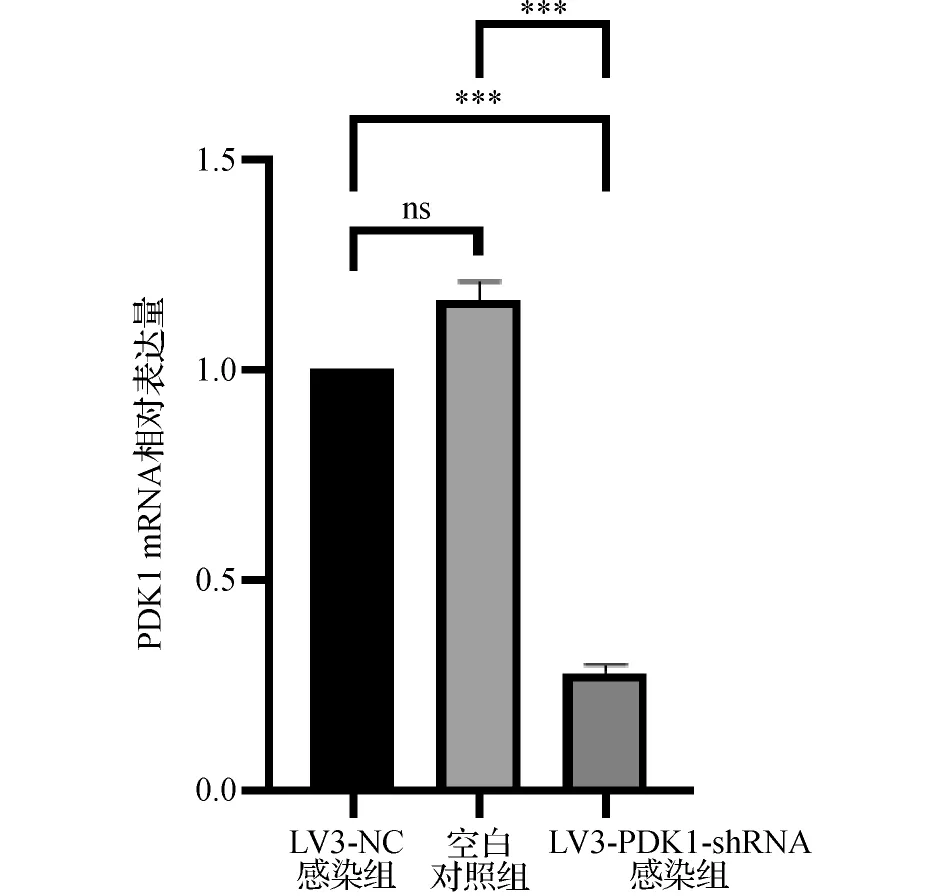
图4 不同处理组PC-3细胞PDK1-mRNA相对表达水平比较图
3 讨论
3.1RNA干扰(RNA interference,RNAi)是哺乳动物细胞中一种进化保守且高度特异的基因沉默现象。随着生物学技术的发展,通过特定方式将shRNA或小干扰RNA(small interfering RNA,siRNA)转染哺乳动物细胞并沉默靶基因已成为肿瘤等疾病领域常用的科学研究手段,也是一种有前景的临床治疗手段[10-12]。慢病毒载体是一类由人类免疫缺陷病毒1(human immunodeficiency virus type 1,HIV-1)改造的病毒载体,具有低免疫原性、可携带拷贝数较大的目标基因、可感染静止或非静止细胞并稳定表达外源基因等特性[13-15]。本研究采用慢病毒载体介导的RNAi技术稳定沉默PC-3细胞PDK1基因。
3.2PDK1是一种由556个氨基酸组成的蛋白丝氨酸/苏氨酸激酶,具有N端蛋白激酶A、蛋白激酶G、蛋白激酶C(AGC)结构域和C端普列克底物蛋白同源(pleckstrin homology,PH)结构域。其中N端的AGC结构域可细分为较长的PDK1互作片段(PDK1-interacting fragment,PIF)口袋结构域和较短的活化环结构域。PDK1在真核细胞进化中高度保守,并被发现广泛存在于哺乳动物、果蝇、线虫和部分植物细胞内[16]自1997年Batty首次发现PDK1以来,越来越多的证据表明PDK1通过3,4,5-三磷酸磷脂酰肌醇(phosphatidylinositol-3,4,5-trisphosphate,PIP3)依赖途径改变AGC家族蛋白激酶B(protein kinase B,Akt)等蛋白构象并使其活化,参与调控细胞的增殖、分化、凋亡以及迁移,发挥调控胚胎发育、免疫应答和肿瘤发生与转移等多种生物学功能[17-20]。细胞迁移是胚胎发育、肿瘤进展和血管生成的共同病理生理基础。近年来,不少研究发现PDK1在多种实体肿瘤的发生、侵袭和转移中发挥关键作用。苯并吡干预肺上皮细胞可下调PTEN基因表达水平,激活PDK1/磷脂酰肌醇3激酶(phosphatidylinositol-3 kinose,PI3K)通路,增强Akt活化程度,使细胞发生恶性转化[21]。黑色素瘤组织高表达PDK1,敲除小鼠PTEN基因可显著降低PDK1水平,黑色素瘤侵袭和转移能力被显著抑制;经PDK1抑制剂(PDK1 inhibitor,PDK1i)干预的野生型小鼠黑色素瘤组织显著缩小,证实PDK1在黑色素瘤发生和发展中发挥关键作用[22]。
3.3前列腺癌是西方国家男性最常见的恶性肿瘤,而我国男性的前列腺癌发病率和死亡率也呈逐年增加的趋势[23]。细胞糖代谢异常在前列腺癌发生及进展中发挥重要作用[24]。本课题组的前期研究[6]发现,CD44过表达提高了LNCaP细胞、PC-3细胞PDK1的表达水平;而拮抗CD44可显著降低PC-3细胞的葡萄糖代谢水平和氧化应激水平,并增加PC-3细胞对多西紫杉醇的敏感性。这提示PDK1可能在前列腺癌细胞的能量代谢途径中发挥重要作用,但是这种生物学机制仍未被完全阐明。
3.4为进一步研究PDK1在前列腺癌发生发展中的作用及其与CD44相关通路分子表达水平的调控关系,本研究设计合成了PDK1干扰序列并连接到LV3载体,并获得滴度为1×108TU/ml的PDK1 shRNA慢病毒载体,较以往研究具有更高的病毒活性[25-26],这可能与本研究中用于慢病毒包装的293T细胞传代数、冻存和复苏次数较少,以及使用了毒性较低的钙磷转染法等有关。进一步的研究结果显示,本研究所构建PDK1 shRNA慢病毒载体在体外可高效转染PC-3细胞,经过为期72 h的持续观察,转染后的PC-3细胞生长、增殖良好,胞质丰富,可见高亮绿色荧光。real-time RT-PCR结果显示,LV3-shPDK1慢病毒载体干扰效率较高。
综上所述,本研究成功构建PDK1基因RNAi慢病毒载体,获得稳定沉默PDK1基因的PC-3人前列腺癌细胞株,为深入研究PDK1在前列腺癌防治中的作用及进一步阐明其具体的分子生物学机制奠定了基础。
