白首乌C-21甾体总苷通过TGF-β1/Smad信号通路干预人肝星状细胞活化的机制
2021-09-08丁永芳彭蕴茹
张 婷,丁永芳,彭蕴茹
(1.南京中医药大学附属中西医结合医院,2.江苏省中医药研究院,江苏 南京 210028)
肝脏纤维化是指肝细胞出现坏死及炎症刺激后,肝脏内大量纤维结缔组织异常增生,胶原合成与降解异常的病理过程。肝纤维化是发展到肝硬化的必经阶段,因此,有效阻断肝纤维化的发生发展,对防治肝硬化及肝癌具有重要意义。肝纤维化是肝内多种细胞及多个因素共同作用的结果,而肝星状细胞(hepatic stellate cell, HSC)在其中发挥了关键性作用。持续的损伤刺激肝脏内免疫细胞释放炎症因子,HSC由静止转化为活化状态,最终具有肌成纤维样细胞表型[1]。HSC是肝脏内主要的细胞外基质(extracellular matrix,ECM)生成细胞,活化的HSC主要特征为强增殖力,表型改变,ECM异常累积[2]。持续不断的ECM沉积导致肝脏脏器损伤,失去基本生理功能。转化生长因子-β(transforming growth factor,TGF-β1)是目前研究较多的一种促纤维化细胞因子,参与肝病各个阶段并发挥重要作用[3]。而脂多糖(lipopolyscaccharide,LPS)是一种细胞毒素,可以释放炎性细胞因子,对HSC也有一定的激活作用,可参与肝脏损伤-炎症-纤维化的过程[4]。有研究[5]显示,TGF-β1与LPS可以分别激活LX-2细胞建立体外纤维化模型,促进纤维化的进程,但其协同作用的具体机制尚不清楚。
活化的HSC大量表达TGF-β1,Smad是TGF-β1下游靶点,主要是通过调节TGF-β1/Smad信号通路推动纤维化进程[6-7]。Smad家族中Smad2,Smad3活化后主要分布在细胞核内,持续活化HSC,增加合成ECM蛋白的表达,自分泌大量TGF-β1持续激活HCS,加速肝纤维化进展。因此,研究TGF-β1/Smad信号通路对于阐释药物抗肝纤维化作用机制有重要意义。
白首乌是传统补益类中药,C-21甾体是从白首乌中发现的数量最多、也是最主要的活性成分。本课题组前期研究[8-9]表明,白首乌C-21甾苷(TCSG)具有显著的抗肝纤维化作用。但迄今为止,白首乌C21甾苷对肝星状细胞活化的影响及作用机制尚未深入研究。本研究拟采用TGF-β1联合LPS诱导人肝星状细胞LX-2的活化从而模拟体外肝纤维化发病过程,并在此基础上研究TCSG对LX-2活化的影响,以及通过TGF-β1/Smad信号通路阐明TCSG发挥抗肝纤维化的内在分子机制。
1 材料与方法
1.1 材料
1.1.1试剂,仪器及细胞 白首乌C-21甾体总苷(TCSG)提取物由本院中药资源研究室钱仕辉教授课题组提取并经比色法测定C-21甾体总苷的质量分数为52.89%。脂多糖(Sigma,Lot:L2880-100MG);TGF-β1(PEPRO TECH,Lot:1218209);Alexa FluorTM488 donkey anti-rabbit IgG(H+L)(Invitrogen,Lot:2045215);BCA蛋白浓度测定增强型试剂盒(碧云天,Lot:091919200430);GAPDH、α-SMA、NF-κB、IκB-α、p-Smad3(Cell Signaling,批号分别为:#2118、#19245、#8242、#2859、#9520);p-Smad2、Smad2、Smad3、TGF-β1(Abcam,批号分别是:ab53100、ab40854、ab40854、ab92486);二抗山羊抗兔IgG(Jackson Immuno Research,Lot:147832);羟脯氨酸试剂盒(碱)(南京建成生物工程研究所,A030-2-1);DMEM(HyClone,Lot:AE29423688);胎牛血清(Gibco,Lot:2166451)。Millicell EZ SLIDE(MILLIPORE);倒置荧光显微镜(LEICA,DMi8),酶标仪(Thermo,Multiskan FC),电泳仪器(Bio-Rad)。人肝星状细胞株(LX-2)购于中南大学。
1.2 实验方法
1.2.1LX-2细胞培养 LX-2在含1%双抗和10% FBS的DMEM高糖培养基中培养,置于37 ℃、5% CO2条件下培养,每2-3 d换液一次,在显微镜下观察直到细胞密度达到对数生长期后进行传代及冻存。
1.2.2MTT法检测细胞活力 取密度为8×106个·L-1的细胞悬液,100 μL/孔加入96孔培养板中,每组6个复孔。实验分为对照组和不同浓度(20、40、60、80、100 mg·L-1)TCSG药物组,除对照组外,其余每组加入相应浓度的TCSG,分别孵育24、48、72 h后,加入20 μL新鲜配制的MTT(5 g·L-1)溶液37 ℃孵育4 h,小心弃去上清液,每孔中加入200 μL的DMSO溶液,振摇10 min,保证蓝色甲瓒充分溶解于DMSO中,设定波长490 nm,采用全自动酶标仪,在相应的波长下读取并记录吸光度值。
1.2.3细胞免疫荧光染色法观测α-SMA表达情况 取密度为4×106个/L的细胞悬液,接种于Millicell EZ SLIDE (8-well glass)培养板中,300 μL/孔,培养24 h后进行分组和药物处置。实验设对照组,TGF-β1+LPS组,TGF-β1+LPS联合 不同浓度的TCSG药物干预(10、20、40 mg·L-1)组。TGF-β1+LPS组分别加入终浓度为10 μg·L-1的TGF-β1和10 mg·L-1的LPS,药物干预组在加入诱导剂TGF-β1和LPS同时,加入终浓度为10、20、40 mg·L-1的TCSG,对照组加入相应体积的DMEM。处理24 h后,PBS洗涤3次/5 min,4%多聚甲醛冰上固定20 min,PBS洗涤3次/5 min,0.5% Triton X-100冰上透化15 min,含3% BSA的PBS室温封闭45-60 min。一抗(抗α-SMA抗体1 ∶200)4 ℃孵育过夜。次日,室温孵育30 min,暗室荧光二抗(Alexa Fluor 488 donkey anti-rabbit IgG(H+L)1 ∶500)室温孵育1 h。核染料DAPI(5 mg·L-1)染细胞核,室温孵育5 min后用PBS缓冲液洗涤3次/5 min,每孔随机选择3个视野荧光显微镜下拍摄。
1.2.4羟脯氨酸含量检测 取细胞密度为8×106个/L细胞悬液,接种于12孔培养板中,每组3个复孔。24 h后药物处置方法同“1.2.3”,24 h后收集各孔培养液上清,按照羟脯氨酸碱水解法检测试剂盒说明书操作流程,检测细胞上清液中的羟脯氨酸含量变化情况。
1.2.5Western blot 实验分组同“1.2.4”。收集细胞加入细胞裂解液200 μL/孔,冰上裂解30 min。期间每10 min用移液器吹打至混悬状态。在4 ℃条件下,以12 000 r·min-1离心15 min,小心吸取上清液。100 ℃变性10 min,取等量蛋白质进行10%聚丙烯酰胺凝胶电泳,转膜后室温封闭1 h,弃掉牛奶,一抗4 ℃过夜。次日,回收一抗,室温孵二抗1 h,洗膜3次,ECL化学发光显影液显影。蛋白条带采用ImageJ软件检测灰度值,通过目标蛋白与内参蛋白(GAPDH)灰度值比较分析。
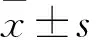
2 结果
2.1 TCSG对LX-2细胞增殖的影响MTT结果显示:与对照组相比较,不同浓度的TCSG(20、40、60、80、100 mg·L-1)处理LX-2细胞24 h,细胞增殖没有明显抑制作用;处理LX-2细胞48 h,与对照组比较,40、60、80、100 mg·L-1TCSG均对细胞增殖有显著抑制作用(P<0.05,P<0.01);处理细胞72 h,各个浓度TCSG(20、40、60、80、100 mg·L-1)均显著抑制细胞增殖(P<0.05,P<0.01)。实验结果表明一定浓度的TCSG作用于细胞48 h以上,可以抑制肝星状细胞LX-2的增殖,并且呈现剂量依赖性,所以后续实验选择10、20、40 mg·L-1TCSG作为抑制LX-2细胞活化的浓度,以避免药物产生毒性。
2.2 TCSG对活化的LX-2细胞α-SMA表达的影响免疫荧光染色结果如Fig 2所示,绿色荧光的深浅表示α-SMA蛋白在LX-2细胞内的表达水平,绿色越深,分布越密集,表明α-SMA蛋白表达水平越高,DAPI染胞核呈蓝色荧光。对照组呈现微弱的绿色荧光,分散稀疏,表示α-SMA的蛋白表达水平较低;TGF-β1联合LPS处理LX-2细胞24 h,绿色荧光强度明显增强,表示α-SMA蛋白表达水平较高;10、20、40 mg·L-1TCSG处理LX-2细胞24 h,绿色荧光强度明显减弱,表示α-SMA蛋白表达水平降低。说明TGF-β1联合LPS刺激提高了LX-2细胞中α-SMA蛋白表达,10、20、40 mg·L-1TCSG可以降低α-SMA在LX-2细胞内的表达水平。
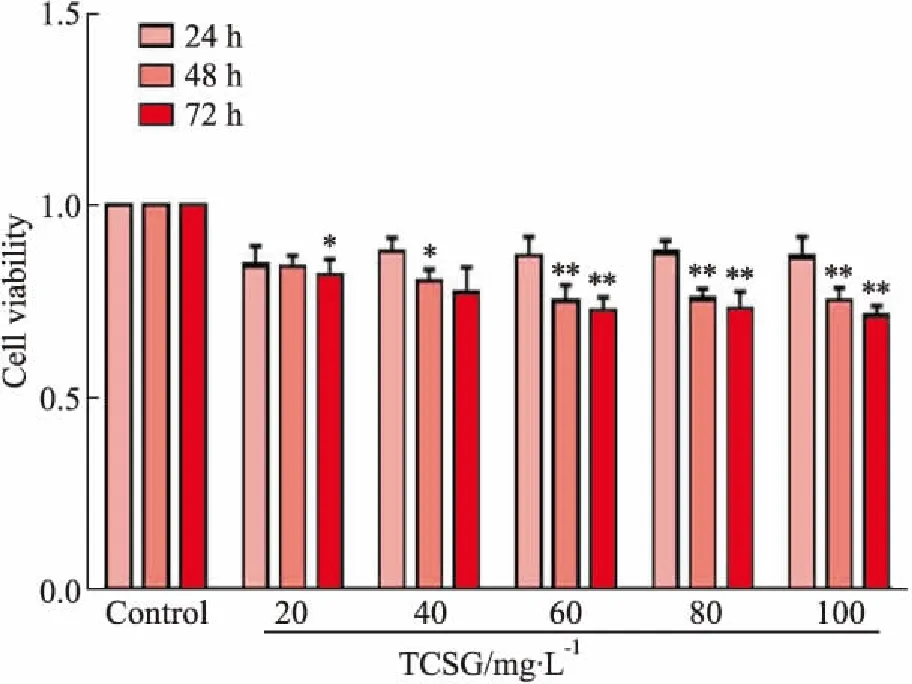
Fig 1 Effect of TCSG on cell
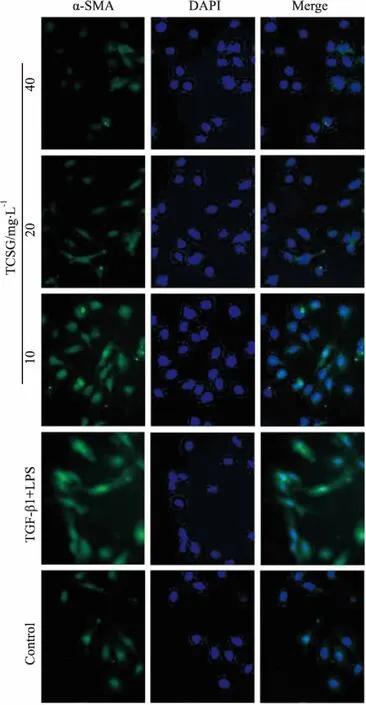
Fig 2 Expression of α-SMA in LX-2 cells observedby immunoflouresence(×400)
2.3 TCSG对活化的LX-2细胞HYP含量的影响如Fig 3所示,与对照组相比较,模型组中LX-2细胞上清液HYP含量升高(P<0.01)。与模型组相比较,TCSG药物组中LX-2细胞上清液HYP含量降低(P<0.05)。提示TCSG具有剂量依赖性降低LX-2细胞上清液HYP水平。
2.4 TCSG处理组对LX-2纤维化及炎症相关蛋白表达的影响与对照组相比,模型组LX-2细胞上TGF-β1、NF-κB、α-SMA、p-Smad2/Smad2、p-Smad3/Smad3蛋白相对表达量升高(P<0.05)。IκB-α蛋白相对表达明显降低。与模型组相比,TCSG药物组LX-2细胞上TGF-β1、NF-κB、α-SMA、p-Smad2/Smad2和p-Smad3/Smad3蛋白相对表达量明显降低,而IκB-α蛋白相对表达量升高(P<0.05)(Fig 4A,B)。提示TCSG可能通过调节TGF-β1/Smad信号通路抑制LX-2细胞活化发挥抗肝纤维化作用。
Fig 3 Effect of TCSG on hydroxyproline content
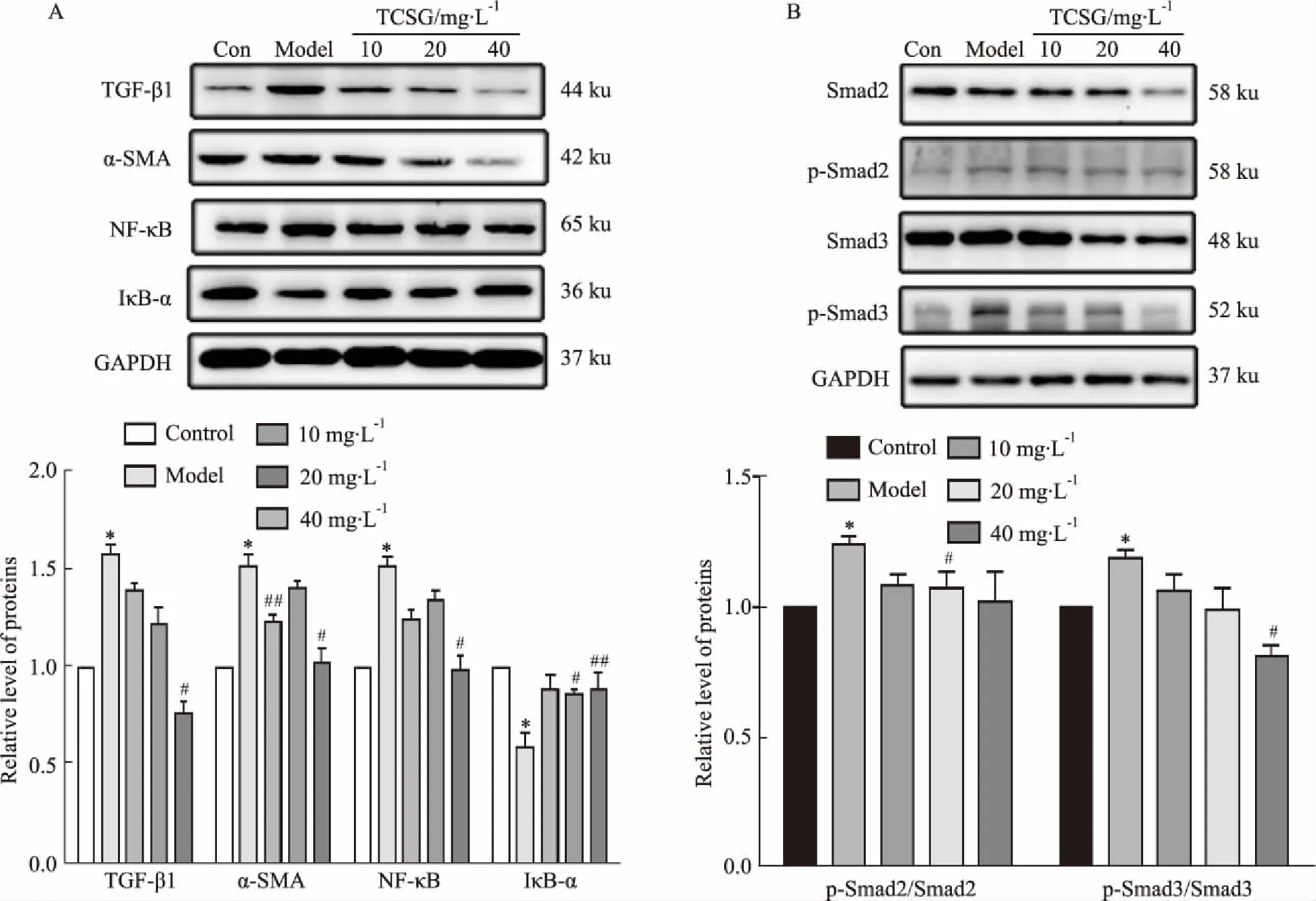
Fig 4 Effects of TCSG on protein expression of TGF-β1,α-SMA,NF-κB,IκB-α,p-Smad2/Smad2 and
3 讨论
肝星状细胞(HSC)活化,细胞外基质(ECM)异常沉积,最终导致肝纤维化。多项研究[10-11]表明,TGF-β1是目前研究最多的导致纤维化的细胞因子,在细胞外,胞质与胞核内均有表达。体内TGF-β1可以通过旁分泌及自分泌激活HSC细胞,大量产生α-SMA及胶原等,推动肝纤维化发展。有研究[12]表明,Smad信号通路是TGF-β1调控的主要细胞内信号通路。TGF-β1与细胞表面TGF-β受体结合,激活下游Smad家族中Smad2、Smad3,导致Smad2和Smad3磷酸化,增加纤维化标志物α-SMA,TGF-β1蛋白表达及胶原合成,活化HSC细胞[13-14]。有文献[15-16]表明,LPS通过刺激HSC细胞,引起炎症反应,大量分泌促炎性因子,激活HSC细胞。其中NF-κB是LPS诱导炎症发生过程中重要的转录因子,调节多种炎症因子的基因表达。其中IκB-α是存在于细胞质中的NF-κB抑制因子,通常情况下与NF-κB结合形成无活性的复合物,当对刺激做出反应时,IκB-α被IκB激酶磷酸化后转移并降解[17-18]。活化的NF-κB信号通路激活TGF-β1的表达,持续活化HSC,上调纤维化标志物α-SMA蛋白表达。
基于本课题组前期体内实验研究表明白 首乌C-21甾苷抗肝脏纤维化的工作基础,本实验以体外人肝星状细胞(LX-2)纤维化模型为研究对象,进一步研究TCSG调控NF-κB/TGF-β1/Smads信号通路抗肝纤维化的内在分子机制。TGF-β1联合LPS建立体外肝纤维化模型,免疫荧光结果显示纤维化标志物α-SMA蛋白表达升高,细胞上清液中羟脯氨酸含量增加,Western blot结果显示LX-2细胞中TGF-β1、NF-κB、p-Smad2/Smad2、p-Smad3/Smad3蛋白比值表达升高,IκB-α蛋白表达降低。TCSG干预后,免疫荧光结果显示纤维化标志物α-SMA表达明显降低,细胞上清液中羟脯氨酸含量降低,Western blot结果显示LX-2细胞中TGF-β1、NF-κB、Smad2、Smad3与其磷酸化蛋白比值表达降低,IκB-α蛋白表达升高。
综上所述,中药白首乌主要成分TCSG对TGF-β1及LPS共同诱导的体外肝纤维化模型具有明显的干预作用。可能是通过抑制Smad2与Smad3蛋白磷酸化水平,下调TGF-β1、α-SMA、NF-κB蛋白表达,抑制IκBα降解,调控NF-κB/TGF-β1/Smad信号通路,抑制人肝星状细胞活化起到抗纤维化作用。
