绿原酸通过抑制AMPA受体的突触表达缓解慢性炎性疼痛
2021-09-08李银霞刘燕妮张亦涵索占伟
李银霞,高 敏,白 雪,刘燕妮,张亦涵,索占伟
(兰州大学药学院分子药理研究所,甘肃 兰州 730000)
绿原酸( chorogenic acid,CGA)为金银花、杜仲等中药的重要有效成分,具有抗炎、抗氧化、抗微生物等多种生物活性[1-2]。同时,CGA广泛分布于咖啡豆、茶叶、水果以及蔬菜等膳食中,也是一种重要的人体机能调节物质。研究表明,CGA具有显著的镇痛作用,如减轻角叉菜胶诱发的炎性疼痛[3]、紫杉醇诱发的外周神经痛[4],以及神经损伤诱发的病理性疼痛[5]。研究表明,CGA的镇痛效应主要与间接减轻炎症级联反应有关[6],如通过p38、核因子κB (NF-κB) 信号通路抑制炎性介质及细胞因子的释放等[7]。然而,对于CGA减轻慢性病理性疼痛的确切机制尚未阐明。
慢性疼痛的形成机制十分复杂,涉及与痛觉敏感化相关联的神经及突触的可塑性改变,包括离子通道、胞内信号、支架蛋白等的重构与修饰。其中,位于脊髓背角以及高级中枢通路中的谷氨酸能突触传递的异常增强,被认为是慢性病理性疼痛的核心机制[8]。AMPA受体( alpha-amino-3-hyroxy-5-methyl-4-isoxazolepropionic acid receptors,AMPARs)是一种重要的离子型谷氨酸受体,介导快速兴奋性突触传递,在痛觉传递和可塑性中发挥着重要作用。在成年动物脊髓背角,绝大多数AMPARs是由GluA1和GluA2亚基组成的同源或异源四聚体[9]。其中,包含GluA2亚基的AMPARs,对钙离子的通透性极低,但缺乏GluA2亚基的、由GluA1组成的同源四聚体对钙离子具有高度的通透性[10]。外周炎症或神经损伤可特异性增加脊髓背角神经元中GluA1的突触含量,提高细胞兴奋性、增强突触传递[11-12]。因此,GluA1是参与慢性疼痛形成的重要分子。特异性抑制GluA1的活性或基因敲除GluA1,可显著减轻痛觉敏感化症状[13]。为探讨绿原酸对慢性疼痛可能的镇痛作用及其与AMPA受体的关系,本研究利用CFA诱发小鼠机械性痛觉超敏和热痛觉过敏为模型,考察CGA对慢性疼痛症状的影响,并利用免疫印迹法,探讨CGA对疼痛动物AMPA受体可能的调节作用。
1 材料与方法
1.1 材料
1.1.1实验动物 雄性昆明成年小鼠,体质量(20-22)g,由兰州大学实验动物中心提供,动物合格证号:SCXK(甘) 2005-0007。饲养于12 h明暗交替、(22-24)℃环境,自由饮水、进食。
1.1.2主要试剂 绿原酸(chorogenic acid,CGA,Sigma,批号WXBD1890V);完全弗氏佐剂( complete Freund’s adjuvant,CFA,Sigma,货号 F5881);抗兔GluA1-pS831抗体、抗兔GluA1-pS845抗体、抗鼠β-actin抗体( Sigma 公司,货号 AB5847、AB5849、A1978);抗兔GluA1抗体、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)、辣根过氧化物酶标记山羊抗兔IgG(H+L)、ECL发光试剂盒( Beyotime Biotech公司,货号 AF2473、A0216、A0208、P0018AM );抗兔GluA2抗体( Boster Biological Tech公司,货号 A02905)。
1.1.3仪器 Von Frey纤维(规格:2.36,2.44,2.83,3.22,3.61,3.84,4.08,4.17,Stoelting Wood Dale);PL-200型热测痛仪(成都泰盟科技有限公司);DYY-7C电泳仪(北京六一仪器厂);JA2003精密电子天平(上海良平仪器仪表有限公司);YLS-4C小鼠转棒仪(上海欣软信息技术有限公司)。
1.2 方法
1.2.1机械性缩足阈值( paw withdrawal threshold,PWT)测定 利用Up-Down法[14],采用盲法测定小鼠PWT。药物处理前,将小鼠置于测试笼中,使其适应环境1 h。测定时,将Von Frey纤维垂直作用于小鼠后足底皮肤表面,使其弯曲,并停留5 s。利用公式“50% PWT (g) = 10[Xf+Kδ]/10 000”进行计算,Xf 为最后一个有效值所对应纤维的克数,δ=0.22。为观察CGA对炎性小鼠PWT的影响,在连续测定2 d的基础值后,于后足底皮下注射CFA,1 d后,鞘内给予50、100、200 ng CGA。每隔15 min测定一次PWT,连续监测1 h.
1.2.2热缩足潜伏期(paw withdrawal latency,PWL)测定 将小鼠提前置入观察室中,使其适应环境1 h。测试前,调制刺激强度为0.30,断电时间为10 s。测试时,将光束对准小鼠后足底表面,以传递热刺激。当小鼠出现缩足时,仪器自动记录自加热开始至出现缩足所用的时间,即缩足潜伏期。间断性测定3次,计算平均值。每2次测量之间至少间隔2 min,以免连续热刺激造成误差。给药后的测定均采用盲法。为观察CGA对炎性小鼠PWL的影响,设立与上述PWT测定相同的给药方案和时间点,监测PWL的变化。
1.2.3运动机能测试 利用小鼠转棒仪测试小鼠的运动机能。将小鼠放在转棒上,运行仪器,记录小鼠坠落时的转速,即最大转速[15]。试验前,使小鼠适应转棒运动,每天至少练习3次,连续适应2 d。在测试时,连续记录3次的最大转速值,并计算平均值。为观察CGA是否对运动机能产生影响,在每隔15 min连续测定两次基础值后,鞘内给予200 ng CGA,再每隔15 min测定一次,连续测定1 h。
1.2.4疼痛模型的制备 连续检测2 d的PWT和PWL基础值后,将25 μL CFA悬液缓慢注入小鼠后足底皮下。1 d后,检测PWT和PWL。与基础值相比,PWT和PWL显著降低者,视为建模成功。
1.2.5鞘内给药 小鼠背部剃毛、消毒后,沿L5-L6椎骨间隙,将30 G针头的微量注射器针头垂直刺入蛛网膜下腔,以小鼠轻微摆尾作为给药成功的标志[15],缓慢推注5 μL药物。
1.2.6富含突触后致密质组分的提取 在参照本实验室先前建立的方法[16],提取脊髓背角富含突触后致密质( postsynaptic density,PSD)的组分,以检测蛋白的突触含量。将小鼠随机分为3组,第1组在双后足底皮下注射生理盐水,1 d后,鞘内注射生理盐水;第2、3组双后足底皮下均注射CFA,1 d后,第2组小鼠鞘内给予生理盐水,第3组小鼠鞘内给予100 ng CGA。在鞘内给药15 min后,腹腔注射戊巴比妥钠( 60-90 mg·kg-1)以深度麻醉小鼠,随后分离L4-L5节段脊髓,将其快速移入冰冷、充95% O2/5% CO2的人工脑脊髓液中。显微镜下剥膜后,剪取背角,在4 ℃裂解液( 10.0 mmol·L-1Tris-HCl,pH 7.6,320 mmol·L-1Sucrose,5.0 mmol·L-1EDTA,10 g·L-1PMSF,proteases/phosphatases inhibitors cocktail)中匀浆。经1 000×g离心10 min后,收集上清。上清经10 000×g离心15 min,收集沉淀。将含0.5% TritonX-100的裂解液再次加入至上述沉淀中,经轻微吹打后,4 ℃裂解30 min。32 000×g离心20 min后,得到富PSD的组分P3。在P3中加入SDS上样缓冲液,100 ℃煮5 min后,用于Western blot免疫印迹检测。
1.2.7免疫印迹 蛋白样品用8% SDS-PAGE凝胶经电泳分离后,转移到PVDF膜上。5%的脱脂牛奶封闭30 min后,PBST洗3次,每次10 min。加入一抗,4 ℃孵育过夜。次日,经PBST 3次洗涤后,加入相应二抗,室温孵育1 h。再经PBST 3次洗涤后,ECL显色、拍片。所使用的抗体浓度为:GluA1-pS831(1 ∶1 000);GluA1-pS845(1 ∶500);β-actin(1 ∶600);GluA1(1 ∶400);GluA2(1 ∶1 000)。
1.2.8磷酸化检测 采用“1.2.6”中的分组方法处理动物并分离脊髓背角。利用RIPA裂解液将分离出的脊髓背角进行全细胞匀浆,在4 ℃摇床裂解40 min后,14 000×g离心10 min,收集上清,加入SDS上样缓冲液。经SDS-PAGE、转膜后,加入相应的GluA1的磷酸化特异性抗体,进行免疫印迹,得到磷酸化印迹条带。再将PVDF膜进行Strip,重新加入GluA1抗体后,免疫印迹得到总蛋白条带。
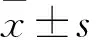
2 结果
2.1 CGA对机械性痛觉超敏的影响行为学结果显示( Fig 1),正常小鼠在后足底皮下注射(i.d.)CFA后,PWT逐渐下降,并在1 d后稳定在较低水平,说明诱发了机械性痛觉超敏。鞘内注射(i.t.)3种剂量的CGA后,PWT出现不同程度的提高。低剂量CGA( 50 ng)作用15 min后,与生理盐水组相比,PWT显著升高(P<0.05),随后迅速下降;中剂量组( 100 ng)在CGA注射后的各时间点,PWT值均显著高于生理盐水组,并在15 min内出现峰值(P<0.01);高剂量CGA( 200 ng) 可更为显著地提升炎性小鼠的PWT,表明CGA可剂量依赖性减轻CFA所诱发的机械性痛敏症状。

Fig 1 Effects of CGA on mechanical allodynia induced by CFA n=6)
2.2 CGA对热痛觉过敏的影响结果显示( Fig 2),正常小鼠在皮下注射CFA后,PWL也出现下降,并在1 d后稳定在较低水平,说明诱发了热痛觉过敏。鞘内给予CGA后,疼痛小鼠的PWL也明显升高,并表现出与PWT变化相近的剂量依赖性和时效关系。

Fig 2 Effects of CGA on thermal hyperalgesia
2.3 CGA对正常动物基础痛阈、运动机能的影响鞘内给予高剂量的CGA(200 ng)后,正常小鼠的PWT(Fig 3A)、PWL(Fig 3B)均未发生改变。在鞘内给予CGA(200 ng)后的各时间点,小鼠在转轮运动时所能承受的最大转速也未发生改变(Fig 3C),表明测试剂量的CGA对小鼠的运动机能并未造成影响。
2.4 CGA对炎性小鼠AMPA受体突触表达的影响免疫印迹结果显示(Fig 4),小鼠后足底注射CFA 1 d后,与注射生理盐水的对照组相比,GluA1亚基的突触含量明显升高(P<0.01),但GluA2亚基保持不变(P>0.05),说明CFA可特异性诱导突触中GluA1的表达亢进。鞘内给予中剂量CGA(100 ng) 作用15 min后,与鞘内给予生理盐水的CFA组相比,GluA1的突触表达水平明显降低(P<0.05),表明CGA可有效逆转CFA所诱发的GluA1的突触表达亢进。

Fig 3 Effects of CGA on basic pain thresholds and motor function of normal animals n=6)

Fig 4 Effects of CGA on synaptic expressions of GluA1 and GluA2 of inflamed mice n=6)
2.5 CGA对炎性小鼠GluA1磷酸化的影响结果显示(Fig 5),小鼠后足底注射CFA 1 d后,脊髓背角GluA1的第845位( Ser845)和第831位的丝氨酸残基( Ser831)的磷酸化水平均明显升高(P<0.01)。给予中剂量CGA(100 ng)作用15 min后,与鞘内给予生理盐水的CFA组相比,GluA1-845的磷酸化水平明显降低(P<0.05),而GluA1-831的磷酸化水平基本不变(P>0. 05),表明CGA可特异性逆转CFA所诱发的GluA1-845的过磷酸化。
3 讨论
本研究利用痛行为学测试发现,鞘内给予CGA可剂量依赖性地抑制CFA所诱发的机械性痛觉超敏与热痛觉过敏,证实了CGA确实对慢性疼痛症状具有改善作用。与之前的报道[17]基本一致的是,CGA的起效较为迅速,在15 min内即可达到峰值,随后其效应迅速下降。这一结果提示,CGA可能并非只通过间接抑制炎症反应而产生镇痛作用。更为重要的是,CGA可能通过某种更为快速的方式调节痛觉传递或可塑性。本研究发现,CGA可快速、特异性地抑制炎性小鼠GluA1亚基的突触表达,提示:逆转AMAP受体的功能亢进是CGA改善慢性病理性疼痛的一个重要机制。
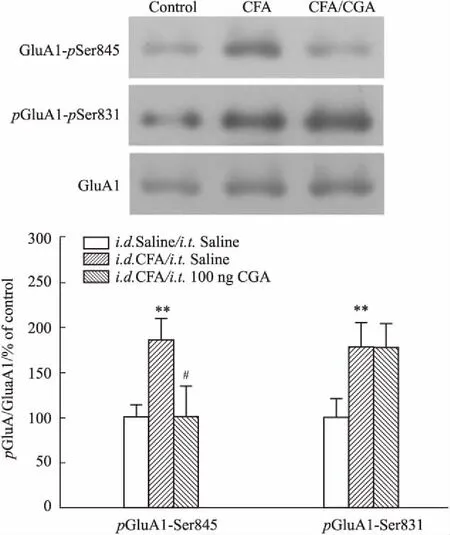
Fig 5 Effects of CGA on phosphorylations of GluA1-Ser845 and GluA1-Ser831 of inflamed mice n=6)
研究显示,AMPA受体亚基的C-末端存在多个磷酸化修饰位点,这些位点的磷酸化与去磷酸化在受体的运输和突触定位中起到关键性作用。其中,GluA1亚基的第831位Ser(GluA1-Ser831)和第845位Ser(GluA1-Ser845)的磷酸化尤为重要。外周炎症或组织损伤可明显提高脊髓背角神经元中GluA1的这两个位点的磷酸化水平,引发GluA1在突触的大量聚集和通道的异常开放,导致突触传递的异常增强,形成痛觉敏感化。值得关注的是,GluA1的磷酸化同时受到蛋白激酶和磷酸酶的双重调控。其中,GluA1-Ser845受到蛋白激酶A( PKA)和钙依赖性蛋白磷酸酶-2B( PP2B)的双重调控。PKA的激活或PP2B的失活,均可提高GluA1-Ser845的磷酸化水平。提高PP2B的活性可抑制GluA1的磷酸化及痛敏症状。本研究发现,CGA可逆转GluA1-Ser845的过磷酸化。因此,CGA对GluA1的调控作用可能与其影响GluA1-Ser845的磷酸化有关。因此,CGA很可能通过活化PP2B,降低GluA1-Ser845的磷酸化,从而逆转疼痛动物的GluA1受体的突触表达亢进,进而产生镇痛效应。
