复方脑肽节苷脂注射液治疗急性缺血性脑卒中388例回顾性研究
2021-09-08于生元贾延劼胡风云张祥建
刘 莹,于生元,顾 平,贾延劼,姜 新,胡风云,张祥建*
(1 河北医科大学第二医院,石家庄 050000;2 中国人民解放军总医院,北京 100036;3 河北医科大学第一医院,石家庄 050000;4 郑州大学第一附属医院,郑州 450000;5 辽宁省人民医院,沈阳 121004;6 山西省人民医院,太原 036200)
在我国,脑卒中是排名首位的致死性疾病[1]。根据卒中引起大脑缺血的原因可分为缺血性脑卒中(ischemic stroke,IS)和出血性脑卒中。IS是最常见的卒中类型,占脑卒中的60%~70%,主要包括脑血栓形成和脑梗死。患者能否获得良好预后,很大程度上取决于是否能迅速地使闭塞血管再通,及时挽救缺血半暗带[2-3]。因此,时间窗内(≤3 h)使用静脉溶栓药物已成为治疗急性IS的重要措施,其疗效的循证医学证据充分。然而,静脉溶栓的实施受到溶栓时间窗、药物本身的局限以及各地区卒中单元建设状况的影响,而总体卒中患者接受静脉溶栓治疗仅为4.1%[4]。因此,急性IS治疗过程中神经保护、减少再灌注损伤、抑制缺血级联反应以减轻神经功能缺损,可作为血管再通之外的另一种特异性治疗手段[5-6],其合理使用亦显得尤为重要。复方脑肽节苷脂注射液是临床广泛应用的多靶点神经保护复方药物,已在临床使用多年。本研究采用回顾性方法,对治疗急性IS的安全性和有效性开展进一步评价。
1 资料与方法
1.1 一般资料
收集2017年11月~2018年11月河北医科大学第二医院、中国人民解放军总医院、河北医科大学第一医院、郑州大学第一附属医院、辽宁省人民医院、山西省人民医院共6家医院收治的急性IS患者的临床资料进行回顾性分析。最终抽取患者388例,各中心入组情况见表1。

表1 各中心的入组人数 例
纳入标准:① 所有病例诊断均符合《中国急性缺血性脑卒中诊治指南2018》诊断标准[4]。② 年龄18~80岁者。③ 根据病史记录,发病14天内进行药物治疗者。
排除标准:① 短暂性脑缺血发作(transient ischemic attack,TIA)、脑出血及颅内异常血管网症患者。② 已确诊脑肿瘤、脑外伤、脑寄生虫病、代谢障碍、风湿性心脏病、冠心病及其他心脏病合并房颤引起脑栓塞者或伴有严重原发性神经系统疾病者。③ 合并严重的心、肝、肾、造血系统和内分泌系统等严重原发性疾病者。④ 排除溶栓者。⑤ 排除使用复方曲肽者。
试验组(复方脑肽节苷脂注射液+常规治疗)191例、对照组(其他神经节苷脂类药物+常规治疗)100例、空白组(常规治疗)97例。除体温外,三组基线资料、病程及疾病分型等无统计学差异(见表2);常规治疗包括急性期的患者给予积极的内科治疗,如控制血压使血压维持在一定的范围;阿司匹林和氯吡格雷双联抗血小板治疗;他汀类药物调脂、稳定斑块;使用扩血管药改善脑组织循环;甘露醇、呋塞米减轻脑水肿。

表2 各组基线资料、病程及疾病分型比较
1.2 治疗方法
依据美国国立卫生研究院脑卒中量表(NIHSS)评分评定脑卒中患者神经功能缺损程度,比较各组患者在治疗前和按疗程治疗后(治疗2周后)的NIHSS评分。疗效判定标准:① 显效:患者体征及临床症状消失,NIHSS评分降低>45%。② 有效:体征及临床症状明显改善,NIHSS评分降低为18%~45%。③ 无效:NIHSS评分变化率<18%或患者症状加重(形成脑疝)[7]。总有效率=显效率+有效率。NIHSS评分变化率=[(治疗前总积分-治疗后总积分)/治疗前总积分]×100%。
观察各组患者改良Rankin量表(mRS)评分变化情况,描述治疗前、治疗后(治疗4周后)mRS评分和评估结果。收集治疗过程中患者生命体征、血常规、便常规、肝肾功能、心电图和不良事件记录进行安全性分析。通过诊断内容以及用药情况分析获得患者的基础用药、合并用药、伴随用药情况,并将其作为疗效判定的混杂因素予以分析[8-11]。
1.3 统计学方法

采用R软件处理本研究所关注的疗效判定混杂用药情况(基础治疗用药、合并用药及伴随用药)。筛选合适的协变量纳入倾向评分模型中,采用条件Logistic回归计算两组研究对象的倾向评分值。采用最邻近匹配法经倾向评分以1∶1匹配后,按常规的统计分析方法比较试验组与对照组、试验组与空白组的疗效差异。
2 结果
2.1 治疗前后NIHSS评分及疗效比较
各组治疗前后NIHSS评分结果如表3所示,试验组治疗前NIHSS评分为3(1,6),治疗后评分下降为1(0,2),各组治疗前NIHSS评分无统计学差异(H=3.02,P>0.05)。治疗后各组NIHSS评分具有统计学差异(H=23.00,P<0.01)。治疗前分值降低程度由高到低为试验组[-2(-4,-1)]、对照组[-1(-3,0)]和空白组[0(-1,0)],具有统计学差异(H=63.86,P<0.05)。试验组显效率为72.77%(139/191),对照组为40.00%(40/100),空白组为12.37%(12/97),组间比较具有统计学差异(χ2=99.648,P均<0.05)。试验组总有效率为78.53%(150/191),对照组为63.00%(63/100),空白组为24.74%(24/97),组间比较具有统计学差异(χ2=80.897,P均<0.05)。
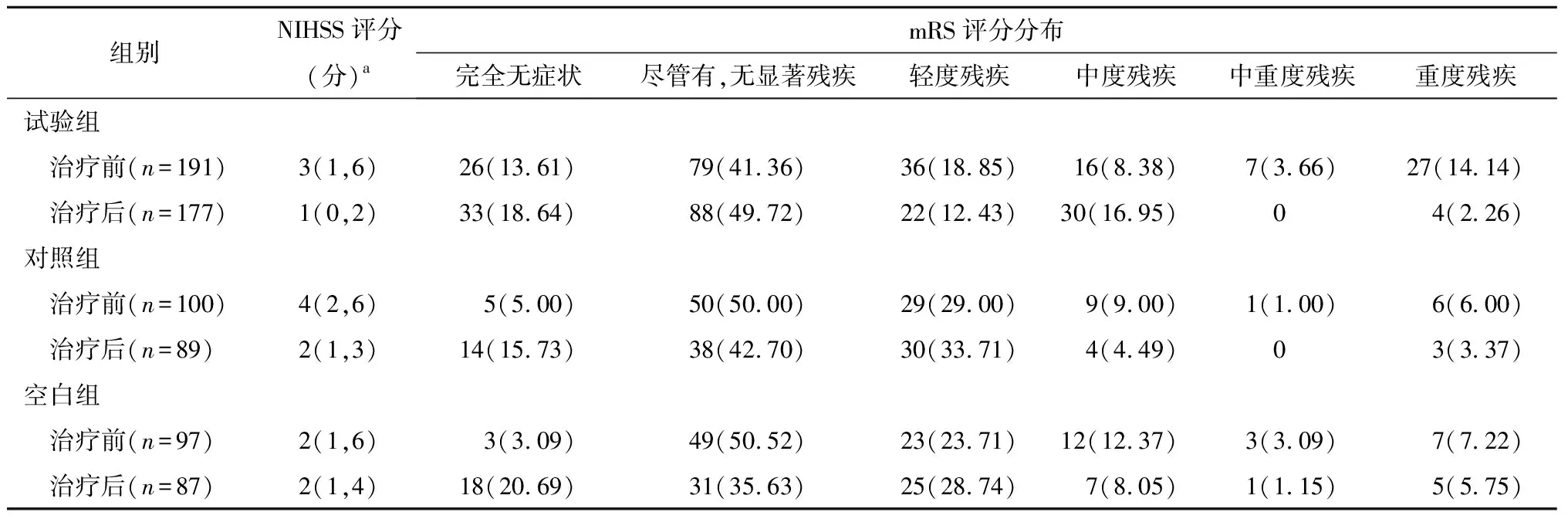
表3 各组治疗前后NIHSS与mRS评估结果情况 n(%)
2.2 治疗前后各组mRS评分分布情况
各组治疗前后mRS评分分布如表3所示。各组治疗前mRS评分无统计学差异(H=0.43,P=0.8081)。治疗后各组mRS分布情况无统计学差异(H=0.87,P=0.6472)。
2.3 不良反应
试验组发生不良事件34例(17.8%),可能与研究药物相关的不良事件为2例;对照组发生不良事件14例(14.00%);空白组发生不良事件12例(12.37%)。不良事件发生率组间无统计学差异(P>0.05)。本研究无患者被记录到发生严重不良事件。
2.4 混杂因素分析
本研究根据实际的用药情况,最终纳入与结局相关的9类药物为协变量,将其作为混杂因素进行统计处理。9类药物:① 抗血小板药。② 降纤抗凝药。③ 脱水剂。④ 扩容药。⑤ 降脂药。⑥ 伴随用药(包括降糖药、高血压药、抗生素类、呼吸系统药、泌尿生殖系统药、消化系统药及其他伴随用药)。⑦ 中药制剂。⑧ 维生素类。⑨ 其他(包括自由基清除剂、神经营养药、脑血管扩张药、钙离子拮抗剂、膜稳定剂、侧支循环药)。以上协变量纳入Logistic回归模型,按1∶1比例,以最邻近匹配法,匹配容差设定为0.2的原则,进行各组间两两匹配。
2.4.1试验组与对照组倾向指数匹配后分析
匹配前,试验组和对照组在“伴随用药”与“合并用药其他”的使用上具有统计学差异。倾向指数评分后,两组各获得100例匹配病例,两组的用药情况均衡可比。经倾向指数评分后,试验组和对照组总有效率和显效率分别为80%(80/100)vs63%(63/100,χ2=7.03,P=0.008),72%(72/100)vs40%(40/100,χ2=20.78,P<0.05)。NIHSS评分相对于基线的变化,试验组降低-3(-12,-1),对照组降低-1(-3,0),具有统计学差异(H=12.95,P<0.05)。倾向指数评分匹配后,第28天的mRS评分数据缺失>10%,以治疗后第14天的评分数据进行替补:两组组间的mRS量表中“完全无症状”“尽管有,无显著残疾”“轻度残疾”“中度残疾”“中重度残疾”“重度残疾”6个等级的患者分布无统计学差异(H=0.22,P=0.639)。试验组与对照组倾向性评分后mRS评价情况见表4。

表4 试验组和对照组倾向性评分后mRS评价情况 n=100,n(%)
2.4.2试验组与空白组倾向指数匹配后分析
匹配前,试验组和空白组在伴随用药、合并用药其他、合并用药维生素类及基础治疗降脂药使用上具有统计学差异。经倾向指数评分后,试验组和空白组最终各获得97例匹配病例,两组的用药情况均衡可比。经倾向指数评分后,试验组和空白组总有效率和显效率分别为81.44%(79/97)vs24.74%(24/97,χ2=62.61,P<0.01)和76.29%(74/97)vs12.37%(12/97,χ2=80.29,P<0.05)。NIHSS评分相对于基线的变化,试验组降低-3(-7,-1),空白组降低0(-1,0),具有统计学差异(H=54.2,P<0.05)。倾向指数评分匹配后,第28天的mRS评分数据缺失>10%,以治疗后第14天的评分数据进行替补:两组组间的mRS量表中6个等级的患者分布无统计学差异(H=2.68,P=1.02)。各组的mRS评分分布如表5所示,试验组用药后轻、中、中重、重度残疾例数分别为22、13、9和1。

表5 试验组和空白组倾向性评分后mRS评价情况 n=97,n(%)
3 讨论
复方脑肽节苷脂注射液是临床常用的IS治疗药物[12],其主要成份为活性多肽和多种氨基酸、多种神经节苷脂、次黄嘌呤等。其中的活性多肽和多种氨基酸能够透过血脑屏障,直接作用于中枢神经,为神经元修复提供氨基酸,营养神经细胞,可作用于呼吸链调节和改善神经元的代谢、促进突触的形成,诱导神经元的分化,同时激活腺苷酸环化酶抑制氧自由基的产生,具有促进记忆和改善脑功能的作用[13];神经节苷脂亦能透过血脑屏障,与大脑受损区域的神经组织高度亲和,增强细胞膜的稳定性,促进神经发生分化,突触和轴突生成,并促进神经损伤后修复再生[14-15];次黄嘌呤参与人体生命活动,改善脑细胞能量代谢和物质代谢、修复受损脑细胞,促进神经功能恢复[16]。Wang等[17]使用大鼠大脑中动脉闭塞模型研究了复方脑肽节苷脂对脑缺血/再灌注损伤的影响。结果表明,缺血性脑卒中后连续7天给予复方脑肽节苷脂有助于恢复大鼠神经功能和减少脑梗死体积。血流监测结果表明,给予复方脑肽节苷脂可有效促进脑卒中后的脑血流恢复,并有助于保护缺血侧血管。此外,复方脑肽节苷脂治疗增加了周围缺血区域的新血管数量,并上调了血管内皮生长因子,血管生成素1及其受体(TEK受体)酪氨酸激酶、成纤维细胞生长因子和Wnt信号通路相关蛋白的表达水平,说明复方脑肽节苷脂改善了大鼠脑缺血再灌注后的血液循环和神经功能。Miao等[18]探讨复方脑肽节苷脂对大脑中动脉闭塞再灌注损伤大鼠缺血神经元损伤的保护作用,并探讨复方脑肽节苷脂的神经保护机制。结果表明,复方脑肽节苷脂可降低大脑中动脉闭塞后14天的梗死体积,降低神经功能缺损评分,并加速体感功能的恢复。此外,复方脑肽节苷脂减少了缺血皮层半影中NeuN阳性细胞的丢失。研究表明,复方脑肽节苷脂通过抑制细胞凋亡、改善突触和线粒体功能,对大脑中动脉闭塞损伤大鼠具有神经保护作用。
本研究中,复方脑肽节苷脂注射液疗效优于其他神经节苷脂类药物。IS的病理过程是多因素参与过程,因此,缺血级联反应中每一过程均存在可干预靶点[19-21]。复方脑肽节苷脂注射液的作用靶点较其他神经节苷脂类药物更为丰富,这或许是其疗效较佳的原因。本研究结果发现,试验组、对照组和空白组间的不良事件发生率组间无统计学差异。本研究为回顾性研究,患者住院期间出现的头晕、恶心等不良事件,大多考虑由疾病本身引起,而与药物相关的不良事件并不多,存在一定混杂因素,复方脑肽节苷脂注射液在本研究中显示出较好的安全性。
在疗效判定上,研究者将试验过程中涉及的药物作为本研究疗效判定的混杂因素,采用倾向性评分的方法进一步处理,在平衡各组间的药物使用情况下,再次对研究药物的疗效进行判定。最终,研究者将试验中记录的9类临床用药作为协变量,采用倾向性评分方法在组间进行匹配。匹配后,试验组分别与对照组和空白组进行比较,试验组在总有效率和显效率上均高于对照组和空白组,具有统计学差异(P<0.05)。试验组NIHSS评分相对于基线降低程度明显高于对照组及空白组,具有统计学差异(P<0.05)。综上所述,使用复方脑肽节苷脂的IS患者较未使用者临床有效率更高,该药能在一定程度上提高IS患者的临床疗效。
本研究也存在一定的局限性,研究结果仅作为临床应用复方脑肽节苷脂治疗IS的参考。首先,本研究所采集的病例数据仅来自6家医院,尚无法反映全部医院的整体情况,存在一定的选择性偏倚。其次,该研究对mRS评分量表访视点设置在治疗后28天(1个月)左右,时间较短。后续研究可考虑延长至3个月或更长,用以明确本药的远期疗效。此外,应开展复方脑肽节苷脂治疗IS的大样本随机对照试验(RCT)研究或真实世界研究,为指导临床安全、合理用药提供依据。
