蛹虫草菌糠体外抑菌效果及其活性成分研究*
2021-09-08何先喆唐庆九潘江安刘洁纯
何先喆,唐庆九,潘江安,俞 苓,刘洁纯
(1.上海应用技术大学香料香精技术与工程学院,上海 201418;2.上海市农业科学院食用菌研究所,上海 201403;3.无锡药明生物技术股份有限公司,江苏 无锡 214100)
我国作为食用菌生产大国,食用菌种类繁多,2019年产量已达3 900万吨[1],意味着每年也会产生大量的菌糠废弃物。其中蛹虫草(Cordyceps militaris)作为一种大型食(药)用真菌,在食品、保健品行业的市场需求也逐渐增大。蛹虫草富含核苷类、虫草多糖、甾醇类、蛋白质、黄酮和氨基酸类等活性成分[2],具有抑菌[3]、免疫调节[4]、抗肿瘤[5]和降血糖血脂[6]等多种药理活性。其中,蛹虫草中的虫草素[7]、β-胡萝卜素[8]、多肽类[9]等成分对大肠杆菌、金黄色葡萄球菌等多种细菌均表现出一定抑制效果。蛹虫草菌糠由菌丝体、培养基基质和发酵代谢产物组成[10],价格低廉且数量巨大,具有较高研究利用价值。但目前部分菌糠仅添加应用于饲料、化肥中[11],大多直接作为废弃物处理,造成了环境污染和资源浪费。为拓展蛹虫草菌糠开发再利用领域,对其抑菌活性进行了探究。
检测抑菌活性时常用的测定方法有扩散法[12]、比浊法[13]和微量肉汤稀释法[14]。现有食用菌抑菌活性研究中较常采用扩散法,但扩散法对食用菌提取物不够灵敏。当样品浓度较低时无法清晰得到抑菌圈,容易导致判断失误[15]。同时由于测定方法的不同,不同来源的食用菌抗菌活性也无法进行比较。微量肉汤稀释法操作简便,可以实现不同样品抑菌活性的高通量筛选[16]。但在筛选食用菌的抑菌活性时会受到食用菌提取液颜色影响,且食用菌中含有丰富的营养物质,会促进细菌生长。因此通过优化一种适用于食用菌的快速高效抑菌活性筛选方法,并对蛹虫草菌糠的抑菌效果及活性成分进行探析,为蛹虫草菌糠的开发再利用提供新方向。
1 材料与方法
1.1 材料与仪器
分析纯乙醇、色谱纯甲醇,国药(上海) 化学试剂有限公司;二甲基亚砜(DMSO)、虫草素,美国Sigma公司;M-H肉汤培养基,青岛高科园海博生物技术有限公司;双抗(青霉素10 000 U·mL-1,链霉素10 000 μg·mL-1),赛默飞世尔科技有限公司;大肠杆菌(Escherichia coli ATCC25922),中国工业微生物菌种保藏管理中心(CICC);蛹虫草菌糠、蛹虫草G18a-1子实体、灵芝(Ganoderma lucidum) S2、竹荪 (Dictyophora indusiata)、蝉 花(Isaria cicadae Miquel)、白僵菌(Beauveria spp.)由上海市农业科学院食用菌研究所提供。
SX-500立式自动压力蒸汽灭菌器,日本tomy公司;ZWY-240恒温摇床,上海智城公司;隔水式培养箱,上海一恒科学仪器有限公司;Biotek-Synergy HT多功能酶标仪,美国Bio-Tek公司;Centrifuge 5810R高速冷冻离心机,Eppendorf公司;Alpha 2-4 LDplus冻干机,德国Christ公司;Waters 600型高效液相色谱仪(配Waters 2996紫外检测器),美国Waters公司。
1.2 试验方法
1.2.1 抑菌方法的优化
参照CLSI(美国临床和试验室标准协会) 推荐的抗微生物药物敏感性试验操作方法[17],优化抑菌方法。将大肠杆菌培养至对数生长期,用M-H肉汤(mueller-hinton-broth) 对菌液进行对倍稀释,使菌液吸光度在600 nm下符合0.5麦氏浊度(即大肠杆菌数量约1×108cfu·mL-1),再稀释100倍备用。放入36℃培养箱里培养过夜,用酶标仪测定吸光度值计算其抑制率。试验采用抗菌药物双抗(青霉素-链霉素)作为阳性对照,每组3个平行。
抑制率(K,%) 计算公式为:
K=[1-(OD1-OD0)/(OD-OD’)]×100%
式中:OD1为加样组培养后的吸光度;OD0为加样组培养前的吸光度;OD为细菌阴性对照组培养后的吸光度;OD’为细菌阴性对照组培养前的吸光度。
1)培养基浓度对大肠杆菌生长的影响
分别配制1.0倍、1.5倍、2.0倍、2.5倍、3.0倍、3.5倍、4.0倍、4.5倍浓度的M-H肉汤培养基,检测菌落生长状况,每组设3个重复。
2)菌液浓度对抑菌活性的影响
将培养至对数生长期的大肠杆菌菌液稀释至0.5麦氏比浊度(即菌液浓度为1×108cfu·mL-1),再分别稀释50倍、100倍、200倍、400倍、800倍和1 600倍,即孔板内菌液的浓度分别为2.00×106cfu·mL-1、1.00×106cfu·mL-1、5.00 ×105cfu·mL-1、2.50×105cfu·mL-1、1.25×105cfu·mL-1、6.25×104cfu·mL-1。取200 μL稀释菌液和10 μL双抗加入 96孔板,每组设3个重复。
3)培养时间对抑菌活性的影响
选定合适的菌液浓度,分别再培养12 h、14 h、16 h、18 h、20 h、22 h、24 h,测定双抗对大肠杆菌的抑制率,每组设3个重复。
1.2.2 食用菌抑菌效果筛选
采用优化后抑菌方法对5种食用菌进行抑制大肠杆菌活性比较。称取1 g样品加入5 mL蒸馏水100℃加热提取2 h,取2 mL提取液12 000 r·min-1离心10 min,取上清液稀释后进行抑菌试验。其中,96孔板每孔加样量为100 μL样品和100 μL稀释菌液,使最终样品浓度为25 mg·mL-1,阳性对照以100 μL 浓度为 25 μg·mL-1的双抗替代样品,设 3 个重复。
1.2.3 抑菌活性物质的初步分离
取200 g蛹虫草菌糠,加2 L水100℃提取1 h,提取2次。将2次提取液合并后,4 000 r·min-1离心10 min,并取部分提取液冻干,得到总水提物组分,剩余部分分于大孔树脂分离纯化取50 g的NKA-Ⅱ大孔吸附树脂放入提取液中,并用顶置式搅拌器搅拌过夜,再取上清冻干得吸附后上清组分;过滤收集树脂并用清水洗净后依次用40%乙醇500 mL洗脱得40%洗脱组分,再用90%乙醇500 mL洗脱得90%洗脱组分。重复上述提取吸附操作后,直接采用95%乙醇洗脱得95%洗脱组分。将40%洗脱组分、90%洗脱组分和95%洗脱组分旋转蒸发浓缩至无醇味,冻干。将冻干后各组分用蒸馏水溶解,恒温振荡仪100℃加热灭菌15 min,进行抑菌活性检测,其中96孔板每孔加样量为100 μL样品和100 μL菌悬液,使最终样品浓度为 25 mg·mL-1、12.5 mg·mL-1。
1.2.4 抑菌活性物质的检测
采用高效液相色谱法(HPLC)测定蛹虫草菌糠提取液中虫草素含量[18]。色谱条件:色谱柱为Venusil MP C18柱 (250 mm×4.60 mm,5 μm);流动相为甲醇∶水 (20 ∶80);流速 1 mL·min-1;紫外检测波长254 nm;进样量10 μL;室温测定。
1.3 数据分析
设立3个重复,结果以平均值±标准差表示,采用Excel 2010和GraphPad Prism 8软件进行数据处理及绘图。
2 结果与分析
2.1 抑菌方法的优化
目前也有较多学者对食用菌的抑菌活性进行了探究,其中大多采用扩散法。陈炳智[19]采用平板打孔法和原位抑菌法测定了长裙竹荪(Dictyophora indusiata)对巨大芽孢杆菌和肠炎沙门氏菌的抑制效果。韩燕峰等[20]采用打孔扩散法发现蛹虫草发酵液及菌丝提取物对大肠杆菌均具有一定抑制作用。但食用菌提取物成分复杂多样,采用传统方法测定对抑菌结果判定不太精确,且无法对多种食用菌进行同时筛选比较。因此需优化一种简便、灵敏且适用于大部分食用菌的抑菌快速筛选方法。
食用菌提取液一般颜色较深,且在培养过程中颜色基本不会发生改变,因此测定培养前后的吸光度,并将培养前的吸光度作为本底值减去可以基本消除食用菌提取液颜色的影响。食用菌提取液中成分复杂,包括多种类型的营养成分,对细菌的生长具有促进作用,会造成样品组细菌增殖远超过阴性对照组,使测定结果不准确。为降低食用菌提取液营养成分的影响,采用提高培养基浓度的方法,在测定过程中保持过量的营养,抵消食用菌提取液营养物质对于抑菌活性测定的影响。不同浓度的M-H肉汤培养基吸光度的测定结果见图1。
由图1可知,随着培养基浓度的增加,吸光度先增加后降低,说明当浓度过低时大肠杆菌未充分得到增殖所需的物质,当浓度过高时使渗透压升高,造成大肠杆菌无法获得营养。因此2.5倍M-H肉汤培养基培养大肠杆菌菌液活性最好,后续试验采用该浓度进行筛选。
考察不同浓度双抗在改变菌液浓度、培养时间后对大肠杆菌抑制效果的影响见图2、图3。
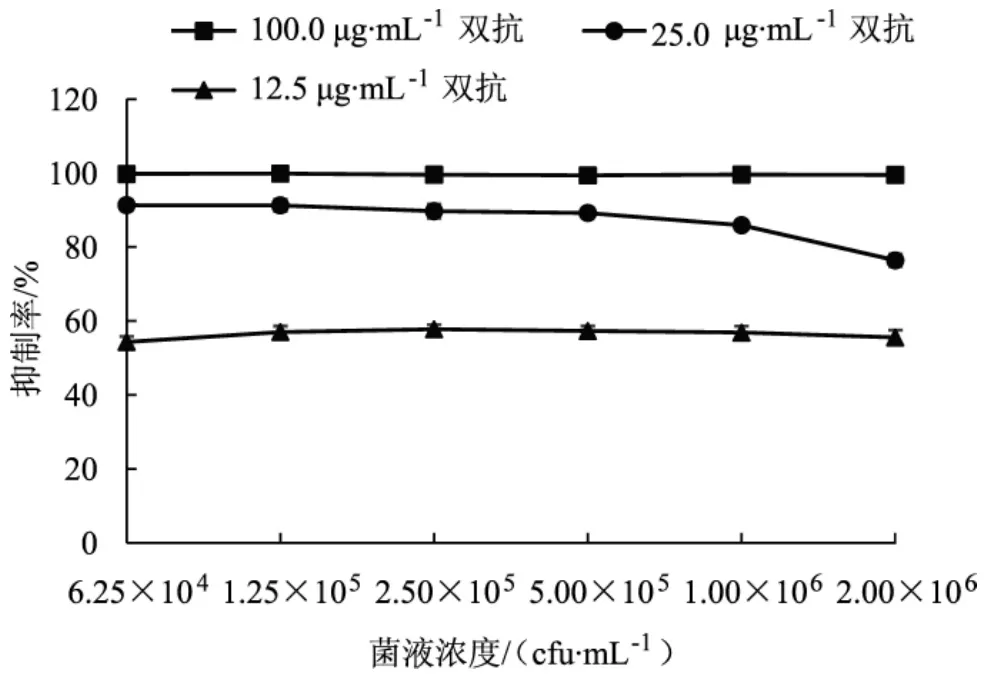
图2 菌液浓度对抑菌效果的影响Fig.2 Influence of bacteria liquid concentration on antibacterial effect
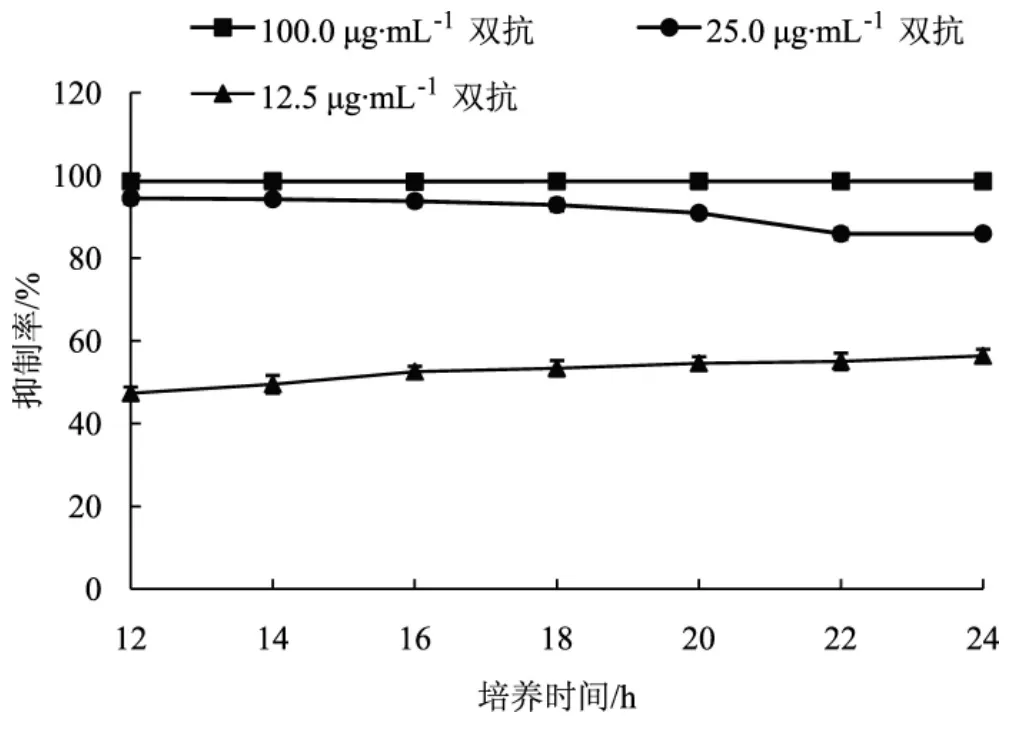
图3 培养时间对抑菌效果的影响Fig.3 Influence of culture time on antibacterial effect
如图2、图3所示,对比可知,双抗浓度过高时可起到完全抑菌效果,浓度过低时抑菌效果较差,无法判断其他因素的影响。因此通过观察25 μg·mL-1双抗的抑制率变化趋势来确定其他最优条件。大肠杆菌菌液浓度在 2.5×105cfu·mL-1~1.0×106cfu·mL-1范围内,抑制率相对稳定,随着菌液浓度的增大,抑制率下降趋势也随之增大,因此后期试验选择适宜菌液浓度为5.0×105cfu·mL-1。大肠杆菌培养时间在12 h~18 h范围内,双抗的抑菌效果较好,培养超过18 h后,抑制率逐渐降低,因此选择培养时间16 h作为抑菌效果观察阶段。
2.2 食用菌抑菌效果的筛选
前期试验对几种食用菌水提物和醇提物抑菌活性比较发现食用菌水提物的抑菌效果较好,因此对5种食用菌的水提物抑菌活性进行比较,试验结果见图4。

图4 不同食用菌抑菌结果比较Fig.4 Antibacterial results of different edible fungi
由图4比较得知,5种食用菌对大肠杆菌均具有抑制效果,其中蛹虫草的抑菌活性最好,对大肠杆菌的抑制率为58.01%。蛹虫草的抑菌活性已被广泛验证,但目前对蛹虫草菌糠的活性研究较少,未见对其抑菌活性的探究。因此再次对蛹虫草菌糠进行抑菌效果检测,发现菌糠提取液对大肠杆菌也有一定的抑制效果。现在仅有部分研究为充分利用蛹虫草菌糠中的营养物质,将其添加应用到保健醋[21]、保健酒[22]中,对蛹虫草菌糠的抑菌活性进行研究可以为其开发再利用拓展新领域,因此后续采用蛹虫草菌糠为原料,对其中成分进行分离,以探究其中抑菌活性部位及成分。
2.3 抑菌活性物质跟踪分离
蛹虫草菌糖分离后各组分抑菌活性试验结果见图5。

图5 蛹虫草菌糠各组分对大肠杆菌的抑制结果Fig.5 Inhibitory effects of various components of Cordyceps militaris chaff on Escherichia coli
由图5比较可知,蛹虫草菌糠提取物各组分对大肠杆菌均有一定抑制效果,且经分离纯化后,抑菌效果得到大幅提升。通过组分1和组分2抑制率对比发现:经过NKA-Ⅱ大孔吸附树脂吸附后,上清对大肠杆菌的抑制率降低,说明抑菌活性物质浓度下降,有效抑菌成分被NKA-II大孔树脂吸附富集;组分3和组分4分别为用40%乙醇和90%乙醇逐级洗脱物质,2组分抑菌活性较好,抑制率分别为59.7%、86.7%,均超过总水提物。后继续采用95%乙醇直接对树脂进行洗脱,发现该组分抑菌效果最好,浓度25 mg·mL-1时抑菌效果几乎与阳性对照持平,抑菌率为94.01%,说明蛹虫草菌糠中抑菌成分在此组分中含量最高。
2.4 抑菌活性成分的检测
核苷类成分为蛹虫草中主要抑菌成分之一[23],蛹虫草菌糠主要由菌丝体、代谢产物等组成,也具有子实体中相似成分。各组分HPLC检测图谱见图6。现有研究对蛹虫草菌糠中核苷类物质进行检测,发现其中虫草素含量较高[24],故采用HPLC对蛹虫草菌糠各分离组分进行虫草素含量的测定。由峰保留时间、峰面积与虫草素标品对比计算虫草素含量见表1。
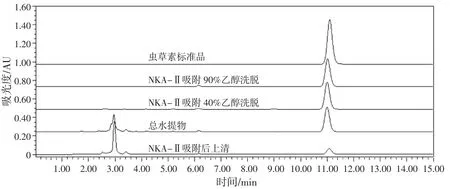
图6 蛹虫草菌糠各组分虫草素HPLC图谱Fig.6 HPLC profile of cordycepin from the Cordyceps militaris chaff

表1 蛹虫草菌糠各组分虫草素含量Tab.1 Cordycepin content of Cordyceps militaris substrate chaff
结合抑菌结果及虫草素含量可知各组分抑菌效果与虫草素含量呈正相关,抑菌效果较好组分虫草素含量也较高。上述试验得到的抑菌效果最好为95%洗脱组分,虫草素含量也最高,可达89.9%。Jiang等[25]也发现虫草素具有广谱抑菌性,可以有效抑制革兰氏阳性和革兰氏阴性细菌。因此确定虫草素是蛹虫草菌糠中主要抑菌活性成分之一。
3 结论
食用菌因其成分复杂,在采用常规抑菌方法时有检测结果不精确等问题,对其抑菌方法进行优化,消除了食用菌提取物颜色深、营养成分复杂等问题,实现了对多种食用菌抑菌效果准确、高效的高通量检测。通过对比蛹虫草G18a-1、灵芝S2、竹荪、蝉花、白僵菌5种食用菌的抑菌效果,发现蛹虫草对大肠杆菌的抑制效果最好,抑制率达到58.01%。进一步对该蛹虫草菌糠进行抑菌检测,发现其也具有一定抑制效果。因此,对蛹虫草菌糠进行抑菌成分吸附分离并定性分析;抑菌结果显示,95%洗脱组分>90%洗脱组分>40%洗脱组分>总水提物>吸附后上清。HPLC虫草素含量测定结果显示,各组分的抑菌效果与虫草素含量呈正比。其中95%洗脱组分抑菌率最高为94.01%,测得虫草素含量最高为89.9%,可知虫草素为蛹虫草菌糠中主要抑菌成分之一。蛹虫草菌糠相较于子实体而言,产量巨大且价格便宜,因此该研究为采用蛹虫草菌糠制备天然、绿色、安全的防腐剂提供可能性,蛹虫草菌糠后续开发再利用具有广阔市场前景。
