儿童晚发型痫性痉挛的临床特征分析
2021-09-07廖彩时康庆云杨理明
廖彩时,康庆云,杨理明
痫性痉挛(epileptic spasms,ES)是2006年由国际抗癫痫联盟(International League Against Epilepsy,ILAE)命名的一种癫痫发作形式,2017年ILAE对其定义进行了新的修订,其临床表现为突然屈曲、伸展,或屈伸混合为主的近端肢体和躯干肌肉收缩,通常持续时间较肌阵挛长,但短于强直性发作。同时可见做鬼脸、点头和轻微眼肌运动,常成串出现。ES可发生于任何年龄,90%在1岁以内起病[1]。晚发型痫性痉挛(late onset epileptic spasms,LOS)是指痉挛发作的起病年龄大于或等于12个月,发作期的临床表现和脑电图(EEG)符合ILAE定义的ES的特征[2]。
LOS患儿在病因、症状学及疗效方面与婴儿痉挛症不尽相同,发病机制尚未阐明,EEG特点及治疗依据有待深入研究,本文回顾性分析LOS患儿的临床特征及治疗效果,探讨儿童LOS的病因、临床-电生理特点、疗效及预后。
1 资料与方法
1.1 一般资料
选取2015年1月至2019年12月在我院神经内科住院部收治的LOS共102例患儿,其中男性68例,女性34例。LOS的诊断标准[3]:①发作期的临床表现和神经电生理检查均符合ILAE定义的ES的特征;②ES的起病年龄大于或等于12个月(不考虑其他发作类型的起病年龄)。
1.2 分组
症状性LOS组(后均简称为症状组):由已知的脑结构异常或损伤、代谢或遗传性疾病或其他神经系统疾病引起的癫痫;隐源性LOS组(后均简称为隐源组):无任何可以导致癫痫的病因、发病前发育正常且无其他形式癫痫发作、实验室及头颅影像学检查基本正常。
1.3 病历资料收集及随访
同步录像脑电图(V-EEG)监测:所有患儿均接受至少1次4 h的V-EEG 监测,包括清醒-睡眠-唤醒过程,并至少监测到1次明确的痫性痉挛发作,并有同步肌电图(EMG)记录证实。
病因学检查;所有患儿均进行头颅核磁共振(MRI)检查及血生化、血乳酸和血氨等检查;其中36例患儿进行了血和尿遗传代谢疾病筛查。
1.4 治疗方案
抗癫痫药物(AED)组:丙戊酸、左乙拉西坦、托吡酯、氯硝西泮和拉莫三嗪等广谱AED,单药或联合治疗;AED联合促肾上腺皮质激素(adrenocorticotropichormone,ACTH);上述口服AED联合ACTH静脉滴注;AED联合甲泼尼龙组:上述口服AED联合甲泼尼龙静脉滴注;所有患儿均在住院期间予大剂量维生素B6静脉滴注。
1.5 疗效评估
以坚持规范治疗4周后短期疗效进行统计学比较。疗效判定如下:①无发作:发作消失;②有效:发作次数减少≥50%;③无效:发作次数无减少或减少<50%。
1.6 随访
通过门诊复诊、电话随访或再入院随访者共84例,随访时间6个月至4年,失访率为17.6%。随访内容包括癫痫发作控制时间、有无复发、复发时间、复发类型、药物治疗过程和精神运动发育情况等。其中精神运动发育情况仅由医生及家长老师粗略评估。比较随访患儿24周时不同治疗方案的长期疗效。
1.7 统计学分析
采用SPSS 23.0统计软件进行数据处理。计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 病因学分析
本组102例LOS患儿中有42例患儿病因不明,占比41%。在60例已知病因患儿中,围生期脑损伤10例(16%),以新生儿期低血糖及围产期窒息和(或)宫内窘迫为主;颅内感染17例(27%),其中病毒性脑炎14例,占已知病因的23%;脑发育异常10例,以巨脑回畸形及胼胝体发育异常为主;肿瘤6例,包括星形细胞胶质瘤、下丘脑错构瘤等;意外所致脑损伤5例,包括药物中毒、溺水等原因;不明原因脑软化12例。结果详见表1。
2.观察组和对照组患者手术并发症发生情况比较:观察组CP患者术后感染2例,无肠胀气、疼痛、出血及穿孔等并发症发生,其手术并发症发生率为1.4%;对照组CP患者术后出现并发症16例,其中肠胀气3例、疼痛5例、出血3例、穿孔2例、感染3例,并发症发生率11.6%。观察组CP患者手术并发症明显低于对照组,差异有统计学意义(P<0.05)。
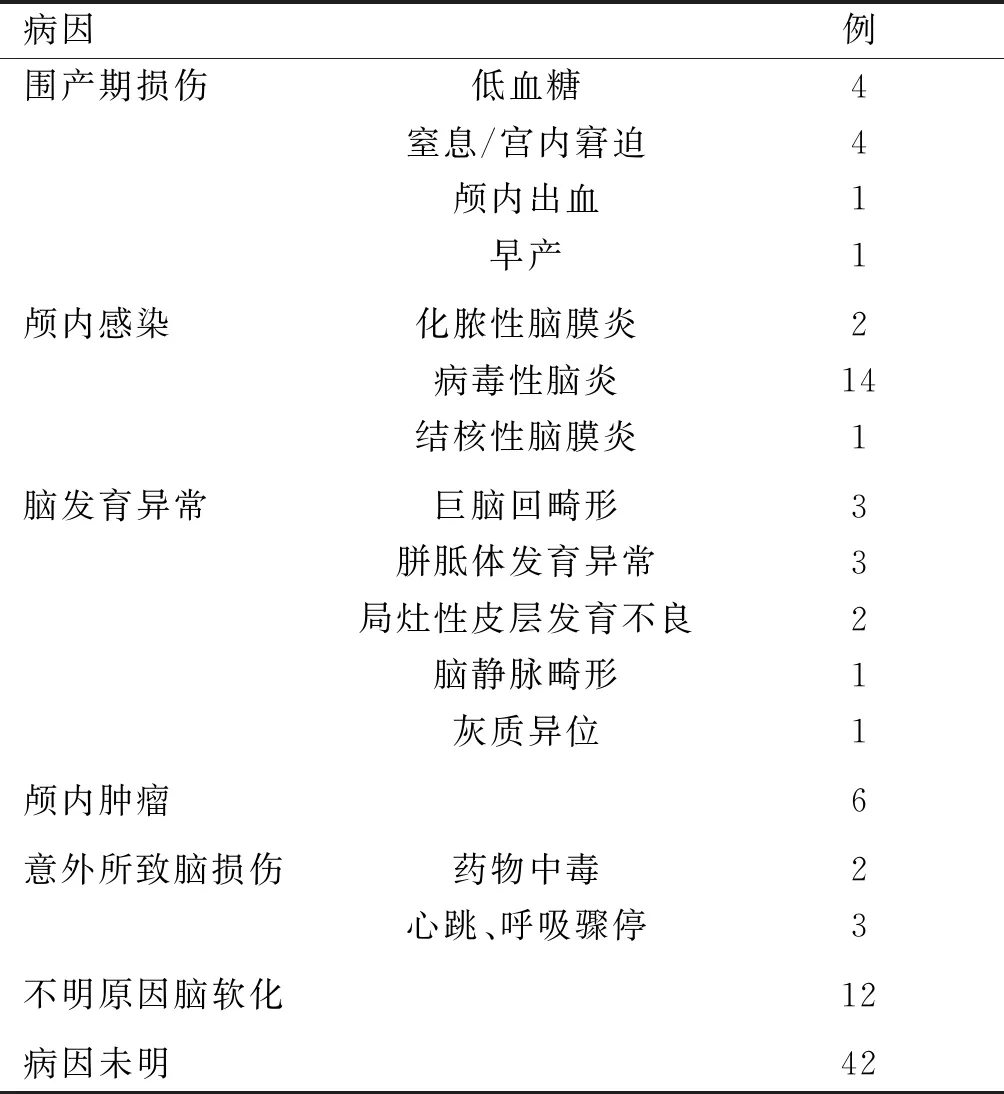
表1 102例LOS患儿的病因比较(例)
2.2 临床特点
症状组LOS患儿中男39例,女21例,起病年龄中位数为26个月,病程中位数为5.5个月;隐源组LOS患儿中男29例,女13例,起病年龄中位数为22.5个月,病程中位数为3.5个月,两组在性别及起病年龄分布上比较差异无统计学意义。癫痫起病发作形式:以痉挛发作为首发表现者:症状组46例(74%),隐源组36例(90%);以其他发作形式起病者:症状组14例(强直/强直阵挛发作5例,失张力发作1例,局灶性发作8例),隐源组6例(强直/强直阵挛发作1例,肌阵挛发作2例,局灶性发作3例);癫痫发作形式:①仅表现为痫性痉挛发作者:症状组41例(66%),隐源组31例(78%);②合并多种发作:症状组19例,隐源组11例(包括强直/强直阵挛发作、失张力发作、不典型失神、肌阵挛发作、局灶性发作等)。结果详见表2。
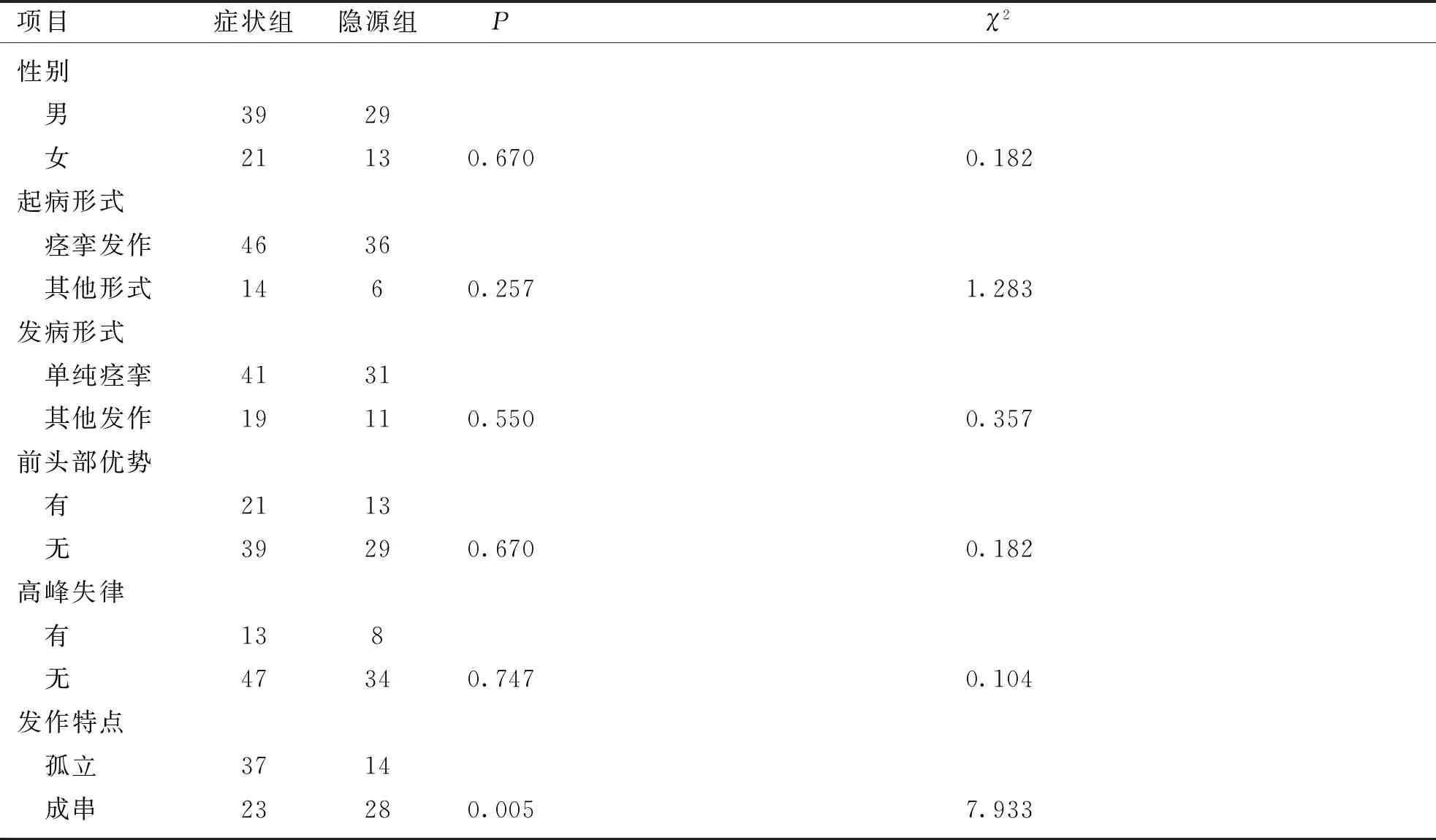
表2 症状组与隐源组LOS患儿的临床特点分布比较
2.3 发作期和发作间期EEG特点
LOS的发作表现为点头弯腰、双上肢内收、双下肢上抬,同期EEG为全导高至极高波幅δ节律复合快活动阵发,持续约1~2 s;症状组的痉挛发作以孤立发作占优势,而隐源组中以成串痉挛发作为主,两者比较差异有统计学意义(χ2=7.933,P<0.05)。
所有患儿发作间期EEG均有全导/多灶痫样放电或局灶痫样放电,高度失律者仅占20%,且以不典型高度失律、片段性高度失律图形为主,放电优势位于前头部者(额、颞区)占33.3%,症状组、隐源组在发作间期有无高度失律、有无前头部优势的分布比较差异无统计学意义。
2.4 疗效
102例患儿均在住院期间规范行抗癫痫治疗,ACTH组根据患儿发作控制情况及短期治疗后EEG复查在2~4周不等,部分患儿因ACTH缺药选用甲泼尼龙大剂量冲击治疗; 癫痫治疗4周短期疗效中总体有效率为59.8%,其中隐源组有效率(73.8%)高于症状组(50%),两者比较差异有统计学意义(χ2=8.795,P<0.05)。ACTH的总使用率为30.3%,总体有效率为80.6%,在隐源性患儿中ACTH治疗组的有效率为88.9%,显著高于AED组及甲泼尼龙组(χ2=14.643,P<0.05)。同时,在隐源组中仅表现为痉挛发作的患儿治疗4周有效率显著高于合并其余发作形式组,两者比较差异有统计学意义(χ2=18.279,P<0.05)。结果详见表3、4。
随访的84例患儿治疗24 周时的疗效比较见表4。隐源组有效率仍高于症状组,但两者比较差异无统计学意义;随访资料中有4例患儿经常规抗癫痫治疗无效加用生酮饮食,因随访时间短或家属自行停用等原因总体疗效欠佳,未纳入统计分析。3例患儿加用氨基己酸治疗,无显著疗效。1 例神经节细胞胶质瘤患儿经手术治疗后达到持久无发作。

表3 症状组与隐源组LOS患儿不同发作形式之间4周疗效比较(例)

表4 症状组与隐源组LOS患儿不同治疗方案的4周疗效比较(例)
2.6 精神行为评估
在随访获得的84例资料中,49例患儿出现严重的精神运动发育落后或倒退,生活不能自理(症状组35例,隐源组14例),35例智力运动基本正常或轻度异常(症状组11例,隐源组24例),包括语言能力下降、记忆学习能力差、走路姿势异常等,总体上症状组患儿预后差,多数累及智力发育。因未进行专业智力量表评估,未进行统计学分析。
3 讨论
ES作为一种独立的发作形式,不仅存在于婴儿痉挛症中,也存在于其他癫痫综合征中。由于ES的病因多样,其在起病年龄、发作特点、EEG特征上具有明显差异,本研究归纳LOS的临床特点,探讨其病因有助于指导癫痫患儿的治疗及改善其预后。
国内外关于LOS的病因研究中,围产期脑损伤、中枢神经系统感染、脑结构异常为3大主要病因[4-7]。本研究关于102例LOS患儿的病因研究中,60例发现明确病因,以中枢神经系统感染所致脑损伤为主,包括病毒性脑炎和化脓性脑膜炎等;围产期脑损伤位居第二,包括新生儿低血糖、围产期窒息、新生儿颅内出血等。其他病因包括巨脑回畸形、胼胝体发育异常、局灶性皮层发育不良等脑发育畸形、肿瘤、意外和不明原因脑软化等。
病毒性脑炎所致不可逆脑损伤是继发LOS的主要原因之一。由于大脑皮层广泛受累,患儿可出现包括痉挛发作、强直发作及局灶性发作等多种发作形式,头颅MRI可见明显结构异常,患儿多出现精神发育迟滞、运动功能障碍、语言能力受损等严重后遗症。旷小军等[8]总结25例病毒性脑炎继发LOS患者的临床资料,发现其中88%的痉挛发作不成串,发作间期EEG背景存在广泛性或局部性异常慢波,痫样放电为局灶性或广泛性,23例无高度失律。而本研究中14例病毒性脑炎继发LOS患儿中仅1例表现为片段性高度失律,11例(78%)表现为非成串性痉挛发作,这与上述研究结果一致。
脑皮质发育畸形也可导致LOS的发生。陈国洪等人[9]综述国内外近30年来关于LOS的10项临床研究,发现已知病因中脑皮质发育畸形占比最高,值得注意的是,局灶性皮层发育不良(FCD)在LOS中扮演重要角色[7]。FCD在年长儿中常以局灶性发作起病,但低龄儿中常表现为痉挛发作,其发作可以是对称或不对称的,EEG多数没有典型的高度失律,可表现为广泛性和(或)多灶性放电。且额部的FCD似乎更容易导致晚发型ES,但总体的远期预后及精神运动发育更良好。本研究中2例PCD患儿均表现为成串性痉挛发作,EEG无典型高度失律,发作间期的EEG放电有明显的致痫区放电优势,与患儿的影像学改变相符合。杨海坡等[10]报道1例3岁起病的LOS患儿,早期头颅MRI无显著异常,在后续随访中发现EEG从广泛性放电演变成致痫灶的局灶放电,进而通过头颅MRI发现FCD的存在。这提醒我们在寻找癫痫病因的过程中需要动态观察EEG及影像学的演变,早期患儿生理或病理的脑发育不成熟可能导致“全面性”放电,从而掩盖了局部致痫灶的放电活动。此外围产期的脑损伤、肿瘤、不明原因脑软化、亚历山大病[11]等代谢性疾病也可导致LOS的发生。
据报道遗传性癫痫占总体癫痫的30%[12]。关于LOS的遗传学病因也得到更多的报道。在病因未明的LOS患者中可能多数与遗传性因素相关,这值得我们进一步探讨。目前已知的与LOS相关的遗传学病因包括3大类[9]:基因组失衡,如21-三体综合征、Phelan-McDermid综合征;单基因病,如STXBP1基因突变;拷贝数变异,如MECP2拷贝数变异。
本研究中约40%的患儿病因不明,而在后续随访中发现LOS患儿部分基因异常,其中3例出现TSC2基因突变,其突变位点分别为c4867A>G,c781C>G,c566G>C,3例均为错义突变,相关研究也报道TSC2突变以错义突变常见[13]。临床表现以ES首发者2例,起病年龄1岁零1个月至2岁零8个月,1例以局灶性发作首发,起病年龄1岁零3个月,出现成串或孤立的痉挛发作,但由于缺乏色素脱失斑、面部血管纤维瘤、室管膜下结节或钙化灶、牛奶咖啡斑等结节性硬化(TSC)主要症状,未能确诊结节性硬化,在随访过程中1例失访,剩余2例抗癫痫控制不佳,伴有轻度精神运动发育落后。TSC2基因是TSC的致病基因之一,关于TSC基因型与表型的相关性研究表明,TSC基因异常患者中癫痫发作发生率为80%~90%,起病年龄为0~2岁,主要表现为婴儿痉挛,可导致智力低下、语言及运动发育落后,预后较差;其次为部分运动性发作以及全身强直阵挛发作[14]。TSC2基因突变是TSC主要的分子学发病机制,临床表现较重,患者更易出现智力低下、癫痫、面部血管瘤及肾错构瘤等症状。TSC2基因突变导致ES风险概率是TSC1基因突变的1.56倍[15]。因此,上述3例患儿最终能否确诊TSC需要动态随访。1例患儿经二代测序发现PPP3CA基因c1283-1284insC移码突变,导致蛋白翻译提前终止,诊断为婴儿或儿童早期癫痫脑病1(IECEE)。IECEE是一种以PPP3CA基因突变引起的以顽固性癫痫、精神运动发育迟缓和智力障碍为特征的常染色体显性遗传病[16]。该患儿癫痫发作以肌阵挛发作为首发表现,同时存在ES、不典型失神等多种发作形式,伴有湿疹及语言发育延迟,头颅MRI正常,经丙戊酸钠、左乙拉西坦联合抗癫痫治疗效果欠佳,后期加用生酮饮食仍未控制,预后不佳。
EEG发作间期的高度失律图形是ES的一大特点,也是West综合征的3大主征之一,可作为预测婴儿痉挛的发作或停用ACTH后痉挛复发的指标[17]。但在本研究中LOS患儿EEG发作间期仅20%的患儿出现高度失律图形,痉挛的起病年龄在1~2岁左右,且绝大多数表现为不典型高度失律和片段性高度失律。吴舒华等[4]认为ES的发作与高度失律图形无必然联系,且高度失律多具有年龄依赖性,2~3岁后一般不具有典型的高峰失律图形,本研究与之一致。此外,癫痫发作间期的EEG持续放电也是ES的特征之一,Eisermann等[3]报道22例病因不明的LOS患儿痉挛发作间期的放电主要位于颞区或颞-额区,具有前头部优势。他认为这种情况可能是介于婴儿痉挛症与LGS综合征两者之间的过渡阶段,反映了颞叶成熟过程异常或潜在的颞叶损伤。而本研究中放电优势位于前头部者(额、颞区)占33.3%,症状组、隐源组在发作间期有无高峰失律、有无前头部优势的分布上比较差异无统计学意义。有学者归纳10例LOS患者发现其均具有不典型的ES表现,无明显高度失律图形,且多数存在显著发育迟滞,建议单独归为晚发型婴儿癫痫脑病[18]。本研究中患儿的远期精神运动发育情况同样不容乐观,58%出现严重的精神运动发育迟滞,生活不能自理,其中以症状性癫痫患儿为主,可以与其出生后不可逆脑损伤有关,多数累及智力、语言功能,隐源性癫痫患儿相对而言智力运动发育情况较好,可能与痉挛及时控制相关。
对ES的治疗主要分为AED治疗、生酮饮食及手术治疗。LOS的治疗仍是一大难点,其病因的复杂性决定了其治疗困难及预后欠佳。目前国内外关于ES尤其是婴儿痉挛的首选药物治疗仍是ACTH及氨基己酸[19]。由于使用ACTH需长时间住院治疗,部分医院缺药,且可出现库欣综合征、易怒、食欲增加,睡眠障碍、高血压、继发感染等不良反应,部分临床研究推荐可使用甲泼尼龙冲击治疗或口服泼尼松片替代治疗[20-21]。大多数临床研究证实托吡酯在ES患者的AED辅助治疗中具有明显优势,但有学者认为,泼尼松片联合中等剂量托吡酯口服的患者相较于单独使用泼尼松的患者而言,在癫痫的控制及预后方面无显著差异[22]。廖建湘等[23]建议对于持续性ES患者也可使用类似自身免疫性脑炎的治疗方案,如丙种球蛋白、免疫抑制剂(环磷酰胺、雷帕霉素)等,其中急性症状性癫痫对免疫治疗效果较好。本研究中ACTH在治疗LOS上仍具有显著优势,且在隐源性LOS患儿短期疗效中更明显,差异有统计学意义。这可能与ACTH对ES这一发作形式有效,而隐源性LOS多表现为单纯痉挛发作有关。氨基己酸国内尚未普遍推广,且长时间使用易导致视野缺损等严重不良反应,本研究中仅3例患儿在后续随访过程中加用氨基己酸联合治疗,控制效果不佳。我院前期ACTH缺药,部分患儿使用甲泼尼龙大剂量冲击或泼尼龙片口服替代治疗,但总体疗效无显著优势,需要更多的样本作进一步的临床研究。
生酮饮食是目前治疗癫痫的一大热门方案。经临床研究表明,添加生酮饮食对包括ES在内的多种儿童难治性癫痫有效。但我国开展生酮饮食治疗较晚,缺乏大样本多中心的随机对照试验,且由于儿童年龄小,治疗依从性及耐受性差,使得生酮饮食的推广受限[24]。本研究随访资料中有4例患儿经常规抗癫痫治疗无效加用生酮饮食,因随访时间短或家属自行停用等原因总体疗效欠佳,未纳入统计分析。对于有明确致痫灶的LOS患者而言,若AED治疗效果欠佳,可选择手术治疗达到癫痫缓解及认知评估改善的效果。FCD也是LOS的责任病灶之一,国外学者对6例实施癫痫病灶切除术患者进行研究随访,发现其中5例病理结果是FCD Ⅰ型,且进行手术者癫痫完全缓解率为67%,高于未手术者的50%,同时有更好的认知结果。
总之,LOS的病因多样,以围产期损伤及中枢神经系统感染所致脑损伤为主,对于不明原因的LOS患者,应根据其EEG特点及癫痫发作的演变情况反复寻找结构性病因,尤其是对于FCD,更应注重遗传学病因的探讨。LOS的发作特点与婴儿痉挛明显不同,可成串或孤立发作,常无典型高峰失律图形,症状性癫痫发作间期的放电与致痫灶明显相关。及时控制痉挛发作及明确病因有助于指导癫痫的治疗及判断预后。国内对LOS的治疗仍以ACTH及AED为主,部分患者可选用甲泼尼龙大剂量冲击及丙种球蛋白等免疫治疗。LOS的预后总体欠佳,这可能与病因复杂有关,隐源性LOS相对预后较好,但LOS能否作为单独的一类癫痫脑病仍值得我们更多地研究探讨。
