三七总皂苷对脑缺血再灌注大鼠TLR4/NF-κB信号通路及炎性细胞因子的影响*
2021-09-07周玉嘉张允岭马青科金香兰张志辰
周玉嘉 张允岭 周 晶 田 沫 马青科 金香兰 张志辰△
(1.北京中医药大学东方医院,北京 100078;2.中国中医科学院西苑医院,北京 100191;3.北京第一中西医结合医院,北京 100026)
根据《全球疾病负担研究》报告,中风已成为第2大死亡原因,也是全球残疾调整生命年的第3大原因[1]。近年来,缺血性卒中的临床治疗手段越来越多样化,大量研究表明,血管再通是治疗缺血性脑卒中的最有效手段。中风后的脑损伤是由于流向大脑的血液中断以及受损区域缺氧引起的[2]。然而,对于发生血栓后的组织来说血供的重建会提高损伤的程度,即缺血再灌注损伤(I/RI)[3]。炎症是I/RI的主要机制之一[4],神经缺血缺氧后可激活Toll样受体4(TLR4),激活核因子-κB(NF-κB),被激活的NF-κB可以促进多种促炎性细胞因子合成,促进小胶质细胞释放促炎性细胞因子白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α),减少抑炎性细胞因子白细胞介素-4(IL-4)、白细胞介素-10(IL-10)等释放,扩大炎症反应。因此,靶向抑制TLR4/NF-κB信号通路,可降低脑组织促炎性细胞因子的表达,改善组织炎性损伤。
三七总皂苷是三七提取物,临床上广泛应用于心脑血管疾病。基础研究发现,三七总皂苷可以改善大鼠脑、心、肾等脏器I/RI损伤[5-8]。目前研究认为,三七总皂苷对脑缺血/再灌注损伤的保护机制涉及其对自由基及脂质过氧化物、细胞凋亡、钙通道、神经元损伤、相关信号通路蛋白表达等[6]。本研究旨在从TLR4/NF-κB信号通路及炎症因子角度,探讨三七总皂苷对脑缺血/再灌注大鼠脑组织的保护作用机制。
1 材料与方法
1.1 实验动物 SPF级雄性Wistar大鼠45只,体质量(275±25)g,购自北京维通利华实验动物技术有限公司,使用许可证编号:SYXK(京)2019-0013。饲养于北京中医药大学东方医院动物中心,饲养级别为SPF级,5只/笼,保证正常光照节律、温度适度、环境安静,正常大鼠生长繁殖饲料饲养,自由进食和饮水。本研究通过北京中医药大学动物实验伦理审批(批号:2019072)。
1.2 试药与仪器 三七总皂苷(广西梧州制药有限公司,生产批号:19060106)。大鼠线栓(广州佳灵生物科技有限公司,规格:L3600);大鼠IL-1β ELISA试剂盒(Abcam,ab100768);大鼠TNF-α ELISA试剂盒(Abcam,ab100785);大鼠IL-4 ELISA试剂盒(Abcam,ab100771);大 鼠 IL-10 ELISA 试 剂 盒(Abcam,ab100765);Anti-TLR4抗体(Abcam,ab217274);Anti-NF-κB p65抗体(Abcam,ab16502)。显微镜(Leica公司,型号DM3000);酶标分析仪(无锡华卫德朗仪器有限公司,DR-200BS);高级凝胶成像系统(基因有限公司,G:BOX F3)。
1.3 分组与造模 所有大鼠适应性饲养1周后,随机分为假手术组、模型组、中药组各15只。模型组及中药组建立I/RI模型。造模方法:10%水合氯醛(0.35 g/kg)麻醉大鼠,麻醉成功之后,大鼠固定于操作台,颈部正中切口,游离右侧颈总动脉、颈内动脉及颈外动脉,颈外动脉及结扎,夹闭颈总动脉,在大鼠做一V型切口,插入线栓并缓慢向前推进,直至插入大脑中动脉,轻遇阻力即停止。栓塞2 h后,缓慢拔出线栓,逐层缝合大鼠伤口。假手术组不插入线栓外,其余操作与模型组及中药组相同。造模24 h后评估模型成果,成功标志:Longa神经功能分级评分≥2分的大鼠为模型制备成功。剔除各组造模不成功大鼠及死亡大鼠,最终假手术组14只,模型组12只,中药组13只。
1.4 给药方法 中药组大鼠尾静脉注射三七总皂苷50 mg/kg(给药剂量参考文献[7]),模型组及假手术组给予等量0.9%氯化钠注射液尾静脉注射。各组给药均每日1次,连续3 d。
1.5 神经行为学评分 给药3 d后,对所有大鼠进行Garcia评分[8],从大鼠自主运动、体态对称性、前肢伸展功能、攀爬运动、身体双侧触觉、双侧胡须碰触反应等6个方面评估大鼠神经功能损伤的程度。分值为3~18分,数值越大,神经功能损伤越轻,18分为正常。
1.6 标本采集与检测 1)大鼠脑组织HE染色。各组大鼠完成神经行为学评分后,每组随机取3只大鼠麻醉,4%多聚甲醛灌注固定,留取脑组织制作5 μm的冠状石蜡切片。切片脱蜡、复水后进行HE染色,在普通光学显微镜下观察大鼠脑组织形态变化。2)大鼠脑组织氯化三苯基四氮唑(TTC)染色。每组随机取3只大鼠麻醉,生理盐水心脏灌注,留取干净脑组织迅速放入-20℃冰箱里冷冻,20 min后取出,冠状位切5~6片,每片厚约2 mm。切好的脑组织用2%TTC染色液37℃孵育染色30 min,冲掉多余染色液,4%多聚甲醛固定,24 h后拍照,计算脑梗死面积。3)大鼠脑组织小胶质细胞炎性细胞因子IL-1β、TNF-α、IL-4、IL-10水平检测。各组剩余大鼠麻醉后迅速留取脑组织,-80℃保存用于细胞因子检测及蛋白免疫印迹法(Wester blotting)检测。取大鼠新鲜脑组织50 mg,在预冷PBS(0.01 mol/L,pH=7.0~7.2)中清洗去除血液,将组织切成小块,均匀地放入放置在冰上匀浆,匀浆液4℃低温冷冻离心机10 000 r/min离心5 min,留取上清液用于检测。分别用IL-1β、TNF-α、IL-4、IL-10 ELISA试剂盒检测各个大鼠脑组织细胞因子含量,具体操作步骤按试剂盒说明进行。4)各组大鼠脑组织TLR4、NF-κB p65蛋白表达检测。取30 mg大鼠脑组织剪碎,加入适量含磷酸酶抑制剂的RIPA裂解液,置于冰上研磨,4℃低温冷冻离心机10 000 r/min离心5 min,取上层清液为蛋白提取液,用BCA蛋白定量试剂盒检测蛋白浓度。调整各样本为统一浓度,金属浴使蛋白变性。配备SDS-PAGE凝胶电泳,恒流转膜1.5 h,用5%脱脂奶粉封闭,于室温摇床封闭1.5 h,分别加入一抗(兔抗TLR4抗体1∶300;兔抗NF-κB p65抗体1∶2 000),4 ℃过夜孵育,洗膜后加入二抗(山羊抗兔IgG HRP,1∶10000),室温摇床孵育70 min,洗膜后加入超敏ECL发光液显色,于凝胶图像成像分析系统曝光5~30 s,Image J软件计算条带灰度值。
1.7 统计学处理 应用SPSS20.0统计软件。数据符合正态分布,以(±s)表示,符合方差齐性,两组对比采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经行为学评分比较 见表1。模型组及中药组大鼠表现不同程度的神经功能缺失症状,如左侧偏瘫,行走时左侧转圈,运动减少,左前爪不能完全伸展等。对各组大鼠进行Garcia评分,与假手术组相比,模型组大鼠Garcia评分显著降低(P<0.01),与模型组相比,中药组大鼠Garcia评分升高(P<0.05)。
表1 各组大鼠神经行为学评分比较(分,±s)

表1 各组大鼠神经行为学评分比较(分,±s)
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。下同。
组别假手术组模型组中药组n 14 12 13 Garcia评分17.31±0.23 6.28±2.49**8.53±1.72△
2.2 各组大鼠缺血半暗带组织形态学变化 见图1。假手术组大鼠神经元胞体及轴突排列整齐,细胞结构完整,细胞核清晰可见;模型组大鼠神经细胞可见坏死,细胞排列混乱,神经元结构不完整;中药组大鼠与模型组大鼠相比神经元凋亡情况显著改善。

图1 各组大鼠脑组织病理观察(HE染色,400倍)
2.3 各组大鼠脑梗死面积比较 见表2,图2。通过Image Pro Plus软件分析各个层面白色梗死区域的所占面积,取平均值代表大鼠梗死面积百分比。与模型组相比,中药组大鼠脑组织梗死面积显著降低(P<0.05)。
表2 各组大鼠大脑梗死面积比较(%,±s)

表2 各组大鼠大脑梗死面积比较(%,±s)
组别假手术组模型组中药组n 3 3 3脑梗死面积0 46.79±17.46 27.53±11.32△

图2 大鼠脑组织梗死情况(TTC染色)
2.4 各组大鼠脑组织炎症因子水平比较 见表3。与假手术组相比,模型组大鼠促炎性细胞因子IL-1β、TNF-α水平显著增高(P<0.01),抑炎型细胞因子IL-4、IL-10水平降低(P<0.01);与模型组相比,中药组促炎性细胞因子IL-1β、TNF-α水平显著降低(P<0.01),抑炎型细胞因子IL-4、IL-10水平显著增加(P<0.05或P<0.01)。
表3 各组大鼠脑组织炎症因子水平比较(pg/mL,±s)

表3 各组大鼠脑组织炎症因子水平比较(pg/mL,±s)
组别假手术组模型组中药组n 8 6 7 IL-1β 16.03±2.28 39.46±5.25**27.13±4.51△△TNF-α 37.24±0.28 59.11±1.45**53.40 ±0.75△△IL-4 28.21±9.83 14.00±7.66**19.50±7.81△IL-10 12.93±3.02 7.99±2.45**11.75±2.39△△
2.5 各组大鼠脑组织TLR4、NF-κB p65蛋白表达水平比较 见表4,图3。与假手术组相比,模型组大鼠TLR4、NF-κB p65表达均显著上调(P<0.01);与模型组相比,中药组大鼠TLR4表达下调(P<0.05),NF-κB p65蛋白表达显著下调(P<0.01)。
表4 各组脑组织TLR4、NF-κB p65水平比较(±s)
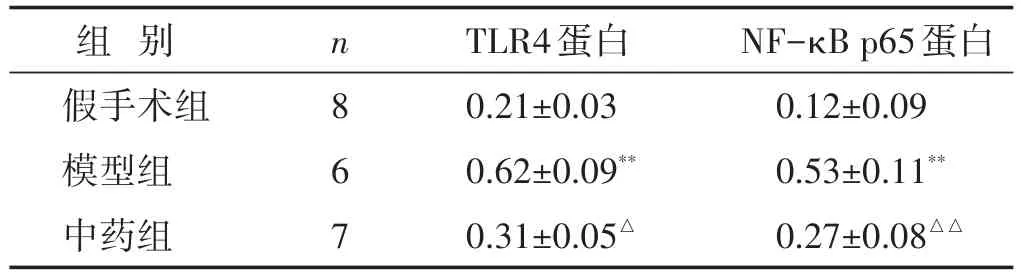
表4 各组脑组织TLR4、NF-κB p65水平比较(±s)
组别假手术组模型组中药组n 8 6 7 TLR4蛋白0.21±0.03 0.62±0.09**0.31±0.05△NF-κB p65蛋白0.12±0.09 0.53±0.11**0.27±0.08△△

图3 各组大鼠TLR4、NF-κB p65蛋白表达条带
3 讨论
炎症是脑IR/R的主要损伤机制之一[4]。在静息状态下,存在于细胞质内并处于失活状态,当脑缺血组织突然恢复血供后,细胞产生大量氧自由基,诱导TLR4激活[9],通过信号级联扩大效应激活 NF-κB,NF-κB被激活后从细胞质转移到细胞核内(尤其是p65亚单位),与相应的炎症相关基因结合,启动炎性细胞因子转录,诱发炎症。此外,活化的NF-κB还可激活小胶质细胞,同时调控其激活状态[10-11]。
小胶质细胞是中枢最主要的炎症细胞,在脑缺血后第一个做出反应[12]。小胶质细胞的活化存在于缺血性脑中风的各个阶段[13],通过释放细胞因子、趋化因子等持续影响神经功能[14-15]。研究发现,活化的小胶质细胞可以表现出损伤和保护两种截然相反的生理活性,这主要取决于小胶质细胞活化后的状态[16-17]。M1型小胶质细胞为促炎型小胶质细胞,主要产生促炎性细胞因子,如TNF-α、IL-1β、干扰素-γ(IFN-γ)、IL-6、IL-12、IL-23、诱导型一氧化氮合酶(iNOS)和蛋白水解酶(MMP9、MMP3)等,加剧组织炎性损伤[18]。M2型小胶质细胞为修复型小胶质细胞,产生促血管生成和促炎性作用的IL-4、IL-10、IL-13、转化生长因子-β(TGF-β),以及生长因子如VEGF、BDNF、血小板衍生生长因子(PDGF)等,可以减轻组织炎症,促进损伤修复[19]。NF-κB对小胶质细胞的激活主要是使小胶质细胞由静息态转化为M1型,还可以促进小胶质细胞由M2型转化为M1型,增加IL-1β、TNF-α、IL-6和IL-8等促炎症因子释放,引起组织广泛而又持续的炎性损伤[20]。
实验研究证实,抑制TLR4/NF-κB信号通路,可以减轻脑组织炎性损伤,预防脑IR/R[21-22]。综上所述,抑制TLR4/NF-κB信号通路,促进小胶质细胞M1/M2转化,可以减少促炎性细胞因子水平,增加抑炎性细胞因子水平,恢复脑组织免疫稳态,可减少脑组织IR/R损伤。在本研究中发现,三七总皂苷可显著缩小MCAO模型大鼠脑梗死面积,改善大鼠神经元损伤,改善大鼠神经功能缺损症状,这与既往的研究结果相同,再次印证了三七总皂苷对脑IR/R的保护作用。其机制可能与下调大鼠TLR4/NF-κB炎性信号通路,促进小胶质细胞由M2型向M1型转化,进而减少M1型小胶质细胞IL-1β、TNF-α表达,增加M2型小胶质细胞IL-4、IL-10表达,减轻组织炎性损伤相关。
