基于神经血管单元各组成部分保护作用的中药抗缺血性脑卒中的研究进展
2021-09-06孟庆琦
孟庆琦,米 妍,侯 悦
基于神经血管单元各组成部分保护作用的中药抗缺血性脑卒中的研究进展
孟庆琦,米 妍,侯 悦*
东北大学生命科学与健康学院,辽宁 沈阳 110169
脑卒中是一种具有极高致死率的脑血管疾病,严重影响着人们的健康和生活。随着神经血管单元概念的提出,脑卒中的治疗从单一的神经元保护转变为对神经血管单元各组成部分的保护。中药具有多成分、多途径、多靶点等特点,在脑卒中治疗中受到广泛关注。中医认为,脑卒中的发病因素与“风”“痰”“瘀”“火”“气”“虚”密切相关,其中“虚”“瘀”“痰”贯穿脑卒中发生发展的始终。研究表明,从“虚”“瘀”“痰”论治的中药在脑卒中治疗中发挥着重要作用。综述了中药对缺血性卒中后神经血管单元各组成部分的保护作用。
中药;脑卒中;神经元细胞;胶质细胞;血管细胞
脑卒中是一种具有极高致死率及致残率的脑血管疾病,据调查显示,2016年全球共有8010万例脑卒中病例,其中包括1370万新增病例及550万例死亡病例[1];此外,1990—2016年脑卒中伤残调整寿命年(disability-adjusted life-years,DALYs)呈现上升趋势[1];脑卒中也是我国成年人致死、致残的主要病因,根据我国一项调查显示,2017年中国约有196万人死于脑卒中,2005—2016年我国脑卒中的DALYs也呈现明显上升趋势[2]。脑卒中的高致残率、高致死率等特点严重影响了人口的平均寿命,为家庭和社会带来了沉重的经济负担,因此寻找安全有效的治疗手段得到了广泛关注。《中国急性缺血性脑卒中诊治指南(2018)》中指出脑卒中的治疗方式主要包括改善脑血循环、使用他汀类药物及神经保护类药物等方法,但目前的治疗手段仍有诸多缺点和禁忌,如阿替普酶溶栓治疗仍存在出血风险以及因血管源性水肿引起呼吸道梗阻等缺点;而血管形成术临床安全性与有效性尚不明确[3]。
脑卒中发病机制复杂为寻找安全有效的治疗药物带来了困难。2003年神经血管单元(neurovascularunit,NVU)概念的提出使得脑卒中的治疗从单一的神经元保护转变为NVU各组成部分的保护。中药具有多成分、多途径、多靶点、药效持久以及不易产生耐药等特点。《中国急性缺血性脑卒中诊治指南(2018)》中指出中药治疗脑卒中的可行性。中药的独特治疗优势也与从NVU角度治疗脑卒中的策略相吻合。NVU由多种细胞构成,各组成组分之间相互联系及相互影响,在缺血性脑卒中发病过程中发挥重要作用。但目前将NVU各组成部分作为整体探究中药抗缺血性脑卒中作用的研究较少。大多数的研究仅关注到中药对其中某1类细胞或某2类细胞的保护作用。因此本文主要从“虚”“瘀”“痰”3个角度探讨中药在治疗脑卒中过程中对NVU各组成部分的影响,以此发掘中药对于NVU整体保护的潜力。
1 概述
1.1 从“虚”“瘀”“痰”中医角度阐述缺血性脑卒中的病机
中医认为中风(卒中)以肝肾阴虚为本,继而气血逆乱,阴阳失衡,上犯于脑而发为中风,病因以内伤积损为主,病机关键为风、火、痰、瘀、气、虚六端,且此六端常相互影响,合而为病。其中虚、瘀、痰贯穿本病始终,针对虚、瘀、痰逐渐形成了痰热腑实论、气虚血瘀论、痰瘀互阻学说、“痰致中风”学说及“内虚邪中”学说等论断[4]。
“虚”分为“气虚”“血虚”“阴虚”以及“阳虚”,在脑卒中发病机制中以“内虚邪中”学说和“气虚血瘀论”为代表,阐述了“虚”在脑卒中发生发展中的作用。所谓“内虚”主要指“肝肾亏虚”。中医认为,由于肝肾亏虚所致风、痰、瘀、火四邪潜伏于脑髓影响着患者的病情。因此针对“肝肾亏虚”,中医常选用具有“补益肝肾”作用的中药进行治疗[5]。“气虚”主要与肺、脾、肾等脏器的损伤有关,针对“气虚”,常选用补气、益气的中药。
《素问》中记载到“血苑于上,使人薄厥”而“瘀”常和“痰”相伴而生。《血证论》中指出“痰”和“瘀”既可以“共患”,也可以相互转化。现代中医也多从血瘀的角度来治疗中风,谭峰认为瘀血存在于中风发生发展的各个时期[6];刘冬立提出气滞血瘀是造成心脑血管及老年病的常见原因[7]。此外,大量实验证实,血瘀是中风发病过程中的重要病机,采用活血化瘀药治疗中风取得了良好的效果。
“痰致中风”是中风发病机制的一个重要学说,朱丹溪提出“半身不遂,大率多痰”,中医认为“痰证”贯穿中风发生发展的各个时期,在中风的治疗上多强调“治痰为先,次养血行血”[8]。因此,针对“痰致中风”理论多选用具有化痰、祛痰作用的中药进行辨证治疗。
1.2 神经血管单元
NVU由神经元、胶质细胞(小胶质细胞、星形胶质细胞、少突胶质细胞)、血管细胞(血管内皮细胞、血管周细胞、平滑肌细胞)以及脑脉管系统内的基底膜基质组成[9];其中血管内皮细胞、周细胞和星形胶质细胞终足构成了血脑屏障(blood brain barrier,BBB)维持中枢系统稳态。大脑的正常功能依赖于NVU各组成部分之间的相互作用[9]。神经元细胞是最容易受到脑缺血再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)的细胞类型,且持续受到CIRI后炎症反应、兴奋性氨基酸毒性、氧化应激等病理反应的影响。胶质细胞主要包括少突胶质细胞、小胶质细胞及星形胶质细胞,其中星形胶质细胞发挥着双重作用,在生理状态下,星形胶质细胞通过释放多种神经营养因子,修复神经元和血管细胞损伤;此外,星形胶质细胞上存在广泛的缝隙链接,生理状态下营养物质可以通过缝隙链接传递,脑缺血状态下导致细胞内钙泵、钠泵失调,同时造成缝隙链接被破坏,Ca2+及有毒物质迅速传递,造成星形胶质细胞释放大量的谷氨酸加重兴奋性氨基酸毒性。另一方面,星形胶质细胞在缺血急性期会被过度活化,过度活化的星形胶质细胞形成胶质瘢痕阻碍神经元细胞的修复[10]。小胶质细胞是脑内固有的免疫细胞,脑缺血发生后小胶质细胞会出现短暂的M2型极化后转为M1型极化释放大量的炎症因子,大量积累的炎症因子不但会破坏神经元的正常功能还会损伤血管内皮细胞破坏BBB结构加重脑水肿。血管细胞是NVU的重要组成部分,在脑缺血发生后血管细胞极易受到氧自由基、炎症因子等因素的损伤导致脑血管血液流量变化,破坏BBB完整性,改变血管收缩的协调性加重脑损伤。
现代中医认为中风病位在脑,与肝、肾、胃、脾关系密切,“虚”“瘀”“痰”互结贯穿于发病始终,在调节NVU功能结构过程中交叉重叠。本文从“虚”“瘀”“痰”3个方面论述了发挥NVU保护作用的治疗药物。
2 中药对NVU的保护作用
2.1 从“虚”论治
2.1.1 单味中药 淫羊藿是常用的补阳类中药,性温,味辛、甘,归于肝、肾二经,有补肾阳、强筋骨、祛风湿之功效。现代药理学研究表明,淫羊藿提取物可以显著改善脑血流量,改善脑缺血再灌注后神经细胞凋亡。BBB作为NVU的重要构成,在保持中枢神经系统的代谢稳态方面发挥重要作用。脑缺血再灌注后BBB被破坏,加重脑梗死和脑水肿,并导致严重的出血转化。Liu等[11]发现,淫羊藿提取物淫羊藿苷Ⅱ可以通过调节基质金属蛋白酶9/组织金属蛋白酶抑制物1平衡,抑制天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase 3,Caspase-3)依赖性细胞凋亡途径改善BBB通透性抑制神经元凋亡,发挥抗CIRI作用。高琛等[12]研究表明淫羊藿苷改善BBB通透性和神经功能损伤的机制与下调水平、激活Notch/核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)轴相关。实验显示,淫羊藿提取物不仅可以改善BBB通透性,还可以改善神经元损伤。Gao等[13]发现淫羊藿苷Ⅱ可以通过抑制磷酸二酯酶-5表达、激活环磷酸鸟苷酸依赖性蛋白激酶/环磷腺苷效应元件结合蛋白/脑源性神经营养因子(brain derived neurotrophic factor,BDNF)/络氨酸激酶受体B信号通路改善缺氧缺糖(oxygen-glucose deprivation/ recovery,OGD/R)诱导的海马神经元损伤。唐冰雪等[14]发现淫羊藿苷可以通过调控小胶质细胞的活化,阻断Toll样受体4(Toll-like receptor 4,TLR4)/核转录因子-κB(nuclear factor-κB,NF-κB)信号通路,抑制白细胞介素-1α、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子表达,发挥卒中后的脑保护作用。
天麻是一味传统中药,《本草纲目》中记载“天麻,乃干净气分之药”,可以用来改善肝经风虚。现代药理学发现,天麻可以通过改善氧化应激水平,抑制炎症水平以及抗血小板聚集等作用改善CIRI。胶质细胞在NVU中主要发挥防止神经元与血管细胞直接接触,缓冲血液物质冲击的作用。生理状态下星形胶质细胞作为一个桥梁,允许神经元-神经胶质细胞相互作用,并将NVU的神经胶质部分与血管部分联系起来,缺糖缺氧状态导致星形胶质细胞功能破坏并发生凋亡,进一步加重脑损伤[9]。黄春华等[15]通过构建OGD/R模型发现,天麻提取物天麻素可以通过调节氧化水平抑制星形胶质细胞的凋亡;此外,天麻素的星形胶质细胞保护作用在环境污染和及蛛网膜下腔出血造成的神经损伤中得到证实[16-17]。少突胶质细胞产生富含脂质的髓鞘来包裹轴突并加速冲动传导,是缺血性脑卒中后促进髓鞘修复的重要细胞。实验发现,天麻素可以显著改善OGD/R处理后少突胶质细胞凋亡情况[18]。小胶质细胞具有病原体识别和吞噬功能,是中枢神经系统的第一道防线。脑缺血再灌注后小胶质细胞活化释放大量的炎症因子,实验证明,天麻素可以显著抑制OGD/R后小胶质细胞的活化,缓解炎症反应[19]。此外,天麻素在治疗CIRI过程中也发挥了改善BBB损伤和神经元保护的作用[19]。除上述中药外,地黄[20-21]、钩藤[22]及枸杞[23]等单味中药也被证实有改善CIRI损伤的功效。
2.1.2 中药药对 红花-黄芪的使用常见于治疗气虚血瘀证的方剂中,具有补气活血、痛经止痛的功效。红花-黄芪可通过抗炎、抗氧化、促进血管新生等方式发挥抗CIRI作用。中枢神经系统对能源需求巨大,但其储能能力相当有限,因此需要充足的血液供给,脑缺血再灌注损伤会损伤NVU结构,破坏其精确调节脑血流量和能量供应的作用。曹金一等[24]实验发现不同比例的黄芪红花均可以改善大脑中动脉阻塞再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)大鼠的脑损伤水平,其机制可能与调节小凹蛋白1/血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路促进血管新生有关,且结果显示黄芪与红花最佳的配伍比例为5∶1。许航等[25]用黄芪活性成分黄芪甲苷与红花活性成分红花黄色素A联合治疗大鼠脑缺血再灌注损伤,实验结果显示,二者配伍可以促进血管新生,其可能机制与CD31+细胞水平有关,CD31是一种细胞表面的抗原且广泛存在于造血祖细胞表面,在脑缺血条件下,CD31+细胞可以迁移至损伤区域,促进血管新生,黄芪甲苷和红花黄色素A配伍后可以进一步上调CD31+细胞水平;此外,实验结果同样显示二者配伍后可以发挥抗炎和抗氧化的作用。
黄芪与三七配伍后具有益气活血的作用,研究发现黄芪与三七配伍可通过抑制炎症反应、维持BBB的稳定性、抑制血管内皮细胞凋亡等方式发挥对脑血管疾病的治疗作用。徐思思等[26]构建了MCAO/R大鼠模型探索黄芪和三七配伍后改善CIRI的作用,实验结果显示二者配伍后可以抑制NF-κB和TNF-α的表达水平,减缓炎症水平进而改善神经元损伤;同样二者配伍后可以通过抑制基质金属蛋白酶9表达水平,改善BBB通透性,发挥治疗效果。刘晓丹等[27]选取黄芪活性成分黄芪甲苷和三七活性成分三七总皂苷为实验对象,考察黄芪甲苷和三七总皂苷联合使用的抗CIRI作用;结果显示该药对能够较好地抑制OGD/R处理后大鼠脑微血管内皮细胞凋亡、促进内皮细胞增殖,其可能机制与改善线粒体损伤有关。
2.1.3 中药复方 《黄帝素问宣明方》首次记载了由熟地黄、巴戟天、山茱萸等12味中药组成的地黄饮子。中医认为地黄饮子具有补肾阳、滋肾阴、化痰开窍的功效。地黄饮子治疗缺血性脑卒中的作用机制包括改善炎症反应、改善神经元损伤和促进血管新生等。宫健伟[28]实验发现,地黄饮子通过增加MCAO/R大鼠脑组织VEGF的释放和表达,促进大脑缺血区新血管形成,改善脑缺血损伤。李丽娅等[29]实验发现,地黄饮子可以使大鼠颅内血管直径增宽;改善大鼠脑组织神经元形态,调节炎症因子表达水平,抑制炎症反应,减轻脑组织损伤。王俊杰等[30]构建了MCAO/R大鼠,其HE染色实验显示不同剂量地黄饮子可以促进神经元细胞和胶质细胞的增殖,改善脑损伤,其保护作用与Notch信号通路的激活有关。此外,传统药方补阳还五汤[31-35]以及中药制剂首乌益智胶囊[36]也发挥了NVU保护的作用。
从“虚”论治的单味中药和中药复方见表1。

表1 从“虚”论治NVU的中药
综上所述,具有“补益肝肾”和“补气、益气”作用的中药均能显著改善脑缺血再灌注损伤,其可能与改善神经元细胞及星形胶质细胞凋亡及氧化应激水平,促进血管新生,抑制小胶质细胞活化,改善BBB通透性有关。
2.2 从“瘀”论治
2.2.1 单味中药 丹参具有活血化瘀的功效,其根部为主要的入药部位。丹参及其活性成分可以通过抑制细胞凋亡、改善BBB通透性,抑制小胶质细胞活化等作用保护NVU免受CIRI。Zhao等[37]建立OGD/R NVU模型,发现丹参中的有效成分隐丹参酮可以通过抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,下调凋亡相关蛋白表达,维持脑微血管内皮细胞紧密连接蛋白的表达,发挥抗凋亡及BBB保护的作用。脑卒中状态下,氧自由基清除酶活性下降,氧自由基增多会造成脑内氧化损伤,神经元细胞是脑内最易受氧化应激损伤的细胞,体内外的实验显示丹参活性成分可以发挥抗氧化、抑制神经元细胞凋亡及神经元过度自噬的作用,其可能机制与激活磷脂酰肌醇激酶/蛋白激酶B/雷帕霉素靶蛋白信号通路及抑制神经元细胞中c-Jun氨基末端激酶/MAPK的磷酸化等途径有关[38-39]。文献报道,丹参提取物还可以通过抑制TLR4/NF-κB信号通路改善内皮细胞炎症反应[40]。
红花是活血化瘀常用中药,《伤寒论》等论著中提到其具有活血通经、散瘀止痛的功效。近年来研究发现,红花及其有效成分具有改善脑缺血损伤、抑制氧化应激反应、改善血小板聚集等作用[41]。文献报道,红花中的红花黄色素A有较好的抗CIRI作用,其可能与改善脑血管通透性、抑制神经炎症、改善神经元坏死有关。Sun等[42]发现,羟红花黄色素A通过扩张脑血管,改善脑血管通透性降低MCAO/R大鼠脑梗死面积,预防CIRI。研究显示,红花黄色素能通过调节沉默信息调节因子2相关酶1-HIF-1-VEGF信号通路,促进血管内皮细胞新生发挥抗CIRI的作用[43]。此外,文献报道了羟基红花黄色素可以通过抑制凋亡相关蛋白表达,上调抗氧化酶活性,改善星形胶质细胞氧化损伤;通过下调外周血中炎症因子表达水平,改善神经元损伤及神经胶质细胞损伤;通过调节沉默信息调节因子-1活性抑制小胶质细胞活化,改善神经炎症;通过抑制-甲基--天冬氨酸型谷氨酸受体过度活化,保护神经元免受兴奋氨基酸毒性[44-47]。除上述中药外,川芎[48-49]、三七[50-51]及当归[52]也被报道有保护NVU各组成部分的作用。
2.2.2 中药药对 丹参和红花是2味常用的活血化瘀类药物,两者的配伍多在心血管疾病中应用,也是丹红化瘀口服液、心宁片、白癜风胶囊等药物中的常见药对,是中医临床常用的经典药对之一[53]。现代药理学研究发现,丹参和红花配伍后可达到协同效果,使药物的有效成分更好地发挥作用。研究显示,丹参-红花可以明显抑制脑缺血后神经元尼氏小体的消失,改善神经损伤,其可能机制与调节氧化应激水平,抑制炎症因子表达,上调脑源性神经营养因子、胶质细胞源性神经营养因子表达以及改善内质网应激有关[54-56]。Xu等[57]通过实验发现,丹参素和红花提取物联合使用的治疗效果比单独使用的效果更好;此外,免疫印迹分析结果发现丹参素和红花提取物可以协同调节TLR4/NF-κB通路和Nrf2/血红素氧化酶1(heme oxygenase-1,HO-1)通路而发挥抗炎和抗氧化的作用,进而抑制神经元细胞凋亡发挥抗CIRI损伤的作用。
川芎-赤芍是治疗血瘀证的常用药对,《医林改错》的“五逐瘀汤”除身痛逐瘀汤外,均以川芎、赤芍为基础药物发挥活血化瘀作用[58]。研究发现川芎-赤芍能够发挥改善脑血流量,抑制内皮损伤,促进脑组织及神经修复等作用[58]。褚丽[59]研究发现川芎-赤芍可以通过提高神经生长因子、血小板衍生生长因子的水平改善神经元缺血损伤;上调脑源性神经营养因子、转化生长因子的表达促进神经细胞增殖以发挥神经保护的作用。Wang等[60]利用网络药理学方法预测出川芎-赤芍具有抗血栓、抗高血压、预防缺血性脑卒中的作用,且预测到雌激素受体α和HIF-1是最重要的潜在蛋白质靶标;体内水平结果表明,川芎-赤芍可能通过调节雌激素受体α信号通路促进斑马鱼血管生成。除上述药对外,灯盏细辛-赤芍[61-62]、人参-三七[63]及丹参-川芎[64]均具有抗CIRI作用。
2.2.3 中药复方 通心络是一种常被用作治疗缺血性心脑血管疾病的中药制剂,其全方由人参、赤芍、冰片等药材组成,具有益气活血的功效[65]。众多临床数据显示,通心络可以调节脑卒中患者血脂水平、改善患者日常生活能力[66-67]。在对其治疗机制的探讨过程中,人们发现通心络主要在血管保护和神经保护2个方面发挥了重要的作用[65]。通心络通过维持间隙连接发挥血管保护的作用;间隙连接是一种特殊的连接结构,在大脑中,间隙连接参与了神经元之间的信号传递,以及神经胶质细胞之间化学信号和代谢物的传递,支持NVU的功能。Cheng等[68]发现,通心络在治疗MCAO/R大鼠时可以显著上调连接蛋白43(connexin 43,Cx43)表达,降低缺血半暗带中钙蛋白酶Ⅱ、Bcl-2相关X的蛋白质(Bcl-2-associated X,Bax)和Caspase-3的表达,推测通心络可能通过调节Cx43/钙蛋白酶II/Bax/Caspase-3通路改善细胞间隙连接,恢复NVU正常功能发挥抗CIRI作用。此外,有研究结果证明通心络能够发挥神经保护的作用;Yu[69]等研究表明通心络可能通过影响酪氨酸激酶受体1/2/丝裂原活化蛋白激酶1/2/p90核糖体S6激酶通路改善脑缺血再灌注大鼠神经功能,减轻BBB超微结构损伤,抑制神经炎症。此外,血府逐瘀汤[70-73]及脉络宁[74-75]均具有改善NVU损伤的作用。
从“瘀”论治的单味中药、药对和中药复方见表2。
综上所述,具有活血化瘀作用的中药广泛应用于缺血性脑卒中的治疗中,其发挥作用的可能机制与促进血管新生及修复、调节星形胶质细胞谷氨酸转运能力、改善神经元细胞凋亡及氧化应激水平,抑制脑内炎症水平有关。
2.3 从“痰”论治
2.3.1 单味中药 大黄是一种常用的中药,在《别录》等论著中记载具有下气、除痰实的作用。研究表明,大黄可以通过抑制小胶质细胞活化、促进血管内皮细胞再生、抑制星形胶质细胞过度增殖、改善神经元细胞氧化损伤等途径保护NVU免受CIRI。文献报道了大黄酚[76]和大黄素[77]的神经保护作用可能与抑制神经元凋亡,促进神经元修复,抑制NF-κB信号通路,改善抗氧化酶活性等方式有关。研究发现,大黄酚可以通过调节胶质纤维酸性蛋白和Cx43的表达水平,改善星形胶质细胞异常活化[78]。此外,大黄提取物还可以通过调节TLR4/NF-κB、Notch等信号通路调节小胶质细胞活化水平;通过下调水通道蛋白-4表达水平改善BBB通透性,减轻脑水肿及神经炎症,发挥改善CIRI的作用[79-80]。

表2 从“瘀”论治NVU的中药
败酱草具有清热解毒、祛痰排脓的功效。研究发现,败酱草的主要药理作用包括调节氧化应激水平、抑制炎症、镇静等,临床应用十分广泛[81]。魏珍珍等[82]为探讨败酱草提取物的神经保护作用,构建了MCAO/R大鼠,发现模型组大鼠脑内出现大范围的神经元坏死以及炎症因子表达水平升高的现象,过度积累的炎症因子造成内皮细胞损伤并破坏BBB结构,加重脑水肿;而败酱有效成分通过降低细胞间黏附分子-1的表达,抑制脑组织NF-κB p65表达,上调MCAO/R大鼠脑内神经营养因子表达,以改善大脑皮层神经元坏死并抑制炎症反应。缺血引起的能量代谢障碍是导致神经元损伤的重要因素,方晓艳等[83]通过构建局灶性脑缺血模型证明了败酱总黄酮可以升高脑组织内ATP酶的水平,改善脑内能量代谢,减轻神经元损伤。此外,结果显示,败酱总黄酮通过下调MCAO/R大鼠脑内脂过氧化物产物丙二醛的含量,上调超氧化物歧化酶(superoxide dismutase,SOD)水平,平衡MCAO/R大鼠脑内氧化还原状态。除上述中药外,百合科的贝母[84-85]、芸香科的化橘红[86-87]等药物在治疗CIRI过程中发挥了重要作用。
2.3.2 中药复方 侯氏黑散出自《金匮要略·中风历节篇》,是张仲景治疗中风的第一方剂,全方由菊花、白术、青防风等14味中药组成,具有祛风化痰、益气和营的作用。王璇等[88]采用网络药理学预测侯氏黑散发挥作用的可能机制,结果显示侯氏黑散抗CIRI的靶点主要富集在HIF-1/VEGF、AGE-RAGE等信号通路,并推测侯氏黑散可能在改善炎症反应、促进血管新生、调节氧化平衡等方面发挥作用。相阳阳等[89]发现,侯氏黑散可以通过下调磷脂酶Cγ2表达并上调ERK磷酸化水平促进OGD/R后内皮细胞增殖;通过调节转化生长因子β/Sma和Mad相关蛋白2/3信号通路促进血管新生发挥抗CIRI的作用。常佳慧等[90]选取侯氏黑散中的绿原酸、木犀草素、人参皂苷Rg1为研究对象,考察侯氏黑散的抗CIRI作用。研究结果显示,该药能够调节小胶质细胞BV2的活化状态、平衡促炎因子和抗炎因子的水平,推测侯氏黑散可以通过调节NF-κB信号通路改善缺血缺氧后炎症反应。此外,安脑片[91]、化痰通络方[92]及星蒌承气汤[93]都具有改善CIRI的潜力。
从“痰”论治的单味中药和中药复方见表3。

表3 从“痰”论治NVU的中药
综上所述,具有化痰、祛痰的药物在治疗脑缺血再灌注损伤方面发挥了降低神经元细胞凋亡、抑制星形胶质细胞及小胶质细胞活化状态、改善BBB通透性、促进血管新生等作用。
3 结语与展望
随着NVU概念的提出,研究学者开始从多途径、多角度思考治疗CIRI的可行手段,对此中药的特点决定了其在保护NVU完整性上发挥着重要的作用。但目前针对NVU整体保护的研究较少,大多数的研究仅关注到中药对某1类细胞或某2类细胞的保护作用[49],这限制了阐明中药对NVU整体的保护作用。通过整理发现,中药及其活性成分对NVU多种组成部分均具有保护作用,如改善神经元损伤、抑制神经炎症、促进血管内皮细胞新生、修复BBB损伤、改善星形胶质细胞活化状态等,这表明中药具有保护NVU整体免受CIRI损伤的潜力(图1)。
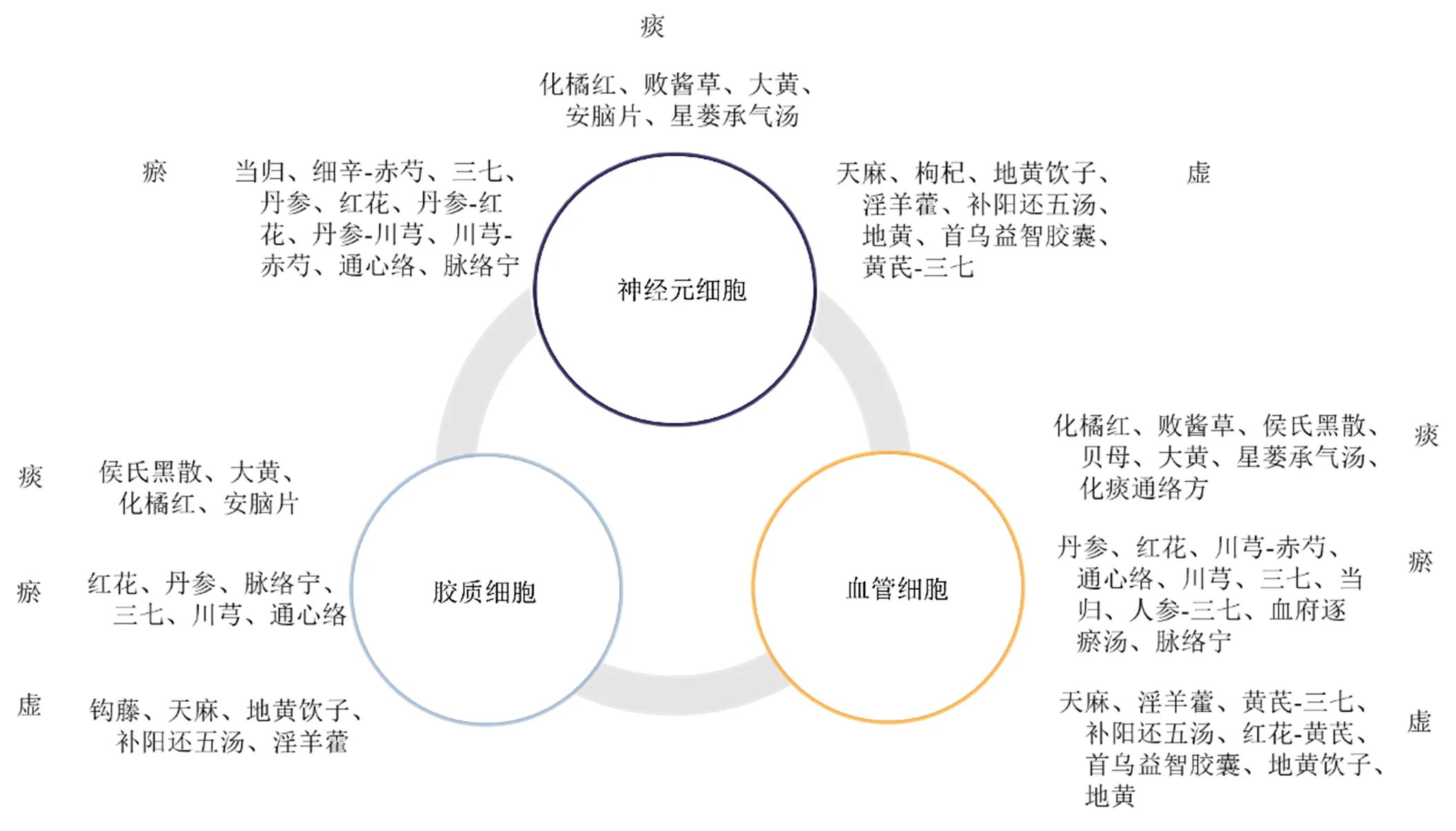
图1 从“虚”“瘀”“痰”论治的中药对NVU的保护作用
“虚”“瘀”“痰”3个病机在脑卒中发生发展中相互缠结形成不同的证型,因此中医常选用具有补肝益肾、补气、益气、活血化瘀及化痰通络等作用的药物辨证治疗。“肝肾亏虚”是本病的发病之根本,贯穿于脑卒中发病始终,针对“虚”提出了“补益肝肾”的治则;脑缺血后脑内血流状态发生改变,形成阻塞,而血瘀理论基于此提出“活血化瘀”的治则;中医认为,缺血急性期会出现痰热实邪阻滞的现象,导致血瘀加重若不及时消除痰热则会加重脑卒中的病情,基于此提出“化痰通络”“熄风化痰”等治则。经归纳整理发现这些药物均可以改善神经炎症、调节氧化应激损伤以及抑制神经细胞凋亡进而改善脑水肿,恢复神经功能;其中从“虚”论治的药物主要以恢复胶质细胞正常功能,促进血管新生为主;从“瘀”论治的中药主要发挥了促进血管新生和修复,改善BBB通透性的作用;而从“痰”论治的药物则主要改善胶质细胞的活化状态,减少缺血后炎症因子、谷氨酸及氧自由基的扩散。
中医药作为我国的传统治疗手段,在抗CIRI上发挥了重要作用。中药具有多靶点、多途径、毒副作用小的特点,是相对西药治疗的优势之一,但由于中药种类多且成分相对复杂,不同中药发挥药效的作用机制有待于深入探究。相信随着进一步的研究,中药在治疗脑缺血上的作用机制会逐渐得以深入阐明,并指导其在临床治疗方面的科学应用。
利益冲突 所有作者均声明不存在利益冲突
[1] GBD 2016 Stroke Collaborators. Global, regional, and national burden of stroke, 1990-2016: A systematic analysis for the Global Burden of Disease Study 2016 [J]., 2019, 18(5): 439-458.
[2] 王陇德, 刘建民, 杨弋, 等. 我国脑卒中防治仍面临巨大挑战: 《中国脑卒中防治报告2018》概要 [J]. 中国循环杂志, 2019, 34(2): 105-119.
[3] 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2018 [J]. 中华神经科杂志, 2018, 51(9): 666-682.
[4] 刘楠茜. 益气活血法对脑梗死急性期(气虚血瘀证)的临床疗效观察 [D]. 南宁: 广西中医药大学, 2018.
[5] 喻远霞, 余桂枝, 张稳, 等. 王行宽教授辨治缺血性脑卒中恢复期经验 [J]. 中国中医药现代远程教育, 2021, 19(7): 76-78.
[6] 陈嘉慧, 陈文霖, 霍绮雯, 等. 谭峰教授缺血性中风早期运用活血化瘀药治疗经验 [J]. 中国中医急症, 2018, 27(6): 1091-1093.
[7] 付海涛, 程皓, 孟湧生, 等. 刘冬立教授从气血论治缺血性中风病经验总结 [J]. 陕西中医, 2019, 40(2): 257-259.
[8] 黄仟. 缺血性中风不同分期痰证诊断标准的临床观察 [D]. 北京: 北京中医药大学, 2019.
[9] Cai W, Zhang K, Li P Y,. Dysfunction of the neurovascular unit in ischemic stroke and neurodegenerative diseases: An aging effect [J]., 2017, 34: 77-87.
[10] 梁萍, 蒙兰青, 黄清, 等. 缺血性脑卒中神经血管单元分子靶点的研究进展 [J]. 右江民族医学院学报, 2019, 41(5): 568-571.
[11] Liu M B, Wang W, Gao J M,. Icariside II attenuates cerebral ischemia/reperfusion-induced blood-brain barrier dysfunction in rats via regulating the balance of MMP9/TIMP1 [J]., 2020, 41(12): 1547-1556.
[12] 高琛, 支应鹏. 淫羊藿次苷II调节miR-141-3p/ Notch/Nrf2轴对局灶性脑缺血模型大鼠神经功能的改善作用研究 [J]. 中国药房, 2020, 31(19): 2386-2391.
[13] Gao J M, Long L, Xu F,. Icariside II, a phosphodiesterase 5 inhibitor, attenuates cerebral ischaemia/reperfusion injury by inhibiting glycogen synthase kinase-3β-mediated activation of autophagy [J]., 2020, 177(6): 1434-1452.
[14] 唐冰雪, 张源文, 吴雅晨, 等. 淫羊藿苷对脑缺血再灌注大鼠的神经保护及小胶质细胞TLR4/NF-κB通路的影响 [J]. 中国实验方剂学杂志, 2020, 26(22): 47-52.
[15] 黄春华, 韦玲芝, 钟良, 等. 天麻素对缺氧缺糖星形胶质细胞氧化损伤的影响 [J]. 中国老年学杂志, 2019, 39(9): 2211-2215.
[16] Jiao M, Yin K, Zhang T,. Effect of the SSeCKS-TRAF6interaction on gastrodin-mediated protection against 2,3,7,8-tetrachlorodibenzo--dioxin-induced astrocyte activation and neuronal death [J]., 2019, 226: 678-686.
[17] Wang X, Li S, Ma J,. Effect of gastrodin on early brain injury and neurological outcome after subarachnoid hemorrhage in rats [J]., 2019, 35(3): 461-470.
[18] 郭艳吉, 郭家智, 钟莲梅, 等. 天麻素对氧糖剥夺模型中小鼠少突胶质前体细胞的保护作用 [J]. 神经解剖学杂志, 2019, 35(6): 599-605.
[19] Li S, Bian L, Fu X,. Gastrodin pretreatment alleviates rat brain injury caused by cerebral ischemic-reperfusion [J]., 2019, 1712: 207-216.
[20] Wang H, Xu X, Yin Y,. Catalpol protects vascular structure and promotes angiogenesis in cerebral ischemic rats by targeting HIF-1α/VEGF [J]., 2020, 78: 153300.
[21] 张一帆. 地黄苦苷对MCAO所致大鼠缺血再灌注损伤的影响及机制探究 [D]. 广州: 广州中医药大学, 2020.
[22] 李凤萍. 钩藤碱对氧糖剥夺星形胶质细胞HMGB1和CDK5 mRNA表达的影响 [D]. 南昌: 南昌大学, 2020.
[23] 马琳, 马然, 王艺, 等. 枸杞多糖对小鼠海马神经元细胞系缺糖缺氧再灌注损伤的影响 [J]. 中国新药杂志, 2018, 27(10): 1172-1175.
[24] 曹金一, 雷露, 段佳林, 等. 黄芪红花配伍对大鼠脑缺血后血管新生及Cav-1/VEGF信号通路的影响 [J]. 现代生物医学进展, 2019, 19(6): 1016-1019.
[25] 许航, 丁一, 刘文星, 等. 黄芪甲苷和羟基红花黄色素A配伍抗脑缺血再灌注损伤的协同作用及机制研究 [J]. 中华神经外科疾病研究杂志, 2017, 16(5): 427-431.
[26] 徐思思, 王本国, 刘星辰, 等. 黄芪三七药对抑制炎症级联反应减轻大鼠脑缺血再灌注损伤的机制研究 [J]. 广州中医药大学学报, 2021, 38(3): 576-582.
[27] 刘晓丹, 杨筱倩, 唐三, 等. 冰片对黄芪甲苷和三七总皂苷配伍有效成分在脑缺血/再灌注模型大鼠脑组织分布的影响 [J]. 中草药, 2019, 50(7): 1649-1656.
[28] 宫健伟. 地黄饮子对实验性脑缺血再灌注模型大鼠脑组织损伤的保护作用机制研究 [D]. 南京: 南京中医药大学, 2013.
[29] 李丽娅, 刘昊, 王超云, 等. 地黄饮子对大鼠脑缺血再灌注后炎症反应的抑制作用 [J]. 中药新药与临床药理, 2021, 32(1): 23-28.
[30] 王俊杰, 楼琦, 汤娟娟, 等. 地黄饮子对脑缺血再灌注损伤大鼠保护作用及其机制 [J]. 中国实验方剂学杂志, 2019, 25(4): 42-48.
[31] 李志威. 补阳还五汤及其类方抗脑缺血再灌注损伤作用及促血管新生的机制研究 [D]. 杭州: 浙江中医药大学, 2020.
[32] 诸葛陆杰, 方燕, 金华倩, 等. 补阳还五汤上调miR-199a-5p表达促进脑缺血大鼠神经发生和血管生成 [J]. 浙江大学学报: 医学版, 2020, 49(6): 687-696.
[33] 邵乐, 夏相宜, 王宇红, 等. 补阳还五汤精简方对氧化应激损伤血管内皮细胞的保护作用研究 [J]. 湖南中医药大学学报, 2019, 39(2): 163-167.
[34] 刘芳, 朱炎贞, 赵冯岩, 等. 补阳还五汤类方提取物对PC12细胞氧化应激损伤模型凋亡与自噬的调控 [J]. 中草药, 2020, 51(20): 5228-5236.
[35] 董志强, 向庆伟, 陈延. 补阳还五汤对TLR4介导脑缺血大鼠海马炎症损伤的作用 [J]. 现代中西医结合杂志, 2019, 28(34): 3777-3781,3876.
[36] Yang X N, Li C S, Chen C,. Protective effect of Shouwu Yizhi decoction against vascular dementia by promoting angiogenesis [J]., 2017, 15(10): 740-750.
[37] Zhao H, Zheng T, Yang X,. Cryptotanshinone attenuates oxygen-glucose deprivation/ recovery-induced injury in anmodel of neurovascular unit [J]., 2019, 10: 381.
[38] Zhu Y C, Tang Q Q, Wang G P,. Tanshinone IIAprotects hippocampal neuronal cells from reactive oxygen species through changes in autophagy and activation of phosphatidylinositol 3-kinase, protein kinas B, and mechanistic target of rapamycin pathways [J]., 2017, 14(2): 132-140.
[39] 郝红, 李方, 王志, 等. 隐丹参酮对脑缺血再灌注损伤神经元细胞凋亡的作用 [J]. 中国临床药理学杂志, 2021, 37(3): 250-254.
[40] 杨华, 何强华, 张爱华, 等. 丹参酮IIA通过抑制TLR4/ NF-κB途径减轻糖氧剥夺对大鼠脑微血管内皮细胞的炎症损伤 [J]. 中国临床神经外科杂志, 2020, 25(9): 610-612.
[41] 袁琴琴, 刘文营. 红花生物活性成分及功能特性研究进展 [J]. 食品工业科技, 2020, 41(3): 332-338.
[42] Sun Y, Xu D P, Qin Z,. Protective cerebrovascular effects of hydroxysafflor yellow A (HSYA) on ischemic stroke [J]., 2018, 818: 604-609.
[43] 戴纪恒. 基于SIRT1-HIF-1α-VEGFA信号转导通路探讨羟基红花黄色素A调控血管新生保护氧糖剥夺/复糖复氧损伤大鼠脑微血管内皮细胞 [D]. 合肥: 安徽中医药大学, 2020.
[44] 宋丽娟, 王青, 杨智超, 等. 红花黄色素对大鼠急性脑缺血后不同时间点炎性损伤的保护作用 [J]. 山西中医, 2017, 33(6): 55-58.
[45] 赵红领, 李磊, 杨慧, 等. 红花黄色素调控p38MAPK对H2O2诱导的星形胶质细胞损伤的保护作用 [J]. 免疫学杂志, 2020, 36(1): 80-85.
[46] Qin X, Chen J, Zhang G,. Hydroxysafflor yellow A exerts anti-inflammatory effects mediated by SIRT1 in lipopolysaccharide-induced microglia activation [J]., 2020, 11: 1315.
[47] Wang X T, Ma Z Y, Fu Z X,. Hydroxysafflor yellow A protects neurons from excitotoxic death through inhibition of NMDARs [J]., 2016, 8(2): 175909141664234.
[48] Wang M, Yao M J, Liu J X,.exerts neuroprotection by promoting adult neurogenesis and inhibiting inflammation in the hippocampus of ME cerebral ischemia rats [J]., 2020, 249: 112385.
[49] Wu S, Wang N, Li J,. Ligustilide ameliorates the permeability of the blood-brain barrier modelduring oxygen-glucose deprivation injury through HIF/VEGF pathway [J]., 2019, 73(5): 316-325.
[50] 梁萍. 基于神经血管单元的三七抗脑缺血再灌注损伤的作用研究 [D]. 百色: 右江民族医学院, 2020.
[51] 林军, 梁萍, 黄清, 等. 三七总皂苷对脑缺血再灌注大鼠神经血管单元的影响 [J]. 中国药业, 2019, 28(13): 10-14.
[52] 李晶晶, 雷涛, 林俊, 等. 当归多糖通过促血管再生保护大鼠脑缺血再灌注损伤机制研究 [J]. 中华中医药学刊, 2019, 37(9): 2272-2276.
[53] 梁启超. 丹参红花配伍研究评价 [J]. 临床医药文献电子杂志, 2019, 6(8): 18.
[54] 宋金军, 周竹晨, 陈冰, 等. 丹参与红花水溶性成分配伍抗大鼠脑缺血再灌注损伤的作用研究 [J]. 中华中医药学刊, 2019, 37(7): 1616-1619.
[55] 陈裕琳, 万海同, 周惠芬, 等. 丹参与红花有效成分配伍对大鼠脑缺血再灌注损伤的保护作用 [J]. 中草药, 2018, 49(16): 3875-3881.
[56] 陈路, 李玮玮, 刘春慧. 药对丹参-红花对脑缺血再灌注损伤大鼠脑保护作用的研究 [J]. 中药药理与临床, 2017, 33(1): 161-166.
[57] Xu H, Liu W X, Liu T L,. Synergistic neuroprotective effects of Danshensu and hydroxysafflor yellow A on cerebral ischemia-reperfusion injury in rats [J]., 2017, 8(70): 115434-115443.
[58] 袁蓉, 施伟丽, 信琪琪, 等. 川芎-赤芍药对研究进展 [J]. 环球中医药, 2019, 12(5): 808-811.
[59] 褚丽. 川芎赤芍配伍对脑缺血再灌注大鼠神经保护因子表达的影响 [D]. 沈阳: 辽宁中医药大学, 2018.
[60] Wang Y, Guo G, Yang B R,. Synergistic effects of Chuanxiong-Chishao herb-pair on promoting angiogenesis at network pharmacological and pharmacodynamic levels [J]., 2017, 23(9): 654-662.
[61] 董永喜, 董莉, 付思红, 等. 辛芍组方对氧糖剥夺损伤的神经PC12细胞凋亡的影响及其机制研究 [J]. 中国药房, 2016, 27(28): 3907-3910.
[62] 陆定艳, 李靖, 董莉, 等. 辛芍组方中灯盏细辛、赤芍单方对脑缺血再灌注损伤大鼠的作用及机制 [J]. 贵州医科大学学报, 2018, 43(10): 1169-1173.
[63] 张楠, 黄鑫, 戴雨霖, 等. 人参三七配伍对脑缺血再灌注损伤小鼠血脑屏障通透性及脑组织炎症反应的影响 [J]. 中国老年学杂志, 2017, 37(7): 1580-1583.
[64] 周惠芬, 万海同, 何昱, 等. 丹参-川芎有效成分配伍对氧糖剥夺海马神经元细胞保护作用研究 [J]. 中草药, 2019, 50(6): 1372-1381.
[65] 刘深, 王宏涛, 魏聪, 等. 通心络胶囊治疗缺血性脑卒中作用机制研究进展 [J]. 中草药, 2017, 48(11): 2321-2326.
[66] 季传钊. 通心络胶囊治疗急性缺血性脑卒中的效果观察 [J]. 当代医药论丛, 2018, 16(2): 103-104.
[67] 张强, 罗毅. 通心络胶囊治疗老年早期缺血性脑卒中的临床观察 [J]. 老年医学与保健, 2019, 25(3): 381-383.
[68] Cheng X, Hou Z, Sun J,. Protective effects of Tongxinluo on cerebral ischemia/reperfusion injury related to Connexin 43/Calpain II/Bax/Caspase-3 pathway in rat [J]., 2017, 198: 148-157.
[69] Yu Z H, Cai M, Li X T,. Neuroprotective effects of Tongxinluo on focal cerebral ischemia and reperfusion injury in rats associated with the activation of the MEK1/2/ERK1/2/p90RSK signaling pathway [J]., 2018, 1685: 9-18.
[70] 李和教, 黄毅岚, 黄易. 基于网络药理学研究血府逐瘀汤治疗血管性认知功能障碍的作用机制 [J]. 海南医学, 2021, 32(9): 1092-1098.
[71] 王彦平, 张保朝, 温昌明. 血府逐瘀汤治疗气虚血瘀证急性脑梗死疗效观察及其促血管新生的机制探讨 [J]. 新中医, 2019, 51(3): 92-95.
[72] 王飞, 田静. 血府逐瘀汤治疗急性缺血性脑卒中 [J]. 中医学报, 2019, 34(7): 1528-1531.
[73] 陈峰, 吴曦, 穆迎涛, 等. 血府逐瘀汤联合常规治疗对急性脑梗死患者炎症反应、氧化应激、内皮及相关因子的影响 [J]. 海南医学院学报, 2019, 25(10): 762-765.
[74] 余瑞双. 基于糖氧剥夺/复供损伤SD大鼠星形胶质细胞和神经元的脉络宁抗炎机制研究 [D]. 开封: 河南大学, 2017.
[75] 庞晓斌, 谢欣梅, 王保全, 等. 脉络宁对脑缺血再灌注大鼠血脑屏障通透性的影响研究 [J]. 中成药, 2014, 36(7): 1347-1350.
[76] 房亚兰, 杨楠, 赵咏梅, 等. 大黄酚对局灶性脑缺血再灌注小鼠缺血半暗带区HIF-1α与VEGF表达的影响 [J]. 首都医科大学学报, 2021, 42(2): 219-224.
[77] 刘炳园, 罗婷婷, 刘柳芳. 大黄素调控NF-κB信号通路抗缺氧缺糖/复氧复糖诱导的PC12细胞损伤 [J]. 河北医药, 2021, 43(8): 1147-1151.
[78] 李江曼, 王一頔, 吴苗苗, 等. 大黄酚通过调控星形胶质细胞相关蛋白表达保护小鼠脑缺血再灌注损伤 [J]. 中国临床药理学杂志, 2019, 35(21): 2702-2705.
[79] 郭青, 何前松, 胡斐然, 等. 大黄酚通过TLR4/NF-κB信号通路途径调控小胶质细胞炎性反应 [J]. 医学信息, 2020, 33(19): 51-54.
[80] 蔡友德, 何前松, 胡斐然, 等. 大黄酸对脑缺血大鼠脑组织中AQP4和小胶质细胞介导炎症反应的影响 [J]. 中国实验方剂学杂志, 2021, 27(2): 60-65.
[81] 陈淑玲, 韩亮. 败酱草的现代研究进展 [J]. 广东药科大学学报, 2017, 33(6): 816-821.
[82] 魏珍珍, 方晓艳, 王灿, 等. 败酱总黄酮对局灶性脑缺血再灌注大鼠的神经保护作用及炎症因子的影响 [J]. 中药新药与临床药理, 2019, 30(4): 396-402.
[83] 方晓艳, 魏珍珍, 苗明三, 等. 败酱总黄酮对局灶性脑缺血再灌注大鼠氧自由基及能量代谢的影响 [J]. 中国现代应用药学, 2021, 38(2): 137-142.
[84] 段建, 康慨, 黄昌仁, 等. 贝母甲素对大鼠脑缺血再灌注损伤的保护作用 [J]. 中国新药与临床杂志, 2020, 39(4): 240-246.
[85] 郭苏兰, 李佳娜, 肖水秀. 贝母素甲对小鼠脑缺血再灌注损伤炎症反应及自噬的影响 [J]. 中国老年学杂志, 2019, 39(21): 5347-5350.
[86] 张家辉. 化橘红柚皮苷调控Nrf2/HO-1及JAK2/STAT3信号通路保护脑缺血再灌注损伤的机制研究 [D]. 南京: 南京中医药大学, 2017.
[87] 刘微, 张洋, 郭建超, 等. 柚皮苷对脑缺血再灌注损伤的保护作用 [J]. 中风与神经疾病杂志, 2017, 34(4): 292-294.
[88] 王璇, 马重阳, 张雅文, 等. 基于网络药理学的侯氏黑散抗缺血性脑卒中机制研究 [J]. 首都医科大学学报, 2021, 42(1): 43-52.
[89] 相阳阳, 王璇, 张秋霞. 侯氏黑散含药血清对氧糖剥夺损伤血管内皮细胞PLCγ2/ERK及TGF-β/Smad2/3表达的影响 [J]. 北京中医药大学学报, 2019, 42(11): 934-939.
[90] 常佳慧, 赵晖, 王蕾, 等. 侯氏黑散化学成分对脂多糖诱导BV2细胞活化中炎性反应因子分泌平衡的影响 [J]. 首都医科大学学报, 2017, 38(2): 213-219.
[91] 张逸. 安脑片抗脑缺血再灌注损伤作用及机制研究 [D]. 北京: 北京协和医学院, 2019.
[92] 项广宇. 化痰通络方治疗短暂性脑缺血发作后脑梗死疗效及对患者氧化应激和血清相关细胞因子水平的影响 [J]. 陕西中医, 2019, 40(7): 864-866.
[93] 张兰, 郭闫葵. 星蒌承气汤治疗急性期缺血性脑卒中机制的研究进展 [J]. 中西医结合心脑血管病杂志, 2020, 18(18): 3017-3020.
Research progress on traditional Chinese medicine against ischemic stroke based on protective effect of each component of neurovascular unit
MENG Qing-qi, MI Yan, HOU Yue
College of Life and Health Sciences, Northeastern University, Shenyang 110169, China
Stroke is a cerebrovascular disease with high mortality, which seriously affects people’s health and life. With the concept of neurovascular unit proposed, the treatment of stroke has changed from a single neuron protection to the protection among the components of neurovascular unit. Traditional Chinese medicine has the characteristics of multi-component, multi-channel and multi-target, which has been widely concerned in the treatment of stroke. According to traditional Chinese medicine, the pathogenic factors of stroke are closely related to “wind”, “phlegm”, “stasis”, “fire”, “” and “deficiency”, among them, “deficiency”, “stasis” and “phlegm” run through the occurrence and development of stroke. Research shows that traditional Chinese medicine based on “deficiency”, “Yu” and “phlegm” syndrome differentiation plays an important role in the treatment of stroke. The protective effects of these traditional Chinese medicines on components of neurovascular unit after ischemic stroke were reviewed in this paper.
traditional Chinese medicine;stroke; neuronal cells; glial cells; vascular cells
R282.710.5
A
0253 - 2670(2021)17 - 5445 - 10
10.7501/j.issn.0253-2670.2021.17.036
2021-07-08
孟庆琦(1997—),女,硕士研究生,研究方向为中药药理学。Tel: 13940203219 E-mail: 1014925917@qq.com
侯 悦(1977—),女,沈阳药科大学62期药学(日语)专业校友,教授,博士生导师,东北大学生命科学与健康学院副院长,主要从事中药药理学研究。Tel: (024)83656116 E-mail: houyue@mail.neu.edu.cn
[责任编辑 崔艳丽]
