甲型H1N1流感病毒感染年轻和老年C57BL/6小鼠诱导肺组织CD8+T细胞特异性免疫应答的比较研究
2021-09-06刘洋王超任晓楠李顺秦波音杨华周晓辉
刘洋,王超,任晓楠,李顺,秦波音,杨华,周晓辉
(复旦大学附属公共卫生临床中心,上海 201508)
全球人口正在迅速老龄化,根据世界卫生组织的数据,60岁以上人口的增长速度超过了其他任何阶段人口,预计到2050年,60岁及以上的人口比例预计将上升至总人口的22%,人口总数将超过20亿[1-2]。衰老常伴随着多种疾病发生,更加剧了人口老龄化的严峻挑战。其中,感染性疾病(如流感等)仍然是老年人发病和死亡的主要原因[3]。当流感病毒从上呼吸道入侵宿主肺部后,往往会造成肺部的炎症病理损伤[4]。而病毒的清除依赖于宿主自身的免疫系统,CD8+T细胞在病毒清除的过程中扮演着重要角色。CD8+T细胞在病毒抗原刺激下发生持续的增殖分化,进入效应阶段并生成病毒特异性CD8+T细胞,然后迁移至感染部位执行效应功能。特异性CD8+T细胞一方面可通过释放穿孔素(perforin)/颗粒酶(granzymes)等直接杀伤细胞,另一方面可通过表面分子(Fas和FasL相互作用)诱导靶细胞凋亡或分泌IFN-γ和TNF-α等多种细胞因子发挥效应[5-6]。
然而,在衰老过程中,机体免疫功能会发生下降,其中获得性免疫系统在老年个体中变化显著,T细胞的改变尤为突出;胸腺输出显著减少导致外周幼稚CD4+T细胞和CD8+T细胞池随着年龄的增长而减少[7-10]。为了研究流感抗原特异性CD8+T细胞随着年龄增长本质上的功能变化,本研究在流感病毒感染的靶器官即肺组织中研究了老年和年轻C57BL/6小鼠流感特异性免疫应答能力,结果表明了老年小鼠肺组织中产生的病毒特异性CD8+T细胞显著减少,并且分泌细胞效应因子以及颗粒酶B的水平显著降低。
1 材料与方法
1.1 材料
1.1.1 实验动物
老年鼠(18月龄以上)[11]:SPF级24月龄C57BL/6小鼠23只,雌性,体重28~34 g;年轻鼠:SPF级3月龄C57BL/6小鼠23只,雌性,体重18~22 g,购于上海西普尔-必凯实验动物有限公司【SCXK(沪)2018-0016】,饲养于上海市(复旦大学附属)公共卫生临床中心实验动物部SPF区域【SYXK(沪)2020-0019】中。饲养环境:温度控制于18~25℃,湿度恒定,自动光控(昼夜各半交替)。在进行病毒感染前3 d将小鼠转移到生物安全二级实验室,对两组小鼠进行分组、标记、体重记录。所有操作均符合上海市公共卫生临床中心实验动物伦理要求(公卫伦审2018-A60-02号)。
1.1.2 病毒
甲型流感病毒毒株 A/Puerto Rico/8/34(H1N1)(PR8),由上海兽医研究所李泽君教授赠予。流感病毒经鸡胚和MDCK细胞培养滴定后,分装并保存于-80℃冰箱。实验过程中包括病毒感染、感染后取材等具有感染性实验操作均在上海市(复旦大学附属)公共卫生临床中心实验动物部生物安全二级实验室(ABSL-2)中开展(注册备案号:金字第022006005号)。
1.1.3 主要试剂与仪器
流式抗体(上海优宁维科技生物股份有限公司,Biolegend),四聚体Flu.NP366-374/Db、四聚体Flu.PB1703-711/Kb、四聚体Flu.PA224-233/Db(广州好芝生物科技有限公司),BD Cytofix/Cytoperm Plus固定破膜试剂盒(Biolegend,555028),I型胶原酶(Sigma 10104159001),流感肽段NP366-374(ASNENMETM)和PA224-233(SSLENFRAYV)(强耀生物公司,中国)。
流式细胞仪(LSR Fortessa,BD公司,美国),CO2培养箱(3111,Thermo,美国),微量移液枪(Eppendorf,德国),冷冻离心机(Micro 17R,Thermo,美国),生物安全柜(HR40-II A2,Haier,青岛海尔特种电器有限公司,中国)。
1.2 方法
1.2.1 小鼠分组及感染
年轻小鼠和老年小鼠各取20只进行感染并进行感染后体重变化记录,在取材时间点各取老年感染组(7只)、老年对照组(3只)以及年轻感染组(7只)、年轻对照组(3只)。使用异氟烷对小鼠进行麻醉,用移液枪吸取40μL病毒液缓慢滴入到小鼠一侧鼻腔中。感染完成后将小鼠放入独立送风隔离笼具(IVC)中正常饲养。
1.2.2 肺组织单细胞的制备
在感染后第8天,分别对感染组老年小鼠和年轻小鼠解剖取肺组织,同时未感染组小鼠各解剖3只,按以下方法制备单细胞:
准备干净的培养皿,向其中加入3 mL R10培养液,将肺组织放入培养皿中,用高压灭菌的剪刀将肺组织尽可能地剪碎,然后将其转移到15 mL离心管中,向管中加入I型胶原酶150μL,使得酶的工作浓度为0.5 mg/mL,轻轻混匀后放于37℃水浴锅中孵育45 min,每隔15 min轻轻混匀1次。消化完全后用预冷的PBS洗两次,4℃,2000 rpm,离心5 min,弃上清,收集细胞。
1.2.3 流式细胞术检测病毒特异性CD8+T细胞
取上述方法制备的肺组织单细胞,以每个样本表面染色用5×105~1×106个细胞加样,染色抗体包括CD8-FITC(1∶200)、CD44-APC-Cy7(1∶200)、Flu.NP366-PE(1∶100),Flu.PB1703-PE(1∶200),Flu.PA224-PE(1∶200)。20μL染色体系,4℃避光染色30 min,PBS清洗2次,200μL染色buffer重悬后等待上机;细胞内细胞因子染色:以每孔2×106个细胞进行铺孔,向细胞中加入流感肽段NP366-374(ASNENMETM)和PA224-233(SSLENFRAYV)按照各2.5μg/mL的浓度与之混匀,按照1μL/mL的比例加入高尔基体阻断剂,混匀后放置于37℃,5%CO2细胞培养箱中培养5 h,按照各抗体以及BD Cytofix/Cytoperm Plus固定破膜试剂盒使用说明书的建议进行染色,流式抗体包括CD8-FITC(1∶200)、CD44-APC-cy7(1∶100)、TNF-α-PE-cy7(1∶100)、IFN-γ-PE(1∶100)、Granzyme B-PB(1∶50)、IL-2-BV605(1∶50)。20μL体系,4℃避光染色30 min。结束后PBS清洗2次,200μL染色buffer重悬细胞,过滤后等待上机。后续实验数据通过Flowjo(V10)软件进行分析。
1.3 统计学分析
2 结果
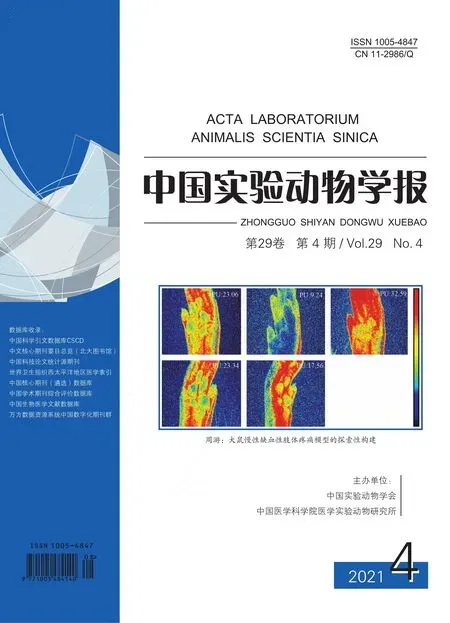
2.1 PR8流感病毒感染C57BL/6年轻小鼠和老年小鼠后体重变化和生存率的比较
本研究使用490 PFU PR8流感病毒分别滴鼻感染3月龄年轻C57BL/6小鼠和24月龄的老年C57BL/6小鼠,连续观察14 d,每天记录体重变化情况及死亡情况。图1A,1B分别对应体重变化曲线和生存曲线。体重变化曲线结果显示:在感染后的第3天,与年轻小鼠相比,老年小鼠体重开始显著下降。第4天开始,两组小鼠体重均逐渐减少,并且老年小鼠体重下降率显著高于年轻小鼠。年轻小鼠和老年小鼠分别在感染后第8天与第9天体重下降到最低,此后,两组小鼠体重开始恢复。生存曲线结果显示老年组小鼠生存率显著低于年轻组小鼠(P<0.01)。结果提示老年小鼠感染PR8流感病毒后,小鼠体重损失及死亡更严重。
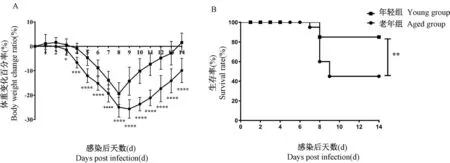
图1 年轻小鼠和老年小鼠感染PR8流感病毒后体重变化曲线及生存曲线Note.A.Body weight changes of the young and aged mice infected with PR8 influenza virus.B.Survival rate of the young and aged mice infected with PR8 influenza virus.Compared with young mice,*P<0.05,**P<0.01,***P<0.001,****P<0.0001.Figure 1 Body weight changes and survival curves of the young and aged mice infected with PR8 influenza virus
2.2 流感病毒感染后年轻组和老年组小鼠诱生病毒特异性CD8+T细胞水平的比较
为探究甲型HIN1流感病毒PR8感染C57BL/6年轻鼠和老年鼠后肺组织诱发的特异性CD8+T细胞免疫应答的差异,在感染后第8天解剖小鼠取肺,通过流式细胞术检测了不同的流感病毒抗原表位包括NP366-374、PA224-233、PB1703-711共同诱导产生的病毒特异性CD8+T细胞比例(见图2)。对CD8+T细胞亚群设门分析,分析流感抗原特异性Tetramer阳性细胞群。结果表明老年组诱生的病毒特异性CD8+T细胞的比例1.39%±0.41%显著低于年轻组4.58%±1.25%(P<0.01)。可知在肺组织中老年组能够诱生病毒特异性CD8+T细胞的能力受损。
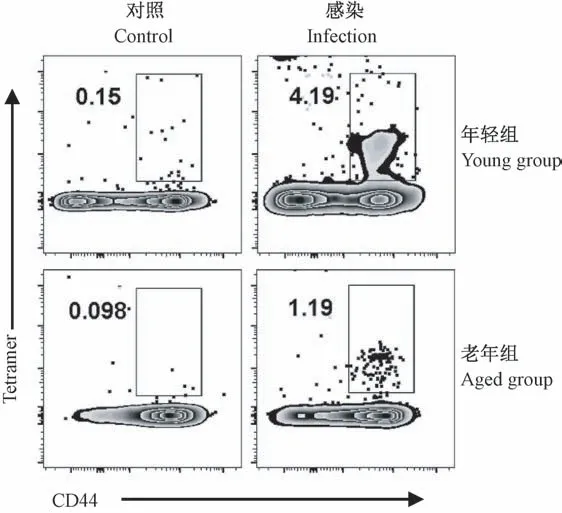
图2 感染后第8天年轻和老年小鼠肺组织中病毒特异性CD8+T细胞比例比较Note.Data gated on CD8+T cell population.Figure 2 Comparison of the proportion of virus-specific CD8+T cells in lung tissues from young and aged mouse on the 8th day after infection
2.3 流感病毒感染后年轻组和老年组小鼠活化CD8+T细胞产生细胞因子水平的比较
利用流感病毒肽段NP366-374(ASNENMETM)和PA224-233(SSLENFRAYV)对制备好的肺组织单细胞进行特异性刺激,通过流式细胞术检测活化后CD8+T细胞(CD8+CD44HighT亚群)分泌IFN-γ、TNF-α和IL-2的比例(见图3)。在分泌IFN-γ方面,老年小鼠活化的CD8+T分泌的比例为0.58%±0.26%显著低于年轻组6.11%±1.64%(P<0.01);在分泌TNF-α方面,老年组的比例0.87%±0.31%显著低于年轻组3.96%±1.28%(P<0.01);此外,老年小鼠活化的CD8+T分泌IL-2的比例0.40%±0.11%同样显著低于年轻组0.82%±0.36%(P<0.05)。因此,在流感病毒第8天后,老年小鼠CD8+T细胞活化后分泌的细胞因子减少,预示其功能受损,抗病毒能力减弱。
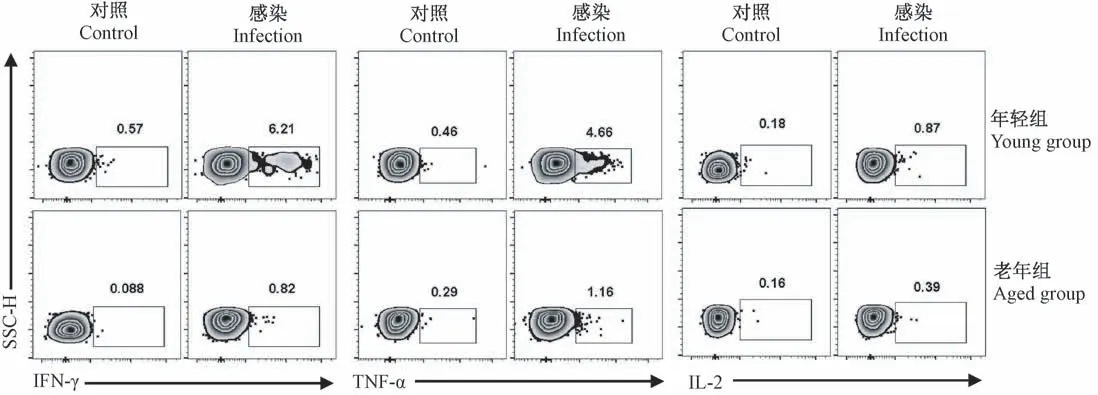
图3 感染后第8天老年和年轻小鼠肺组织中CD8+CD44High亚群分泌IFN-γ、TNF-α、IL-2比较Note.Data gated on CD8+CD44High T cell population.Figure 3 Comparison of IFN-γ,TNF-α,IL-2 secretion by CD8+CD44High T cell subpopulation in lung tissues from young and aged mouse on the 8th day after infection
2.4 流感病毒感染后年轻组和老年组小鼠活化CD8+T细胞产生颗粒酶B水平的比较
当流感病毒感染宿主后,CD8+T细胞在保护机体的过程中除了分泌细胞效应因子外,还会通过释放穿孔素和颗粒酶直接杀伤受感染的靶细胞,从而清除病毒。因此检测了老年和年轻小鼠分泌颗粒酶B(Granzyme B)的情况(见图4)。从CD8+CD44High亚群进行画门分析Granzyme B阳性的细胞比例,结果显示:老年组小鼠分泌的颗粒酶B(Granzyme B)的比例1.16%±0.43%显著低于年轻组3.84%±0.66%(P<0.01)。因此,老年小鼠CD8+T细胞分泌颗粒酶B的能力也受损,预示其清除流感病毒的能力降低。
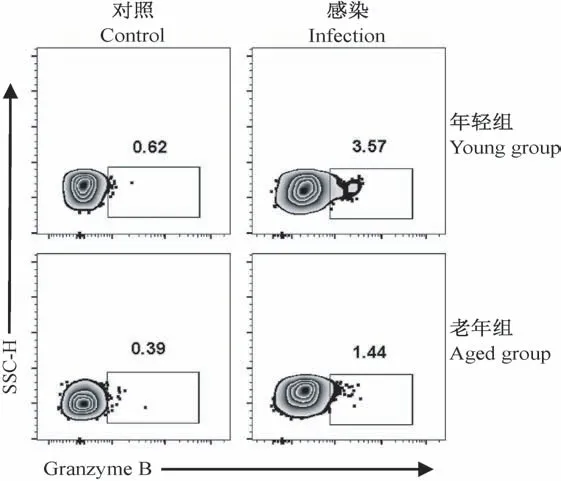
图4 感染后第8天老年和年轻小鼠肺组织中CD8+CD44High亚群分泌Granzyme B的比较Note.Data gated on CD8+CD44High cell population.Figure 4 Comparison of the Granzyme B secretion by CD8+CD44High subpopulation in lung tissues from young and aged mouse on the 8th day after infection
3 讨论
衰老对免疫系统有着深远的影响,免疫系统的固有和适应性免疫应答都随着年龄的增长而呈现功能下降[12-13]。个体对新遇到的感染产生有效的T细胞反应和对疫苗接种产生反应的能力与多方面因素有关。例如,从细胞层面而言,T细胞库(T cell repertoire)多样性维持是其中之一。在老龄化过程中,由于胸腺萎缩老年人循环中Naïve T细胞数量明显减少,其分化增殖能力下降、诱生新的T细胞记忆反应能力也受损,导致T细胞库的多样性减少[14-16],这可能与机体对新遇到的病原体刺激产生初级CD8+T细胞反应的能力降低有关。机体对病毒感染的免疫依赖于病毒特异性免疫应答,其中,病毒特异性CD8+T细胞免疫应答是清除病毒的关键。因此,研究老年宿主CD8+T细胞的特异性免疫应答的改变尤其重要。
本研究使用PR8病毒分别滴鼻感染3月龄C57BL/6小鼠和24月龄C57BL/6老年鼠,在攻毒后第8天即效应阶段取小鼠肺组织细胞做流式检测,对流感病毒抗原表位(包括NP366-374、PA224-233、PB1703-711)诱导产生的病毒特异性CD8+T细胞进行检测。结果显示,感染后第8天老年组肺中病毒特异性CD8+T细胞的比例显著低于年轻组。这表明老年宿主CD8+T细胞经过流感病毒的抗原刺激后激活分化能力降低,诱导产生的病毒特异性的CD8+T细胞减少。流感病毒抗原存在多种抗原表位,受感染的宿主CD8+T细胞在不同抗原表位刺激下产生能够发挥效应的特异性CD8+T细胞[17]。本研究对多种流感病毒抗原表位诱导产生的病毒特异性CD8+T细胞比例进行了整体检测,结果表明:老年宿主肺组织产生的病毒特异性CD8+T细胞显著降低,更反应出了老年宿主诱生病毒特异性T细胞功能整体受损。
流感病毒从上呼吸道感染宿主入侵到肺部后,幼稚的CD8+T细胞被树突状细胞激活并从肺部迁移到淋巴结的T细胞区,在该处增殖分化为病毒特异性CD8+T细胞,病毒特异性CD8+T细胞能够产生细胞因子(如IFN-γ、TNF-α和IL-2等)及效应分子限制病毒复制并清除病毒[18-19]。本团队前期研究发现,在肺组织中检测到老年组活化的CD8+T细胞分泌的IFN-γ、TNF-α和IL-2水平均显著降低。同时,老年组活化的CD8+T细胞分泌的Granzyme B水平也显著降低。颗粒酶B(Granzyme B)是细胞毒性T淋巴细胞(CTL)和自然杀伤细胞(NK)中丝氨酸蛋白酶家族中的主要效应分子,可进入靶细胞,激活caspase级联反应,从而迅速使被感染的靶细胞裂解死亡[20],在清除病毒过程中发挥着重要的作用。由此可见,老年小鼠活化CD8+T细胞在应对流感感染应答过程中分泌效应因子的功能减弱,可能导致病毒清除能力降低。有研究表明流感感染老年和年轻C57BL/6小鼠后,老年小鼠肺部病毒清除延迟。年轻小鼠在感染后10 d左右肺部病毒滴度处在较低的水平,而老年小鼠依旧维持在一个相对较高的水平[21]。本文的研究结果中,老年小鼠肺组织CD8+T细胞分泌的细胞效应因子以及具有杀伤功能的效应分子Granzyme B均显著降低,这一结果可能解释了老年小鼠肺部病毒清除延迟的原因。
综上,本研究通过流感病毒PR8感染小鼠模型,分析了老年和年轻小鼠肺组织CD8+T细胞应对流感病毒感染特异性免疫应答功能,检测了针对多种流感抗原表位产生的病毒特异性CD8+T细胞比例,结果表明:老年小鼠CD8+T细胞分化产生特异性CD8+T细胞的功能受损;同时老年小鼠CD8+T细胞分泌细胞因子及效应分子的能力减弱。然而导致老年宿主CD8+T细胞特异性免疫应答功能减弱的机制还不清楚。T细胞在免疫应答过程中的转录和翻译调控是分子层面决定其功能的关键环节之一,基因的转录及翻译调控又受到多个方面的影响,如转录因子、组蛋白修饰、DNA/RNA甲基化等[22]。因此,为改善老年宿主感染流感病毒的结局和预后,上述多个方面在调控老年宿主CD8+T细胞功能中的研究值得深入探究。