血管性认知障碍动物模型的研究进展
2021-09-06侯外方张茂森张琳韩敏石璇陈美蓉栾晶
侯外方,张茂森,张琳,韩敏,石璇,陈美蓉,栾晶
(陕西省缺血性心血管疾病重点实验室,陕西省脑疾病重点实验室,西安医学院基础与转化医学研究所,西安 710021)
1 血管性认知障碍概述
血管性认知障碍(vascular cognitive impairment,VCI)是一个综合症[1],致病因素较为复杂,包含有脑血管病的危险因素,例如:高血压病、糖尿病、高脂血症、同型半胱氨酸血症和代谢综合征等[2-6],涵盖了显性脑血管病,例如:脑梗死和脑出血等[7]以及非显性脑血管病如:白质损伤和慢性脑缺血等[8-9]导致的从轻度认知损害到痴呆的临床综合征。它的发病和发展是一个持续的由轻至重的发展过程,包括非痴呆性VCl(VCI non-dementia,VCIND)和血管性痴呆(vascular dementia,VaD)。血管性认知障碍的病程持续加重会演变为血管性痴呆。尤其在中老年人群中发病较高[10-13]。VCI严重损害患者日常生活能力和社会功能,明显降低患者的生活质量,已经成为重大的公共卫生问题之一。
值得一提的是,VCI是除了年龄之外最大的单一可识别的痴呆风险因素,这意味着由血管疾病导致的痴呆症状或许是最有可能在发病早期发现、并通过早期干预阻止病程进一步恶化的痴呆[14-15]。成功建立慢性脑缺血性血管性认知障碍的动物模型,是医学研究其发病机制、探索治疗方法并攻克此疾病的第一步。现有的研究显示,脑血流量减少40%~50%,脑细胞活动就会受到明显的抑制。在慢性缺血的条件下,广泛的脑血管病变会导致神经元细胞的不可逆性损伤、脑灰质减少、脑白质损伤、脑脂质稳定性异常、轴突和髓磷脂损伤,这些的病理变化会影响大脑的电生理活动,引起中枢神经系统对信息的摄取、传递、整合、处理能力衰退最终影响认知功能造成认知功能障碍[16-19]。因此,通过手术法结扎或闭塞重要的脑部大血管,是模拟VCI发病机理,构建VCI模型的较好途径。
2 VCI动物模型的构建
2.1 大鼠四血管闭塞法及其改良模型
2.1.1 大鼠四血管闭塞法
Pulsinelli等[20]在1979年提出的四血管闭塞(4-vessel occlusion,4-VO)法。此手术方法被广泛用于研究脑缺血性认知障碍[21-24]。
(1)具体构建方法:在动物麻醉的前提下进行手术,通过电灼法永久闭塞Wistar大鼠两个椎动脉,并在双侧颈总动脉处放置松弛的可逆性卡环,24 h后收紧颈动脉卡环暂时闭塞双侧颈总动脉以达到四血管闭塞的目的,根据研究目的选择在术后间隔10、20、30 min解除颈总动脉卡环的闭塞,实现颈总动脉的血液再流通。
(2)模型机制:a:缺血受损:通过永久性闭塞大鼠双侧椎动脉,配合间歇性闭塞双侧颈总动脉,主要导致大鼠前脑大脑半球严重缺血缺氧引起脑神经细胞营养供应障碍以及细胞氧代谢障碍,引起脑组织神经元细胞坏死,同时坏死细胞触发炎症反应,致使白细胞和小胶质细胞活化产生多种炎性介质如:基质金属蛋白酶(MMP)等生成,最终导致一氧化氮(NO)和氧自由基(ROS)生成增多导致脑细胞水肿出血和死亡[25],与大鼠智能相关的区域受损严重,而脑干部分几乎不受影响。b:缺血再灌注损伤:由于再通双侧颈总动脉致使血液再流通,引起氧化应激、白细胞浸润、炎症反应过度激活、血脑屏障遭到破坏以及白细胞和补体过度激活共同加重的脑损伤[26]。
(3)评价指标:a:病理学变化:免疫组织化学结果显示在施行不同时间间隔的颈总动脉再通的4-VO手术后,大鼠脑部不同区域的损伤程度不同,且损伤程度与缺血时间成正比表现出逐级加重,损伤涵盖了海马的HI区、H3-5区和旁正中区、后新皮质的第3、5和6层以及纹状体[27]。有研究表明4-VO法术后的动物存在前脑短暂性缺血性不可逆性损伤,损伤涵盖了脆弱神经元群体,如海马CA1区锥体细胞等也包含在内,这个大脑区域对学习和记忆至关重要[28]。b:认知行为学:4-VO大鼠在术后除了记忆功能障碍之外,还存在感觉运动障碍或者非特异性认知缺陷,出现有持续的记忆困难[28],该手术方法是针对鼠类最初的研究大脑缺血性疾病认知障碍的手术方法。
(4)模型制作的注意事项:该手术方案由于需要闭塞大鼠椎动脉,手术较为精细复杂对于实验操作者具有较高的要求。
(5)优点:根据研究目的控制动脉闭塞的时间(10、20、30 min解除颈总动脉卡环的闭塞),间接控制动物脑损伤的程度。
(6)缺点:同时闭塞四支主要供应脑部的血管可造成较高的大鼠死亡率,现今研究已经较少应用。
2.1.2 大鼠四血管闭塞法的第1种改良模型
Yamaguchi团队提出对于4-VO法进行改进,改良版的4-VO法也被大量学者沿用[29]。
(1)具体构建方法:在动物麻醉的前提下进行手术,在手术过程中将Wistar大鼠双侧颈总动脉和双侧椎动脉同时夹闭、并间隔一段时间(10 min或30 min)后将四支血管进行再疏通。
(2)模型机制:术后大鼠脑血流量(cerebral blood flow,CBF)减少,同4-VO中的病变机制一致。
(3)评价指标:a:病理学变化:在术后24、48、72 h,间隔10 min再疏通血管实验组中动物CA1和CA3区,以及在实验组间隔30 min再疏通实验组中动物的RGb、S1、白质、丘脑、CA1、CA2、CA3和齿状回都观察到相应细胞的损伤[29]。b:神经功能评分:实验动物存在神经缺陷,神经功能评分明显下降[29]。
(4)模型制作的注意事项:该手术方案被广泛采用后,有学者发现无论用4-VO还是改良4-VO法,再疏通血管间隔的不同时间、手术中动物脑部处于的不同温度环境、以及术后时间的长短都会影响大脑病变损伤部位和程度[30-33],进而,在研究疾病的过程中,通过控制上述变量可得到动物的不同病理表现,使得该手术方案的应用更加广泛。值得一提的是,4-VO法和改良4-VO法也可被应用于脑缺血和脑缺血性再灌注损伤的相关研究[34-37],这也体现了该手术方法适用范围的广泛性。
(5)优点:改良的4VO手术不影响血气值、血细胞比容、血红蛋白或直肠温度,也不导致食管或气管损伤或过度出血。根据研究目的控制动脉闭塞的时间、术中脑温度等因素可间接控制动物脑损伤的程度。
(6)缺点:手术需同时闭塞四支主要供应脑部的血管,大鼠因大脑缺血缺氧导致死亡率较高,该问题目前仍旧没有得到根本性的解决。
2.1.3 大鼠四血管闭塞法的第二种改良模型
Pereira等[38]2012年通过研究提出了基于4-VO方案的另一种新型Wistar大鼠的缺血性认知功能障碍的动物模型。
(1)具体构建方法:在动物麻醉的前提下进行手术,通过椎动脉和颈内动脉的永久性闭塞并且按照双侧椎动脉→颈内动脉→颈内动脉的顺序对于该四条血管进行3阶段逐渐闭塞(4-vessel occlusion/internal carotid artery,4-VO/ICA),选择级间间隔(the interstage interval,ISI)即一个闭塞阶段和下一个闭塞阶段之间经过的时间分别为7、5、4或3 d。
(2)模型机制:术后大鼠出现慢性脑血流量(cerebral blood flow,CBF)灌注减少,同4-VO中的病变机制一致,不同的是术中未再进行血液再灌注,避免脑部血液再灌注损伤,且大鼠脑血流量逐渐减少,大鼠生理指标较稳定。
(3)评价指标:a:病理学变化:实验表明,海马CA1至CA4亚区、RS、PtA皮层中功能正常的锥体细胞,随着ISI的缩短和4-VO/ICA术后闭塞血管时间的延长而减少即神经退行性程度增加。该研究团队发现4-VO/ICA持续时间增加,到90 d,神经变性的程度仅轻微增加且不显著,即脑损伤的程度不会出现和持续时间呈正相关的现象。研究还发现神经细胞变性和死亡的发生发展在很大程度上是在4-VO/ICA的最初几天内发生的[38]。b:认知行为学:新型8臂放射状迷宫实验显示动物出现逆行性遗忘(健忘症)且病变程度随着4-VO/ICA慢性化程度的增加而增加。
(4)注意事项:在使用该模型时,可根据研究目的选择ISI和术后间隔时间。研究提示ISI越短动物脑灌注越不足。由于神经细胞变性和死亡的发生发展很大程度上是在最初几天内发生的,这也提示其他学者,如果应用该动物模型研究药物在预防永久性4-VO/ICA后神经元死亡方面的药效,那么给药时间要尽可能早(即在闭塞阶段)或在4-VO/ICA完成后不久开始。
(5)优点:该方法避免了因动物眼部的不完全性缺血造成的动物视觉功能障碍而影响迷宫实验中评估学习和记忆的实验数据,保证了实验数据的可靠性[38-39]。
(6)缺点:因大鼠脑部主要供血的四支血管同时闭塞,极易造成大鼠因脑部短时间供血不足而死亡。此外,有研究表明4-VO法大鼠的认知障碍只存在于中老年大鼠而对于年轻大鼠无效[40-41]。
2.2 大鼠两血管闭塞法及其改良模型
2.2.1 大鼠双侧颈总动脉结扎法
双侧颈总动脉结扎法(bilateral common carotid arteries ligation,2-VO)是通过SD大鼠双侧颈总动脉永久性结扎的方法,来研究慢性整体脑血液灌注不足对于认知功能障碍和神经退行性过程的影响。利用该模型对血管性痴呆(VD)的研究涵盖了2-VO相关的脑血液灌注不足程度、代谢变化、学习和记忆障碍、神经元信号衰竭、以及海马的神经病理改变等[42]。因而也被众多学者应用于VCI研究。
(1)具体构建方法:在动物麻醉的前提下进行手术,于大鼠的双侧颈总动脉进行同时结扎闭塞,从而构建大鼠脑部血液灌注不足的模型。
(2)模型机制:永久性结扎大鼠双侧颈总动脉,脑组织处于慢性低灌注状态,从而产生大脑严重缺血缺氧引起脑神经细胞营养供应障碍以及细胞氧代谢障碍,引起脑组织神经元细胞坏死,同时坏死细胞触发炎症反应,致使白细胞和小胶质细胞活化产生多种炎性介质如:基质金属蛋白酶(MMP)等生成,最终导致一氧化氮(NO)和氧自由基(ROS)生成增多导致脑细胞水肿出血和死亡[25],脑组织的损害是渐进性的,学习记忆功能的损害程序性加重。
(3)评价指标:a:病理学变化:由于大脑中的灰质、白质、以及海马对于缺血缺氧都非常的敏感,故缺血缺氧后常发生灰质、白质、以及海马体损伤和神经元死亡这些病理学改变会引起动物学习和记忆障碍记忆功能下降发生缺血型中风[43-44]。b:认知行为学:4-VO法构建的大鼠模型表现出持续受损的空间学习能力[45],2VO法可实现相同的表型[46],2-VO法构建的大鼠存在学习和记忆障碍。
(4)注意事项:在进行手术的过程中,结扎动脉时保证实现血管的完全闭塞。
(5)优点:由于2-VO法术后出现的病理学损伤的病因和其手术操作比4-VO法相对简单,术后动物表现出持续受损的空间学习能力,与4-VO一致。2-VO随后被认为是大脑缺血后认知障碍病和血管性痴呆(VD)的理想模型。该手术方案相对简单,手术成本也较低。
(6)缺点:该模型仍存在不足,例如因需同时结扎双侧颈总动脉,动物脑部迅速发生低血流量灌注,导致较高的死亡率;此外,有报道发现2-VO术后动物表现出的认知缺陷有部分原因是术后动物眼部的不完全缺血造成视网膜损伤[47-48],影响了动物的视觉功能,混淆了行为学中评估学习和记忆表现的实验数据。
2.2.2 改良大鼠双侧颈总动脉结扎法
随着对血管性痴呆研究的深入,Sarti等[49]提出了将大鼠[50]两侧颈总动脉分别间隔1周做两次手术结扎即改良的2-VO法。
(1)具体构建方法:在动物麻醉的前提下进行手术,用结扎线对于大鼠的双侧颈总动脉进行间隔1周的结扎闭塞。
(2)模型机制:机制同2-VO法,间隔1周分两次永久性结扎大鼠双侧颈总动脉,脑组织处于慢性低灌注状态,从而产生缺血缺氧性损害,脑组织的损害是渐进性的,学习记忆功能的损害程序性加重。
(3)评价指标:a:病理学变化:存在海马CA1区神经元出现明显损伤,白质区也有损伤。b:认知行为学:Morris水迷宫等行为学实验结果也验证了相对与假手术组,实验组大鼠的学习和记忆成绩潜伏期明显延长(P<0.01)[51]。以上结果说明改良后的手术方案能够复制大鼠的血管性痴呆的模型,且显著提高术后动物的成活率。
(4)注意事项:在进行大鼠的动脉闭塞过程保证结扎线完全闭塞动脉血管,实现颈总动脉的完全闭塞。
(5)优点:改良2-VO手术法避免了同时结扎双侧颈总动脉导致的大鼠脑急速缺血缺氧,从而降低大鼠死亡率。吴章福等[51]采取Sarti等[49]提出的设想验证了采用改良的2-VO法,发现在术后大鼠48 h和60 d的成活率相对于传统的同时结扎双侧颈总动脉(2-VO)而言,有显著的提高:传统2-VO实验组60 d的成活率为40%,而改良组60 d的成活率为75%(P<0.05)。此外,该手术操作简单,手术成本较低。
(6)缺点:由于手术分两次进行,首次手术和二次手术间隔时间为1周,实验周期延长。
2.3 大鼠一侧颈总动脉闭塞一侧颈总动脉的狭窄法。
根据现有的研究,Mansour团队提出了对于成年SD大鼠的一侧颈总动脉闭塞一侧颈总动脉的狭窄模型(modified common carotid artery occlusion,mCCAO)。
(1)具体构建方法:在动物麻醉的前提下进行手术,用6-0号丝线将左侧颈总动脉进行结扎,同时,将右侧颈总动脉与动脉和较钝的29号针捆绑在一起,而后抽出针的建模方法,这种技术保留了该侧动脉的部分血流,成功构建了一侧颈总动脉闭塞一侧颈总动脉的狭窄(modified common carotid artery occlusion,mCCAO)。
(2)模型机制:机制同2-VO法,脑组织处于慢性低灌注状态,从而产生缺血缺氧性损害。
(3)评价指标:a:影像学:mCCAO引起中度缺血脑部血流量灌注下降,但是没有脑梗塞,随着时间的推移该模型动物狭窄一侧动脉会出现自发闭塞,动物椎动脉和基底动脉形成了侧支代偿循环,动物CBF在进行手术后第1周表现出逐渐适量减少,在第2周趋向于平稳,然后从第3周到第4周开始恢复。b:病理学变化:研究显示海马CA1亚区受损神经元的百分比在mCCAO术后第4周约为30%,在mCCAO术后第8周约为23%。由大脑缺血导致的脑白质损伤(WM)约在第4周出现并在第8周开始出现缓解。c:认知行为学:研究表明动物的脑血流量在第4周开始恢复,第8周由缺血导致的WM损伤有缓解趋势。但大鼠认知障碍在第8周仍然存在且有加重的趋势。此外,mCCAO术后大鼠仅存在空间学习障碍,而无运动功能障碍或出现不活动大鼠[52]。
(4)注意事项:对大鼠的体重要求严格,手术过程中尽可能的避免损伤血管,在将血管针捆绑而后抽针的过程避免血管的损伤。
(5)优点:可通过不同型号的针构建不同程度的颈总动脉狭窄,因此应用范围较为广泛,手术花费较少。
(6)缺点:此模型的构建更倾向于烟雾病[53]的病理模型,模型的局限性在于4~8周后脑白质的损伤会得到一定的逆转,这一特点对研究血管性痴呆的治疗效果以及病程进展研究存在干扰,不利于对疾病预防和治疗的进一步探索。此外,该模型有潜在的脑脊液瘘形成。
2.4 小鼠双侧颈总动脉狭窄法(BCAS)
最初针对VCI的研究都是以大鼠为实验对象展开的,缺少小鼠的模型。由于C57BL/6品系小鼠的后交通动脉存在发育不良,因此有学者通过手术将0.18 mm的金属微线圈套在小鼠双侧颈总动脉上,造成小鼠颈总动脉狭窄(bilateral CCA stenosis,BCAS),脑部血液灌注不足、脑组织缺血缺氧的,以此方法成功构建晚期皮质下缺血的血管性痴呆模型。
(1)具体构建方法:选取C57BL/6J小鼠在麻醉的前提下进行手术,采用0.18 mm的金属微线圈套在小鼠双侧颈总动脉,对于两支颈总动脉进行狭窄化处理。
(2)模型机制:机制同2-VO法,因双侧颈总动脉狭窄,脑组织处于慢性低灌注状态,从而产生慢性缺血缺氧性损害。
(3)评价指标:a:病理学变化:经检测,约30 d后小鼠出现脑白质损伤,8个月后在脑白质严重的损伤的前提下,小鼠海马也受到影响发生明显的萎缩和凋亡,这是白质损伤后通过信号调节间接介导海马损伤的结果[54]。同时研究发现动物的血脑屏障通透性增加。b:认知行为学:实验小鼠表现出空间工作记忆障碍以及运动功能受损(皮质下血管性痴呆的关键特征之一)。
(4)注意事项:该手术很复杂,在手术过程中尤其要注意避免微线圈套入动脉过程中损伤动脉。
(5)优点:动物在术后出现感觉/运动缺陷(即皮质下血管性痴呆的典型特征之一),动物出现的海马病变与人类患者这有相似之处,研究发现实验动物不涉及视神经损伤。
(6)缺点:在术后第3个月动物才开始出现感觉/运动缺陷(即皮质下血管性痴呆的典型特征之一)。此外,术后30 d里BCAS小鼠模型并未出现皮质下VCI的其他的如认知障碍和记忆力减退的表型。该手术花费较高,且手术难度高。
2.5 不对称双侧颈动脉狭窄法(ACAS)
ACAS模型较成功的复制了伴有梗塞和运动功能障碍的皮质下低灌注型VCI。
(1)构建方法:不对称颈动脉手术(asymmetric CCA surgery,ACAS),选取C57BL/6小鼠在麻醉的前提下进行手术,用金属微线圈套在C57BL/6J小鼠的一侧颈总动脉,另一侧颈总动脉采用Ameroid环[55]进行结扎,由此构建具有运动功能障碍和脑白质梗死损伤模型。
(2)模型机制:机制同2-VO法,因一侧颈总动脉狭窄,一侧侧颈总动脉渐进性闭塞,脑组织处于慢性渐进性血液低灌注状态,从而产生慢性缺血缺氧性损害伤
(3)评价指标:a:病理学变化:该模型动物CBF下降趋势较平缓,在术后第14天和第32天可观察到多个白质梗死灶,皮质下的胼砥体、内囊、海马伞和尾状核都存在梗死相关病灶。b:认知行为学:动物表现出明显的认知记忆障碍、执行功能障碍、和运动功能障碍[56]。
(4)注意事项:该手术需要两种技术较为复杂,在手术过程中尤其要注意避免微线圈套入动脉过程中损伤动脉。
(5)优点:采用Ameroid环进行手术实现了对于该侧颈总动脉进行逐渐进行性的狭窄化处理,更加符合VCI的疾病进展。
(6)缺点:ACAS小鼠不会发生微血管病理学变化,这与大多数VCI人类的发病机制存在差异[57]。术后,微线圈会对动脉血管内皮产生不利影响[58-59]。该手术难度较高,且手术成本花费是BCAS法的两倍以上。
3 以上不同手术方案的对比
继大鼠4-VO法的提出与广泛应用,针对啮齿类动物VCI模型构建方法的改进包括从手术方法(如:同时结扎4支供应脑部的主要血管,到分批次结扎椎动脉和颈总动脉等)到实验对象(从大鼠到小鼠)的尝试。现对以上几种模型构建方法进行横向比较。
3.1 2-VO法、4-VO法、mCCAO法对比
与4-VO法比,2-VO法在一定意义上降低了由于同时闭塞四支主要脑部供血的血管而导致的因脑组织急性缺血缺氧造成的高死亡率。此外,2-VO的手术操作更简单。
与2-VO相比,4-VO可根据研究目的控制其他变量,间接控制动物脑损伤的程度,因此该方法的应用范围更加的广泛。且4-VO术后的动物不存在眼睛的不完全缺血导致视网膜损伤影响动物的视觉功能。
与2-VO和4-VO相比,mCCAO法可使狭窄一侧动脉自发闭塞,血管病理变化更接近脑血管疾病的发生发展机制。然而在术后第3周到第4周动物脑血流量开始逐渐恢复,因缺血导致的脑白质损伤(WM)损伤逆转并且出现缓解。此外,mCCAO法大鼠仅存在空间学习障碍,该特点对血管性痴呆的治疗效果以及病程进展研究存在缺陷。
3.2 大鼠模型与小鼠模型对比
小鼠模型的构建使得对VCI的研究不再仅局限于以往的大鼠研究,但因小鼠的组织器官更小,在进行手术时操作难度高于大鼠。小鼠手术方案(ACAS,BCAS)实现了颈总动脉血管逐渐闭塞,这对于临床上的心脑血管疾病的研究都具有重要的意义。此外,目前大部分转基因动物为不同品系小鼠,如果研究目的涉及特定的基因功能,需要应用转基因小鼠来进行建模。
大鼠的优势在于术后所出现的认知功能障碍相对小鼠更加明显,BCAS小鼠模型30内并不出现皮质下VCI的如认知障碍等表型,ACAS小鼠不出现微血管病理变化。
3.3 BCAS法与ACAS法对比
传统VCI手术方案以大鼠为实验对象,ACAS和BCAS的手术方案将实验对象改为小鼠,使在该疾病的模式动物研究中有更多选择,此外,这样创新性的尝试也有利于发现新的脑缺血缺氧后的病理损伤因素以及认知功能障碍的影响因素。两种手术方案的操作难度相似,ACAS手术方案以一侧的Ameroid环代替BCAS手术方案中的金属微线圈,二者都成功实现了颈总动脉血管逐渐闭塞的效果,可开展小鼠血管性痴呆的相关机制研究。BCAS模型的成功建立了晚期的皮质下缺血性血管性痴呆,但是无出现皮质下VCI如认知障碍和记忆力减退等表型。ACAS动物表现出明显认知记忆障碍、执行功能障碍和运动功能障碍,但ACAS小鼠无微血管病变,这与大多数人类VCI发病机制存在差异。
4 结合研究目标选择最优手术方案
本文归纳总结以上几种手术方案的特点(表1)及优缺点(表2)如下:
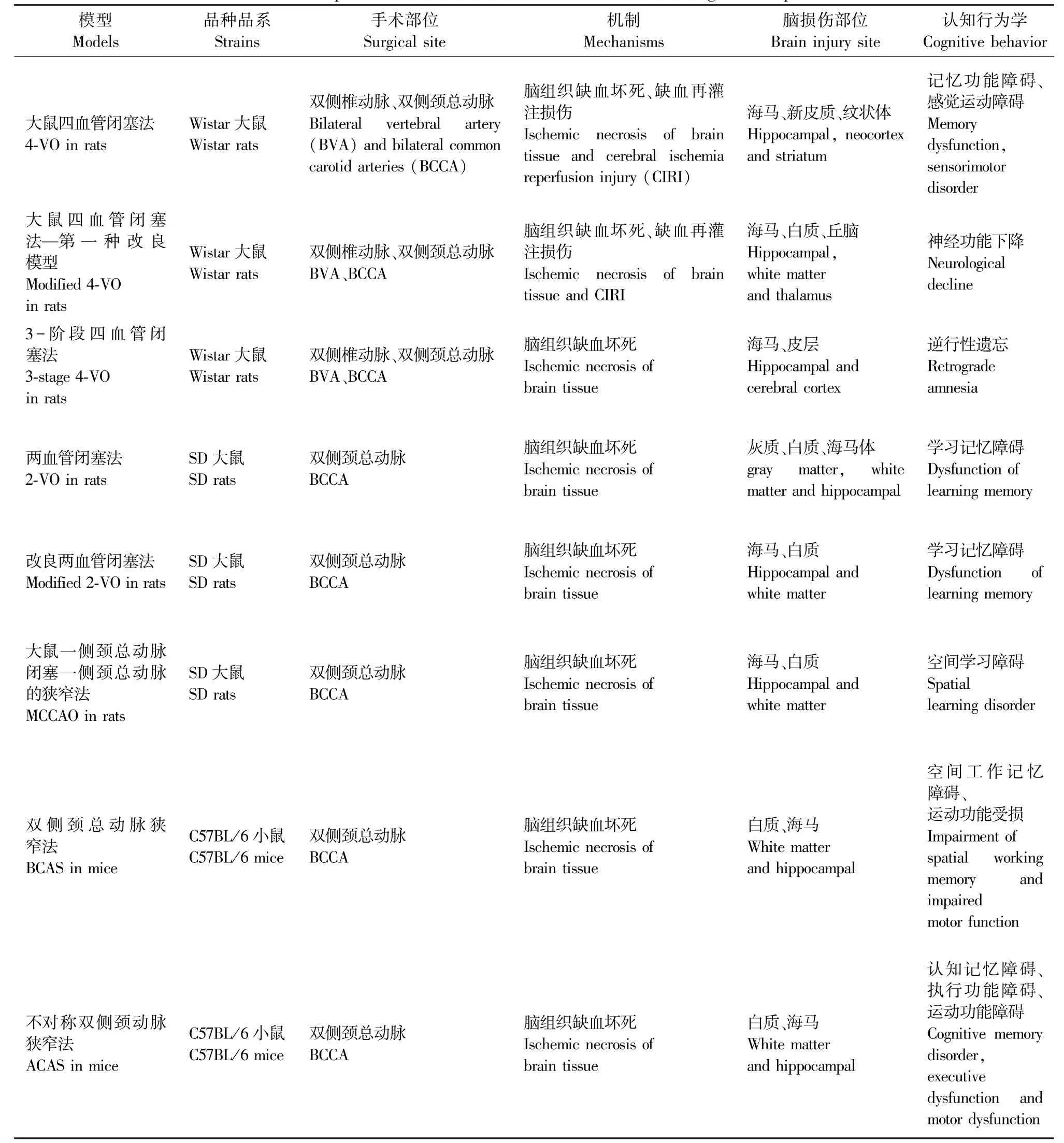
表1 常见血管性认知障碍动物模型对比Table 1 Comparison of common animal models of vascular cognitive impairment

表2 常见血管性认知障碍动物模型优缺点比较Table 2 Summary of advantages and disadvantages of common animal models of vascular cognitive impairment
4.1 4-VO法及其改良模型
4-VO以及第一种改良4-VO模型是通过4血管闭塞(双侧椎动脉以及双侧颈总动脉)而后再灌注血液成功建模。一系列氧化应激反应是缺血再灌注损伤的重要病理生理学机制之一[60],有研究表明在4-VO术后大鼠出现如肝功能异常、糖尿病等代谢性疾病[61-62],因此在研究VCI与缺血再灌注损伤相关的机制以及VCI与糖尿病相关的研究可以优先考虑4-VO法。三种4-VO法对应的脑损伤部位存在一定差异,4-VO法脑损伤包含了新皮质以及纹状体,第1种改良版的4-VO法脑损伤包含了白质和丘脑的损伤,第2种改良版4-VO法损伤包含了皮质,故在此提示研究者在进行VCI的机制研究以及药物治疗研究过程中针对损伤部位的不同而对应优选方案。
4.2 2-VO法及其改良模型
2-VO法及其改良模型的机制为脑部缺血性坏死,2-VO术后动物还存在灰质损伤,这也是2-VO手术相对改良版2-VO存在的优势。所示改良版2-VO手术的优点是明显降低术后动物的死亡率。以上提示,对于单纯性缺血性脑损伤(无缺血再灌注)可以优先考虑2-VO手术方案进行建模,若相关研究涉及灰质损伤则优选2-VO法,若研究仅涉及海马和白质,出于术后存活率的考虑,则优选改良版2-VO法进行手术建模。
4.3 mCCAO法
mCCAO的发病机制为脑部缺血性坏死,脑损伤部位包含海马和白质损伤,该手术方案的优势在于可以对于脑缺血的程度进行一定意义上的控制,然而在4~8周后动物的白质损伤存在一定程度的自发逆转,故提示研究者选择该方案时需考虑以上因素。
4.4 BCAS以及SCAS
C57BL/6品系小鼠的后交通动脉发育不良,这与大鼠的解剖结构存在明显差异,这也提示构建小鼠VCI模型对于该疾病研究具有重要意义。BCAS和ACAS小鼠模型的发病机制为脑部缺血性坏死,BCAS模型术后小鼠出现感觉/运动缺陷(即皮质下血管性痴呆的典型特征之一),ACAS满足颈总动脉进行逐渐进行性的狭窄化,更符合人类VCI的发病过程。由此提示广大研究者,尤其是对VCI的疾病的治疗以及病程病理研究感兴趣的学者,在经费充足的前提下可优先选择ACAS和BCAS方案。
5 总结
啮齿类动物的脑白质较少,这与人类大脑的结构表现出的明显的差异性,该特点限制了动物模型在探索人类VCI疾病机制的应用。VCI病因复杂,迄今还未有能够完全复制人类VCI所有特征的动物模型出现。然而在此综述的8种模型对于研究VCI疾病的发生发展以及药物治疗及预防都具有一定的积极意义,是现今应用较为广泛的VCI动物模型。以上动物模型针对模型构建方法不同,实验动物发生的病理损伤也存在差异,研究人员需根据研究目和需求谨慎选择造模方法和手术方案,并在手术过程中注意避免感染、动物麻醉过度等现象,此外,动物伦理相关事项也需注意,在实验观察终点对需实验动物进行安乐死。