人参水提取物中的人参三萜在人肠内菌体外温孵体系的转化研究△
2021-09-06杨秀伟张雷徐嵬郑飞白雪媛陈长宝
杨秀伟,张雷,徐嵬,郑飞,白雪媛,陈长宝
1.北京大学 药学院 天然药物学系/天然药物及仿生药物国家重点实验室,北京 100191;
2.长春中医药大学 吉林省人参科学研究院,吉林 长春 130117
人参Ginseng Radix et Rhizoma 系五加科多年生草本植物人参Panax ginsengC.A.Mey.的干燥根和根茎,为我国传统中药[1],且其种植品被批准为新资源食品[2]。人参药用始载于《神农本草经》,但直到1963 年,对其的研究才真正步入寻找药效物质基础的阶段[3-4]。人参具有抗疲劳、保护心血管和肝脏系统、抗应激、抗诱变、抗氧化、抗糖尿病、抗炎、抗癌等药理活性,尤其是具有适应原样(adaptogenlike)作用,其主要活性成分为人参皂苷(ginsenoside,G)[5-7]。在长期的临床实践中,中医形成了以口服为主的给药途径,中药化学成分吸收进入系统循环之前往往需要在肠内细菌作用下活性化才能更好地发挥作用,这一机制的提出,为基于中药化学成分体内生物转化机制确定中药有效成分和/或毒性成分[8-9],以及通过寻找新药先导化合物研制现代中药开辟了新途径[10]。本实验采用超快速液相色谱-质谱/质谱法(UFLC-MS/MS)研究人参水提取物中的人参三萜(包括人参皂苷及其苷元)在人肠内细菌体外温孵体系的转化。
1 材料
1.1 仪器
岛津LCMS-8050 型超高效液相色谱-质谱仪,包括Nexera X2型UFLC液相系统(LC-30AD型二元泵、SIL-30AC 型自动进样器、SPD-M30A 型检测器和CTO-20AC型柱温箱)、三重四极杆定量质谱[配备电喷雾离子源(ESI)和LabSolution 工作站];Waters ACQUITY UPLC®BEHShield RP18色谱柱(100 mm ×2.1 mm,1.7 μm);WatersACQUITY UPLC®BEH Shield RP18VanGuardTM色谱柱(5 mm × 2.1 mm,1.7 μm);Thermo Scientific 1029 型厌氧培养箱,配有高纯氮气和高纯三联气;XS105DU 型十万分之一电子天平(Mettler Toledo 公司);AR4120 型万分之一电子天平[奥豪斯国际贸易(上海)有限公司];KQ5200型超声波清洗仪(功率200 W,频率40 kHz,昆山市超声仪器有限公司);CV200型真空离心浓缩仪(北京吉艾姆科技有限公司);Milli-Q Advantage A10 型超纯水仪(Millipore公司)。
1.2 试药
人参饮片(批号:PG-Y-201606)购自安国药材市场,经北京大学药学院杨秀伟教授鉴定为人参Panax ginsengC.A.Mey.的干燥根和根茎,凭证样品存放于北京大学药学院天然药物及仿生药物国家重点实验室。
LC-MS 级乙腈和甲醇购自Fisher Scientific 公司;HPLC 级醋酸铵(Sigma-Aldrich 公司);内标地高辛(digoxin,批号:100015-200709,纯度:98.8%,中国食品药品检定研究院);自制超纯水。
对照品20(S)-G-Rh1(1)、20(R)-G-Rh1(2)、G-Rg6(3)、G-F4(4)、G-Rk3(5)、G-Rh4(6)、G-Rg1(7)、20(S)-G-Rf(8)、20(R)-G-Rf(9)、20(S)-三七皂苷R2[20(S)-NG-R2,10]、20(R)-NG-R2(11)、20(S)-G-Rg2(12)、20(R)-G-Rg2(13)、G-Rs2(14)、G-Rs1(15)、G-Rd(16)、NG-R1(17)、G-Re2(18)、GRe(19)、20-glu-G-Rf(20)、西洋参皂苷R1(Q-R1,21)、G-Ro(22)、G-Rb1(23)、G-Rc(24)、G-Rb2(25)、G-Ra2(26)、G-Ra3(27)、G-Rb3(28)[11]、G-Re1(29)、G-Re4(30)、G-Ra1(31)[12]、G-Rs4(32)、20(S)-G-Rs3(33)、20(R)-G-Rs3(34)、NG-R4(35)、G-Rk1(36)、G-Rg5(37)、20(S)-G-Rg3(38)、20(R) -G-Rg3(39)、G-Rg9(40)[11]、20(S) -G-Rh2(42)、20(R)-G-Rh2(43)、20(S)-原人参三醇[20(S)-PPT,44]、20(R)-PPT(45)、20(S)-原人参二醇[20(S)-PPD,46]、20(R)-PPD(47)[13]均为本课题组从红参[11]、生晒参[12]、人参茎叶[13]中得到;对照品竹节参皂苷Ⅳ(CS-Ⅳ,41)、CS-Ⅳa(48)和G-CK(49)购自成都曼思特生物科技有限公司;所有化合物纯度经液相色谱-质谱法(LC-MS)验证均大于98%。以上49个对照品的化学结构式见图1。
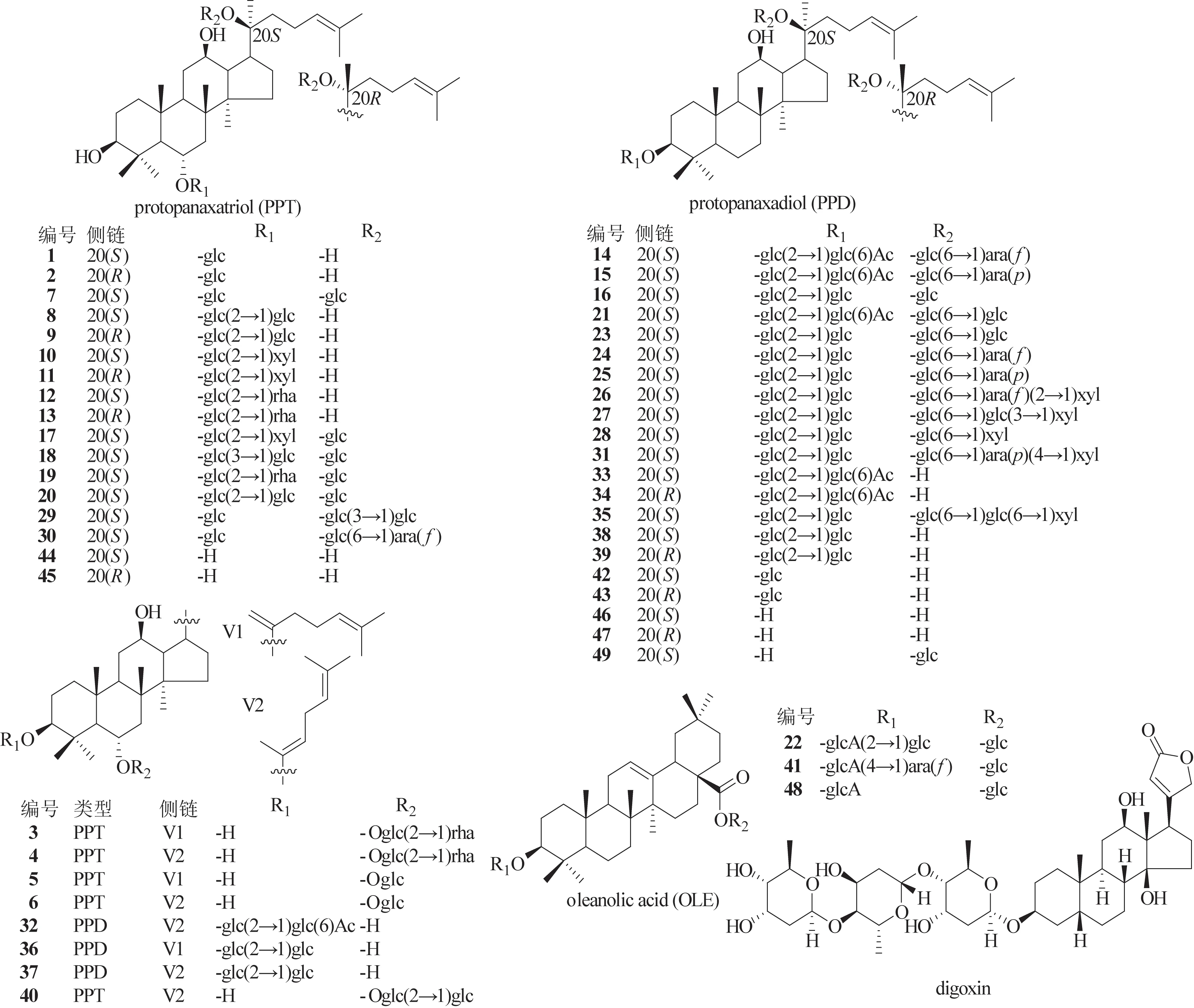
图1 49个人参皂苷和内标地高辛结构
按标准规程[14]制备一般厌氧培养基(GAM),成分为蛋白胨15.0 g·L-1、酵母粉5.0 g·L-1、大豆胨5.0 g·L-1、牛肉粉5.0 g·L-1、葡萄糖5.0 g·L-1、氯化钠5.0 g·L-1、可溶性淀粉3.0 g·L-1、半胱氨酸0.5 g·L-1、磷酸二氢钾2.5 g·L-1、氯化血红素0.005 g·L-1、维生素K10.001 g·L-1。
2 方法
2.1 人参总三萜的制备
称取人参饮片5 g,加入蒸馏水275 mL,加热回流提取2 h,滤过。滤渣再次加入蒸馏水275 mL,加热回流2 h,滤过后合并2次滤液,水浴蒸至约50 mL,加入乙醇100 mL使乙醇体积分数约为65%,4 ℃静置过夜,3000 r·min-1离心10 min(离心半径为11 cm),收集上清液。上清液减压浓缩除去乙醇后冷冻干燥,称定质量,得到人参总三萜(包括三萜皂苷及其苷元)提取物,密封保存。
2.2 对照品溶液的制备
精密称取各对照品适量,溶解于质谱级甲醇中制成质量浓度为1.0 mg·mL-1的对照品储备液,分别移取适量储备液混合并稀释制成混合对照品母液,然后用甲醇连续稀释得到系列质量浓度溶液,浓缩干燥后加入含有灭活肠内细菌的培养基中,加入内标地高辛溶液(1 mg·mL-1)5 μL,再加入乙酸乙酯3 mL,充分涡旋后15 000 r·min-1离心10 min(离心半径为82 mm),分出乙酸乙酯层,用乙酸乙酯重复萃取3 次。用水饱和的正丁醇萃取3 次,每次3 mL。合并正丁醇萃取液,用少量水洗3 次。合并乙酸乙酯和正丁醇萃取液,减压浓缩干燥。残渣加入甲醇1 mL 溶解,15 000 r·min-1离心10 min(离心半径为82 mm),上清液过0.22 μm 微孔滤膜,进行UFLCMS/MS分析。
2.3 厌氧培养基的配制和人肠内菌丛的制备
按操作规程[14],取10 号自封袋,充满氮气,置换掉自封袋内的气体,挤压出气体后再通入氮气。如此重复2 次,再次充满氮气,将志愿者一次排出的所有粪便装入自封袋,封口,并用手挤压自封袋使粪便均质化;通过厌氧箱的置换仓将粪便转移至厌氧无菌操作条件下,取粪便3~5 g,放入配制好的GAM 溶液200 mL 中,加塞封口;置厌氧培养箱中,在37 ℃条件下培养24 h;取出菌液1 mL,加至已装有灭菌GAM 溶液约40 mL 的具塞锥形瓶中,37 ℃条件下活化培养24 h,取出,置于4 ℃冰箱保存,即为人肠内细菌混合菌丛。
2.4 人参总三萜的人肠内细菌生物转化
准确称取2.1 项下人参总三萜提取物0.524 g(折合人参饮片1 g),加入到4 mL蒸馏水中,超声使充分溶解后转移至厌氧培养箱中。分别于10 mL 离心管中加入空白GAM 溶液3 mL、人肠内细菌液0.2 mL 和人参总三萜提取物溶液0.1 mL。密封后转移至摇床,在37 ℃、100 r·min-1温孵培养,分别于0、0.5、1.0、2.0、3.0、4.0、6.0、8.0、12.0、24.0、48.0、72.0 h 取出,加入乙酸乙酯3 mL 灭活,加入内标地高辛溶液(1 mg·mL-1)5 μL,充分涡旋后离心,分出乙酸乙酯层,再次加入乙酸乙酯3 mL,重复萃取3 次。乙酸乙酯萃取完成后加入水饱和正丁醇再萃取3 次,每次3 mL,合并正丁醇萃取液,用少量水洗3 次。合并乙酸乙酯和正丁醇萃取液,减压浓缩干燥。残渣加入甲醇1 mL 溶解,在15 000 r·min-1离心(离心半径为82 mm)10 min,上清液过0.22 μm 微孔滤膜,上样UFLC-MS/MS 系统进行分析。
2.5 UFLC-MS/MS分析方法的建立和方法学考察
2.5.1 色谱及质谱条件 综合考虑分析物质谱优化的结果和生物基质中可能存在的干扰成分的影响,最终选择0.5 mmol·L-1的醋酸铵水溶液(A)和乙腈(B)作为流动相,梯度洗脱(0~3 min,80%~78%A;3~5min,78%~70%A;5~9min,70%~67%A;9~11min,67%~65%A;11~13 min,65%~58%A;13~23 min,58%~53%A;23~24 min,53%~48%A;24~29 min,48%~45%A;29~29.1min,45%~40%A;29.1~34min,40%~35%A;34~36 min,35%~5%A);流速为0.4 mL·min-1;进样体积为1 μL;柱温为30 ℃。
优化后的质谱参数为雾化气流速:3 L·min-1;干燥气流速:10 L·min-1;加热气流速:10 L·min-1;接口加热器温度:300 ℃;脱溶剂管温度:250 ℃;接口电压:-3.0 kV;检测器电压:1.80 kV;电离源为ESI;扫描方式为多反应监测(MRM);扫描模式为负离子模式。
2.5.2 方法学验证 按文献方法分别对分析方法的专属性、线性、定量下限和检测下限、日内和日间精密度及准确度、回收率、基质效应和稳定性进行考察[15]。
3 结果与讨论
3.1 UFLC-MS/MS分析方法的建立
利用单独的对照品溶液分别优化每个分析物的MRM 参数,利用混合对照品溶液进行色谱分离方法优化。49个化合物经过优化后的MRM参数见表1。
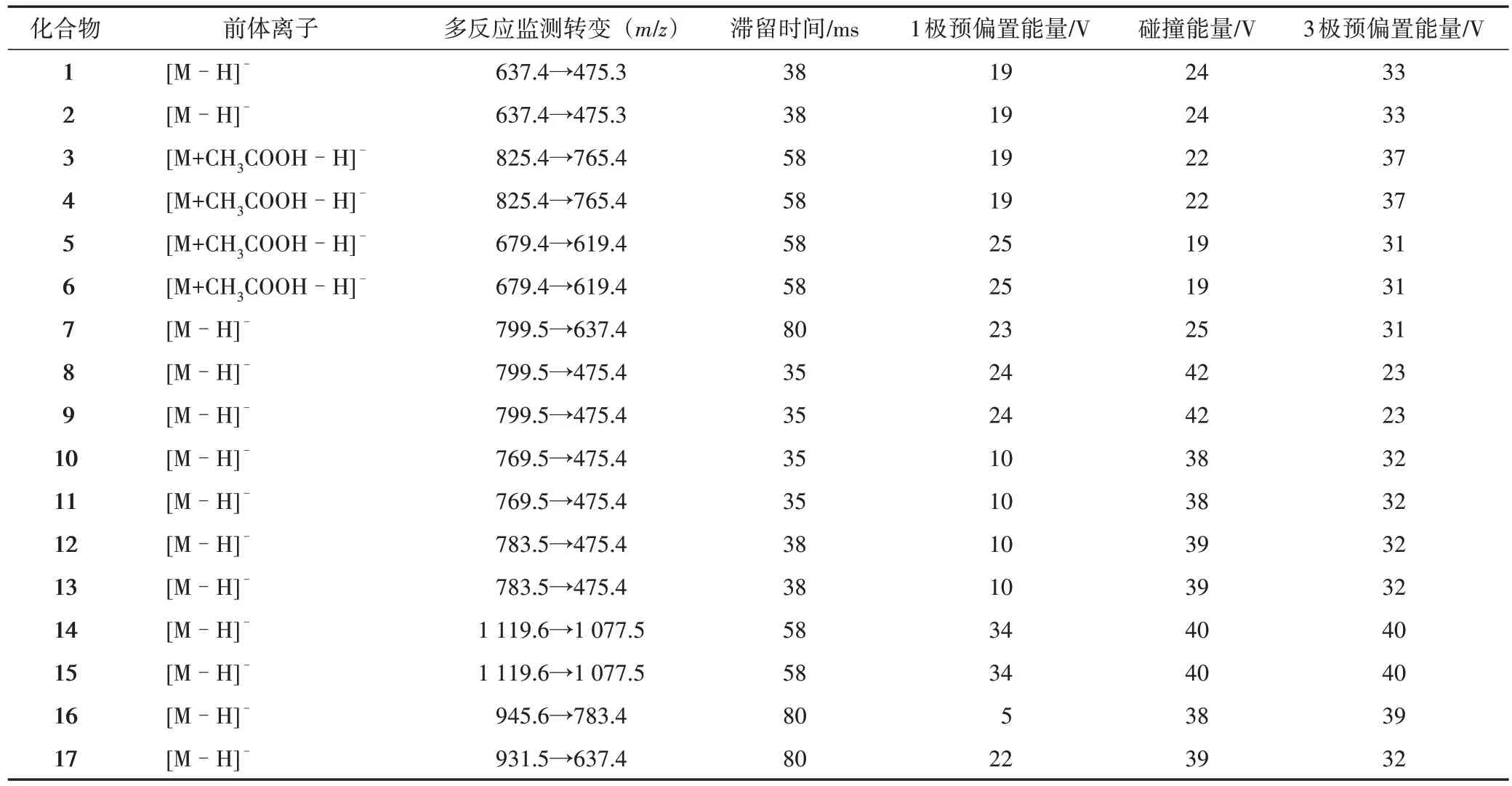
表1 49个分析物和内标地高辛优化后的MRM参数
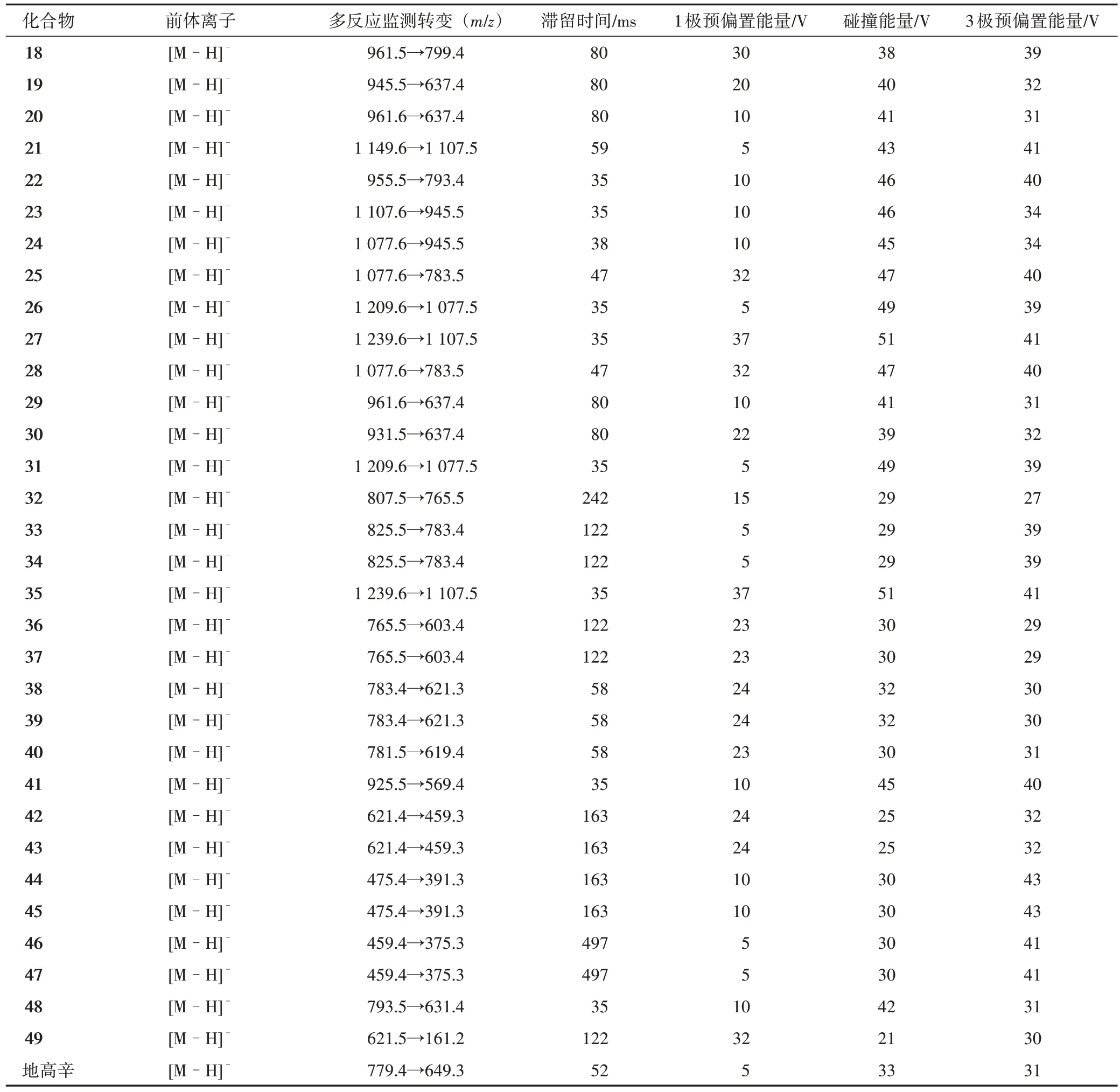
续表1
3.2 UFLC-MS/MS分析方法的方法学验证
经方法学考察,空白基质不会干扰人参皂苷和苷元的定量分析(图2~3),49 个化合物线性、精密度和准确性、回收率和稳定性均符合生物样品分析的要求。

图2 空白基质样品MRM叠加图
3.3 样品前处理方法优化
培养肠内细菌的培养基成分复杂,很容易对色谱柱和分析仪器带来不可逆的破坏。因此,有必要对前处理方法进行优化以保证在保留待测成分基础上尽可能多地去除干扰物质。液-液萃取是比较常用的样品前处理方法,乙酸乙酯和正丁醇是2 种最为常用的萃取溶剂。在最初筛选萃取溶剂时,为尽可能多的去除杂质,只选择乙酸乙酯,以2倍量体积加入,连续萃取6 次,萃取液蒸干后加入甲醇100 μL进行UFLC-MS/MS 分析。结果表明,极性较大的人参皂苷如G-Rb1等得不到满意的回收率。当分别用乙酸乙酯和水饱和的正丁醇萃取3 次时,低极性和高极性的人参皂苷均能被很好地萃取出来。因此选择乙酸乙酯和正丁醇作为萃取溶剂进行样品制备。

图3 对照品溶液中49个分析物和内标地高辛MRM叠加图
3.4 人参三萜的人肠内菌体外温孵生物转化特征研究
3.4.1 不同类型人参三萜在人肠内菌体外温孵转化途径 人参三萜包括人参三萜皂苷(简称人参皂苷)及其苷元。人参皂苷通常含有多个糖基,这些糖基在肠内细菌的糖苷酶作用下会发生水解,生成相应的脱糖基产物。对22 个PPT 型、24 个PPD 型和3 个齐墩果烷(OLE)型人参皂苷及其皂苷元的转化特征及时间-浓度曲线进行研究。PPD 型人参皂苷及其苷元包括G-Rs1、G-Rs2、20(S)-G-Rs3、20(R)-G-Rs3、G-Rs4、Q-R1、G-Ra1、G-Ra2、G-Ra3、G-Rb1、GRb2、G-Rb3、G-Rc、G-Rd、NG-R4、G-Rk1、G-Rg5、20(S)-G-Rg3、20(R)-G-Rg3、20(S)-G-Rh2、20(R)-GRh2、G-CK、20(S)-PPD 和20(R)-PPD;PPT 型人参皂苷及其苷元包括G-Re、G-Re1、G-Re2、G-Re4、20(S)-G-Rf、20(R)-G-Rf、20-glu-G-Rf、G-Rg1、20(S)-GRg2、20(R)-G-Rg2、G-Rg6、G-Rg9、20(S)-G-Rh1、20(R)-G-Rh1、G-Rh4、G-F4、G-Rk3、NG-R1、20(S)-NGR2、20(R)-NG-R2、20(S)-PPT 和20(R)-PPT;OLE 型人参皂苷包括G-Ro、CS-Ⅳ和CS-Ⅳa。根据各人参皂苷在肠内细菌作用下的含量变化趋势和相关文献,分别总结出了PPD、PPT 和OLE 型人参皂苷在肠内细菌作用下的转化途径。
以G-Ra1、G-Ra2、G-Ra3为例,PPD类型人参皂苷在人肠内细菌作用下可能的转化途径见图4。G-Rb3脱糖基转化为G-Rd,可再转化为G-Rg3、G-Rh2、PPD、G-Rg5和G-Rk1。苷元C-3 糖链末端葡萄糖基的C-6 结合乙酰基的G-Rs1和G-Rs2由酯解酶作用下转化为G-Rd,此后依图4 所示转化;而G-Rs3由酯解酶作用下转化为G-Rg3,此后依图4所示转化。
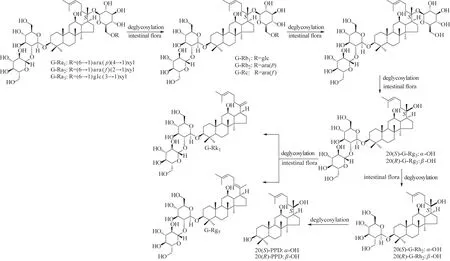
图4 PPD类型人参皂苷在人肠内细菌作用下可能的转化途径
以G-Re 为例,PPT 类型人参皂苷在人肠内细菌作用下可能的转化途径见图5。OLE型人参皂苷在人肠内细菌作用下可能的转化途径比较简单,见图6。
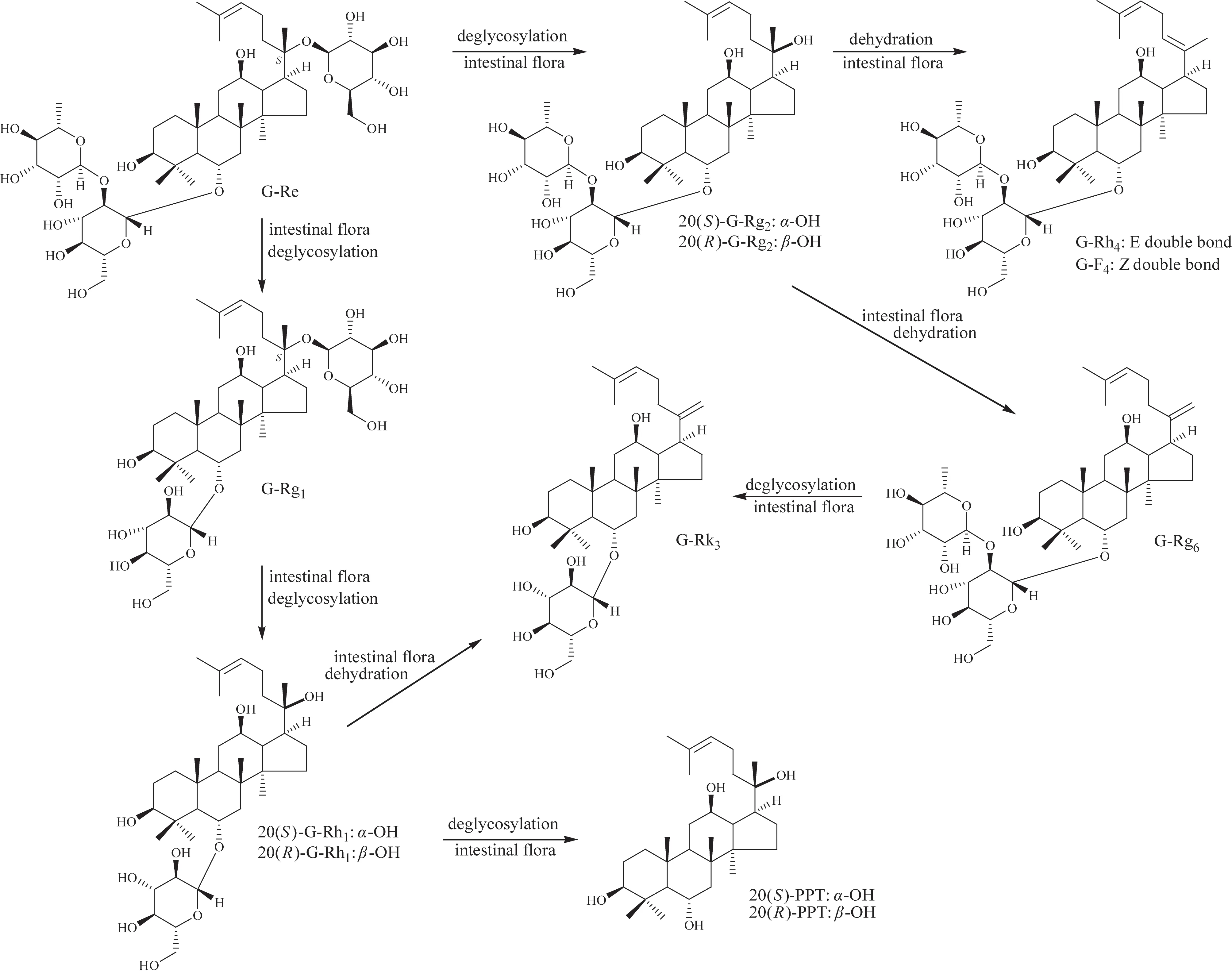
图5 PPT型人参皂苷在人肠内细菌作用下可能的转化途径

图6 OLE型人参皂苷在人肠内细菌作用下可能的转化途径
3.4.2 不同类型人参三萜在人肠内菌体外温孵转化特征 利用内标法计算单个人参皂苷在每个时间点的含量,结果见表2。当肠内细菌和人参三萜同时加入,2 h 内几乎所有化合物均较为稳定。2 h 后大部分成分的含量开始迅速变化,同时温孵液明显浑浊,表明肠内菌生长和人参三萜转化随之进行。所有人参皂苷,无论是PPD、PPT 型还是OLE 型,其整体的变化趋势均为随温孵时间延长,含糖基较多的皂苷含量逐渐下降,同时含糖基较少的皂苷含量逐渐上升。根据含量测定结果可知,不同类型的人参皂苷在转化能力方面有非常明显的差异。整体来说,PPD 型人参皂苷转化程度较PPT 型要高;OLE型人参皂苷也会在肠内细菌作用下发生明显转化;连有乙酰基的人参皂苷更容易在肠内菌作用下水解。与加入初期相比,经过72 h 温孵后其含量上升超过30%的化合物包括G-Rd、20(S)-G-Rh2、20(R)-G-Rh2、20(S)-PPT、20(R)-PPT、20(S)-PPD、20(R)-PPD、GCK 和CS-Ⅳa。其中20(S)-G-Rh2、20(S)-PPD 和G-CK的含量变化最为明显,尤其是G-CK的含量变为初始值的80 倍。除G-Rd 外,这些化合物均为低极性人参皂苷或皂苷元。这表明,在肠内菌丛的作用下,人参皂苷非常容易脱去糖基生成G-CK 以及几个苷元,而这些转化产物不仅吸收能力更强,体内外实验也证明其具有着更好的生物学活性。经过72 h 温孵质量分数下降超过30%的化合物包括20(S)-G-Rf、G-Rg1、G-Rs1、G-Rs2、20(S)-G-Rs3、20(R)-G-Rs3、GRs4、NG-R1、NG-R4、G-Re、G-Re1、G-Re2、G-Re4、Q-R1、G-Ro、G-Rb1、G-Rb2、G-Rb3、G-Rc、G-Ra1、G-Ra2、G-Ra3、G-Rk1和CS-Ⅳ。从这些化合物的结构来看,其往往含有多个糖基,这些糖基容易在肠内菌作用下水解脱去,最终形成对应的次级苷或者苷元。
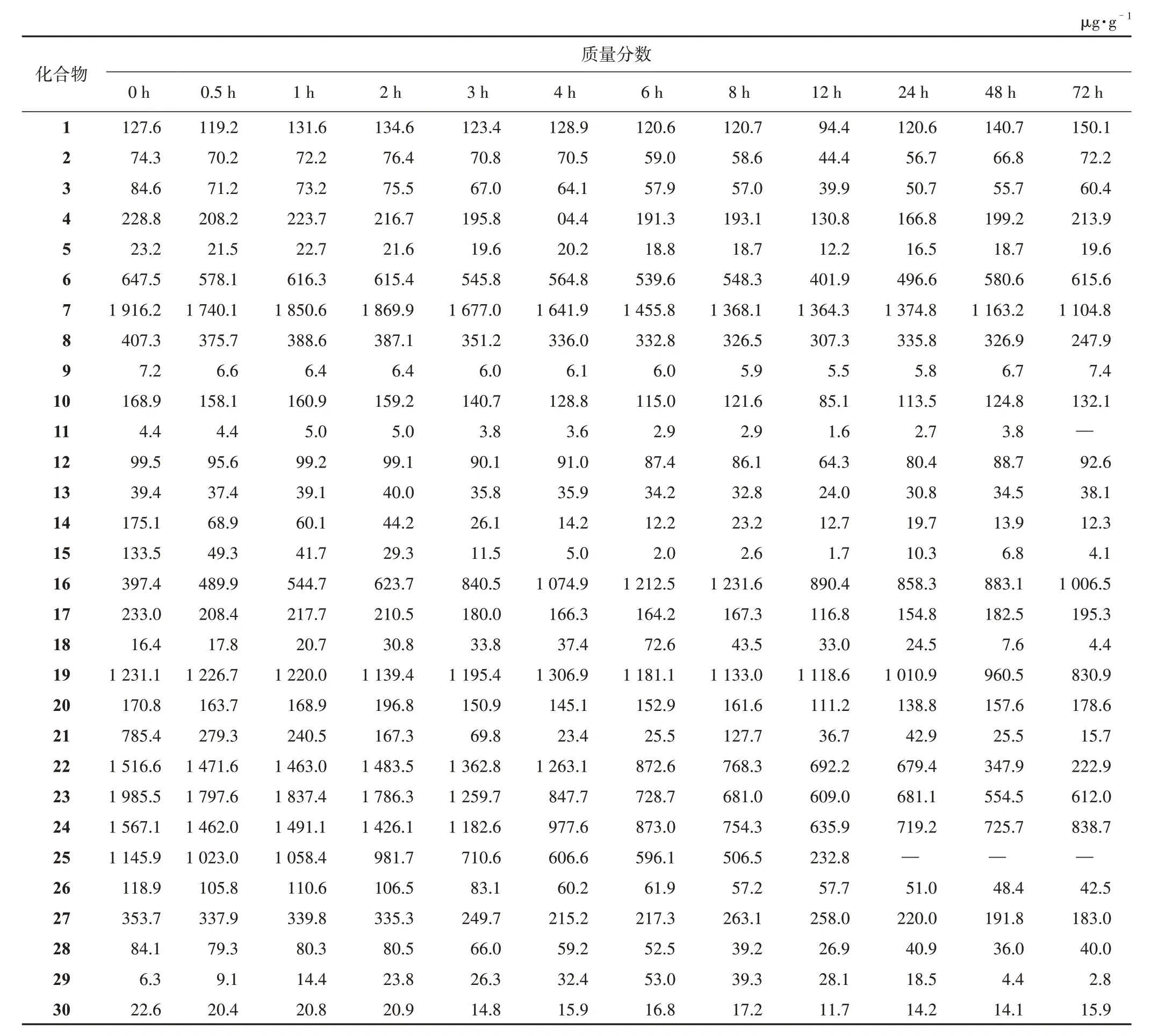
表2 人参三萜提取物中49个成分的人肠内细菌体外温孵过程中的质量分数
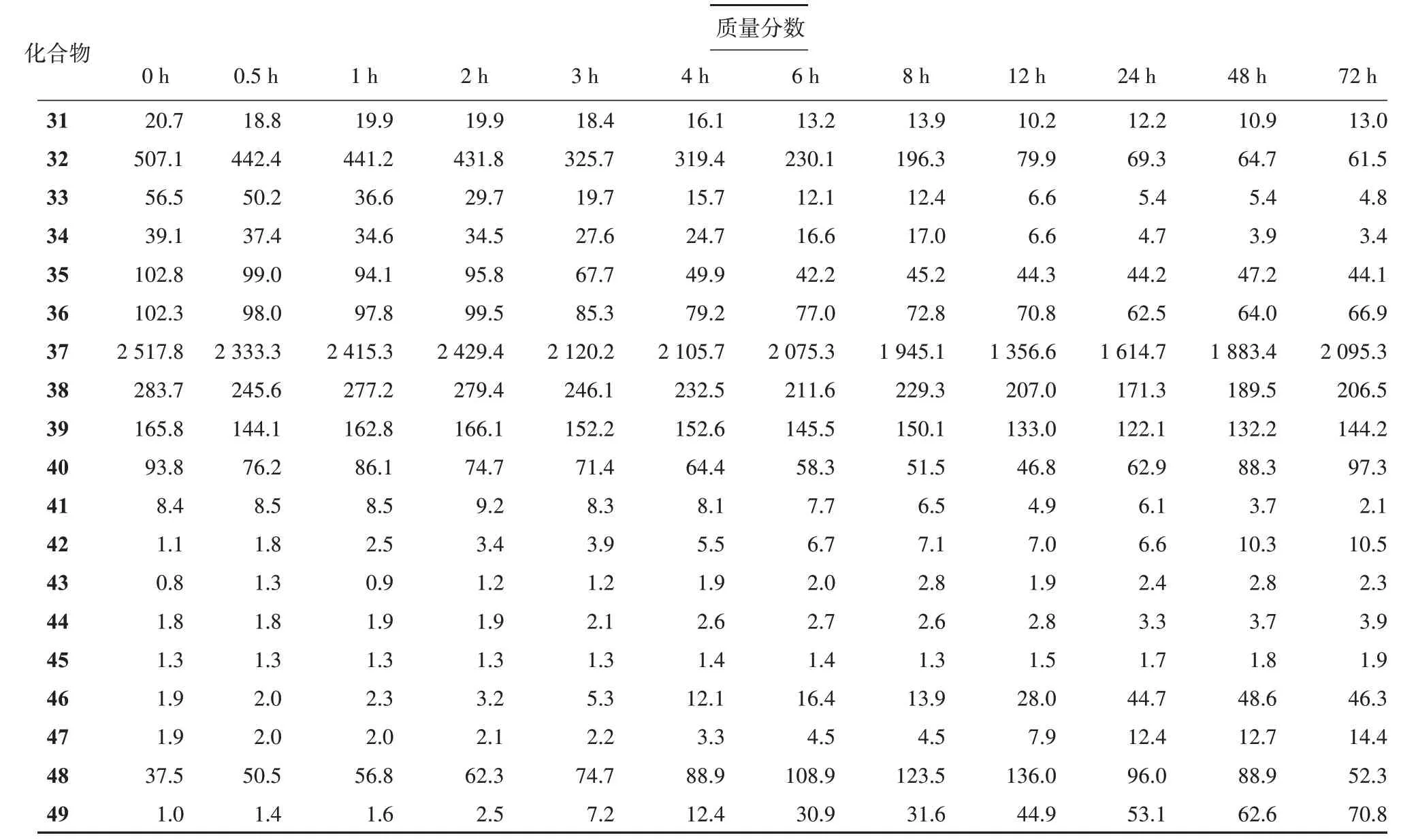
续表2
几个带有乙酰基的人参皂苷质量分数下降非常迅速,G-Rs1、G-Rs2、Q-R1等连有糖基较多的化合物下降更为明显,在6~8 h 时基本已经降到初始质量分数的10%左右。几个连糖基较少的皂苷如G-Rs4、20(S)-G-Rs3、20(R)-G-Rs3质量分数下降相对较缓,在12 h 左右才基本不再变化。可能的原因是连有乙酰基的化合物在肠内菌的作用下会同时发生脱乙酰基和脱糖基反应,此三者会在转化过程中不断的生成和消耗,最终表现为含量缓慢下降。
PPD 型人参皂苷含量下降非常明显,到72 h 时大部分化合物的质量分数均下降了50%以上,表明肠内菌中的酶更容易与PPD 型人参皂苷发生作用,使其发生水解。从图4 可以看出,G-Rd 是肠内菌水解人参皂苷过程中非常重要的中间产物,其含量随着时间具有明显的波动性变化。从图7 可以看出,在最初的时候G-Rd的水解生成占据主导地位,其含量明显上升,到8 h时含量达到最高。而随着其他化合物转化生成的逐渐减少以及G-Rd进一步转化的增加,其含量开始缓慢下降或者波动。但即使72 h 以后,G-Rd的含量仍然是初始值的2倍以上。说明G-Rd在体内滞留时间长,发挥药效作用不容小视。

图7 人参提取物中G-Rd的人肠内菌体外温孵含量-时间曲线
此外,还有2 个比较特殊的人参皂苷为G-Re1和G-Re2,两者均为PPT 型皂苷。这2 个化合物的含量变化和G-Rd 相似,均为先上升后下降,在6 h 时含量达到最高点(图8)。而结构类似的G-Re 和G-Re4则没有这一特点。比较2 类化合物的结构差异,发现G-Re1和G-Re2的糖基只有葡萄糖基,而G-Re 和G-Re4除葡萄糖基外还含有其他类型的糖基。结果表明,人参提取物中可能存在一类与G-Re1、G-Re2结构类似但连有更多的糖基、乙酰基或丙二酰基的PPT 型人参皂苷,在肠内菌的作用下某些基团被水解生成G-Re1和G-Re2。同时这2 个化合物本身极性也较大,会在肠内菌作用下发生进一步水解。
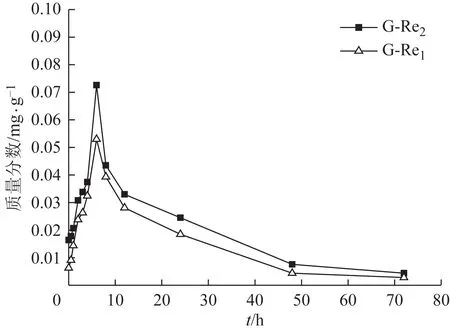
图8 人参提取物中G-Re1和G-Re2的人肠内菌体外温孵含量-时间曲线
此外,随着温孵时间的延长,3个OLE型人参皂苷的含量也变化明显,G-Ro 在前4 h 变化比较缓慢,从6 h开始含量逐渐下降,72 h时含量下降已十分明显。CS-Ⅳ的含量持续降低,从12 h 开始明显下降。CS-Ⅳa含量则有明显的先升后降过程,其含量在前几个小时逐渐上升,至12 h达到顶点,后续则开始逐渐下降。这与G-Rd 的转化特征较类似。根据结构可知,CS-Ⅳa 可由G-Ro、CS-Ⅳ以及其他OLE 型皂苷转化生成,因此其含量表现出了随时间波动的特点。
从以上结果可以看出,在人肠内菌丛作用下,各人参皂苷的初始质量浓度并不能代表其实际在肠道中被吸收时的质量浓度,某些化合物的含量在肠内菌的作用下会发生显著的变化。通过生物转化,部分人参皂苷的含量提高,如化合物G-Rd、G-CK、PPD 和PPT 等低极性人参皂苷和皂苷元。因此,即使这些化合物在生药人参中初始含量极低,在口服给药后仍能在动物体内大量检测到。值得一提的是,动物体内不管是在肠内菌种类上还是在数量上均会明显高于体外模型,优势菌的种类也会有所不同。因此,在体模型中人参皂苷的转化会更为明显。
4 结论
本研究利用UFLC-MS/MS,对人参三萜提取物中49个化合物在人肠内菌作用下的转化特点和时间-含量变化曲线进行了研究。人参三萜在人肠内菌作用下会发生明显的生物转化,根据总结得到的PPT、PPD 和OLE 型人参三萜的转化途径可知脱糖基水解是人参三萜(人参皂苷)在肠内菌液中最主要的转化方式,其次还可能伴有脱水以及异构化。转化最后绝大多数高极性人参皂苷含量明显降低,同时会生成大量具有良好药理活性的G-CK、PPD 和PPT 等低极性人参皂苷和皂苷元。此外,发现PPD 型人参皂苷在人肠内菌丛作用下的转化能力最强,PPT 型人参皂苷则相对较弱,OLE 型人参皂苷也有比较明显的转化趋势。当人参皂苷分子上再连有乙酰基后,其在肠内菌作用下的转化能力大大增加。
