苦水玫瑰ITS及ITS2序列分析与鉴别△
2021-09-06张平黄聪琳王晓琳马潇杨平荣郑健
张平,黄聪琳,王晓琳,马潇*,杨平荣,郑健
1.甘肃省药品检验研究院,甘肃 兰州 730070;
2.甘肃省中藏药检验检测技术工程实验室,甘肃 兰州 730070;
3.甘肃省中医院,甘肃 兰州 730050;
4.中国食品药品检定研究院,北京 100050
苦水玫瑰Rosa rugose‘Kushui’属蔷薇科蔷薇属多年生常绿或落叶灌木,是中国玫瑰和钝齿蔷薇的杂交品种,因产地甘肃永登苦水镇而得名,是一种具有药食两用价值的天然植物[1]。玫瑰花蕾低温干燥用作玫瑰花茶,气芳香浓郁,具有行气解郁、消除疲劳、消炎杀菌、调节体质、润泽肌肤等功效。苦水玫瑰作为药食两用的植物,有必要提高其质量标准,以保证使用上的准确和安全。
分子生物学技术的不断发展为药材鉴定提供了新的思路,DNA 条形码技术的应用有利于药食两用植物的准确鉴定。本研究按照《中华人民共和国药典》2020 年版四部附录9107“中药材DNA 条形码分子鉴定法指导原则”[2],对苦水玫瑰、平阴玫瑰R.rugosaThunb.、月季R.chinensisJacq.、金边玫瑰R.Jinbian、法兰西玫瑰R.gallicaL.的内转录间隔区(ITS)及ITS2 序列进行研究分析[3],并以玫瑰对照药材作为参照物,利用苦水玫瑰序列的差异性对其进行鉴别,以期从分子水平全面了解苦水玫瑰的序列特征,与其他玫瑰品种进行区分,为培育玫瑰花优良品种提供参考。
1 材料
1.1 样品与试剂
样品采自中国甘肃、山东、云南及台湾,由甘肃省药品检验研究院马潇主任药师鉴定,具体信息见表1。
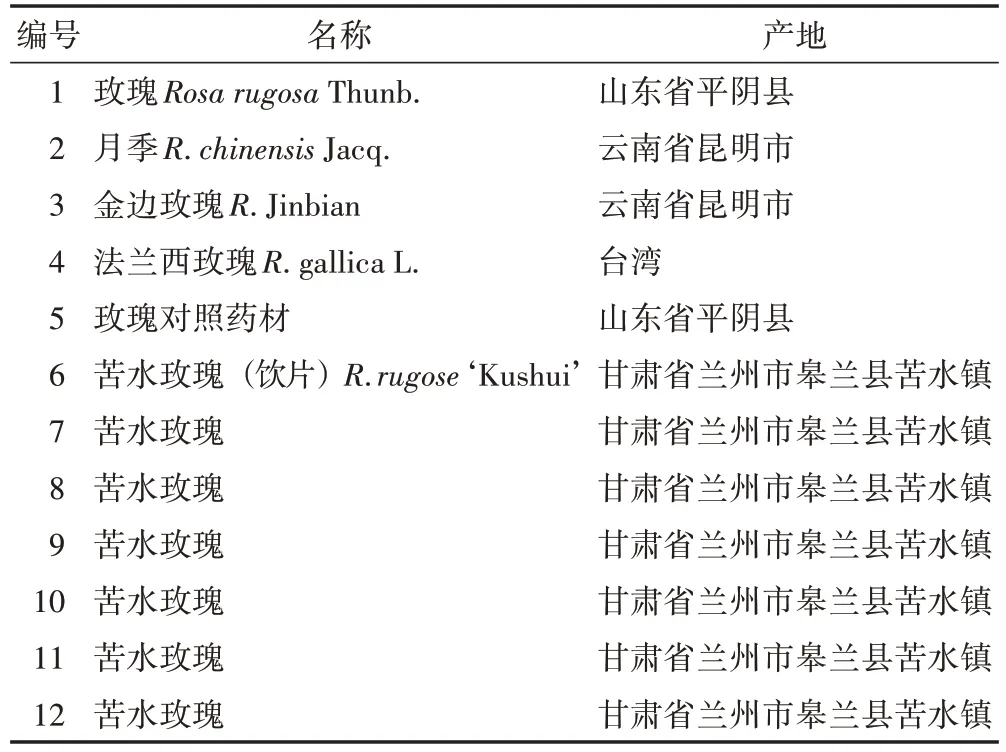
表1 样品信息
植物基因组DNA 提取试剂盒、2×TaqMaster Mix、定量Marker(北京天根生物技术有限公司);引物由上海捷瑞生物工程有限公司合成。
1.2 仪器
8000M 型高能量球磨机(美国Spex 公司);Veriti型梯度聚合酶链式反应(PCR)仪、3730XL型测序仪(美国ABI 公司);JY600C 型水平电泳仪(北京君意东方电泳设备有限公司);ZF-388 型全自动凝胶成像系统(上海嘉鹏科技有限公司);MS205DU型十万分之一分析天平(瑞士梅特勒公司);Pacific RO 型纯水仪、Nano Value8000型多样品-微量紫外分光光度计(赛默飞世尔公司);Codon Code Aligner 3.7.1序列拼接软件(美国Codon Code公司)。
2 方法
2.1 样品总DNA的提取
称取供试品20 mg,每个供试品平行取样2 份,利用天根植物基因组DNA 提取试剂盒提取样品总DNA。微量紫外分光光度计测定DNA浓度。
2.2 PCR反应扩增
ITS 序列扩增引物正向为ITS4:5'-TCCTCCGCTTATTGATATGC-3',反向为ITS5:5'-GGAAGTAAAAGTCGTAACAAGG-3';ITS2 序列扩增引物正向为ITS2F:5'-ATGCGATACTTGGTGTGAAT-3',反向为ITS3R:5'-GACGCTCTCCAGACTACAAT-3'。采用20 μL 反应体系,包括DNA 模板3 μL(1 μL 约50 ng)、2×TaqMaster Mix 缓冲液10 μL、正反向引物各0.4 μL 及灭菌ddH2O 6.2 μL。阴性对照不加模板DNA,以灭菌ddH2O 补足体积。扩增程序:95 ℃预变性4 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min;35个循环;72 ℃延伸7 min,4 ℃保存。
2.3 琼脂糖凝胶电泳检测
配制50×TAE缓冲液(称取Na2EDTA·2H2O 37.2 g、Tris242g于1 L烧杯中,加入800 mL的去离子水,充分搅拌溶解。再加入冰醋酸57.1 mL,充分混匀。加去离子水定容至1 L,室温保存),稀释50 倍得到1×TAE 工作液。制备含显色剂ExRed(1∶10 000)的1.5%琼脂糖凝胶,放入水平电泳槽,添加1×电泳缓冲液至没过胶板,琼脂糖凝胶点样槽内加入扩增产物3 μL。设置电压5 V·cm-1,进行电泳,当溴酚蓝移动到距离胶板下沿约2 cm 处时,停止电泳。经凝胶成像系统观察电泳结果并拍照保存。
2.4 PCR扩增产物测序
对照DNA Marker,将电泳结果显示相对分子质量正确的单一明亮条带的扩增产物送英潍捷基(上海)贸易有限公司进行测序。
2.5 数据处理
测序结果使用Codon Code Aligner 3.7.1 软件校对拼接,去除引物区段,使用基于隐马尔可夫模型的HMMer 注释方法[4],去除两端5.8S 和28S 区段,获得ITS2 序列。将拼接好的序列于GenBank 上进行比对分析。
利用MEGA 5.0 软件基于Kimura 双参数模型(Kimura-2-parameter,K2P)计算种内及种间遗传距离,进行barcoding gap分析。
利用MEGA 5.0 软件基于K2P 模型,采用临接法(neighbor-joining,NJ)构建系统发育树,使用1000 次重复检测的Bootstrap 值表示树上各节点的支持率。
3 结果与分析
3.1 电泳结果
取样品提取DNA 片段,因受到色素等杂质的影响,提取效果不理想,故将样品分为花瓣和花梗分别粉碎取样分析,结果表明,花梗类样品提取的DNA 片段更佳,所受到的干扰小,故选择用花梗粉末提取DNA 片段,扩增后电泳。为了数据准确性,平阴玫瑰、月季、金边玫瑰、法兰西玫瑰均提取了2 份DNA 片段进行电泳分析,玫瑰对照药材因只有粉末故只提取了1 份,苦水玫瑰按表1 提取了7 份。玫瑰采集样品与对照药材ITS 和ITS2 序列的电泳结果见图1~2,均显示为单一条带。ITS 和ITS2 图中部分电泳点颜色较浅,可能是样品间存在差异,或提取DNA片段时杂质干扰使片段不纯。
3.2 ITS序列测序结果
电泳检测结果显示,ITS引物的扩增产物片段大小接近750 bp(图1),ITS2 引物的扩增产物片段大小接近500 bp(图2)。ITS引物的扩增产物片段大于ITS2 引物,理论上ITS 引物的扩增产物携带更丰富碱基信息和鉴别位点,更适用于区分不同玫瑰品种。但是,测序结果显示,ITS引物扩增产物中大部分样品的测序结果双峰严重,无法有效拼接(图3),可用数据量低,含不确定性碱基比例高,因此无法根据ITS 序列对苦水玫瑰及参考物种进行序列比对与分析。
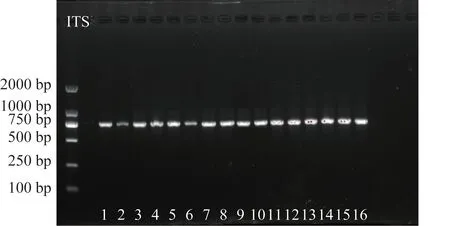
图1 样品ITS序列的PCR扩增电泳图
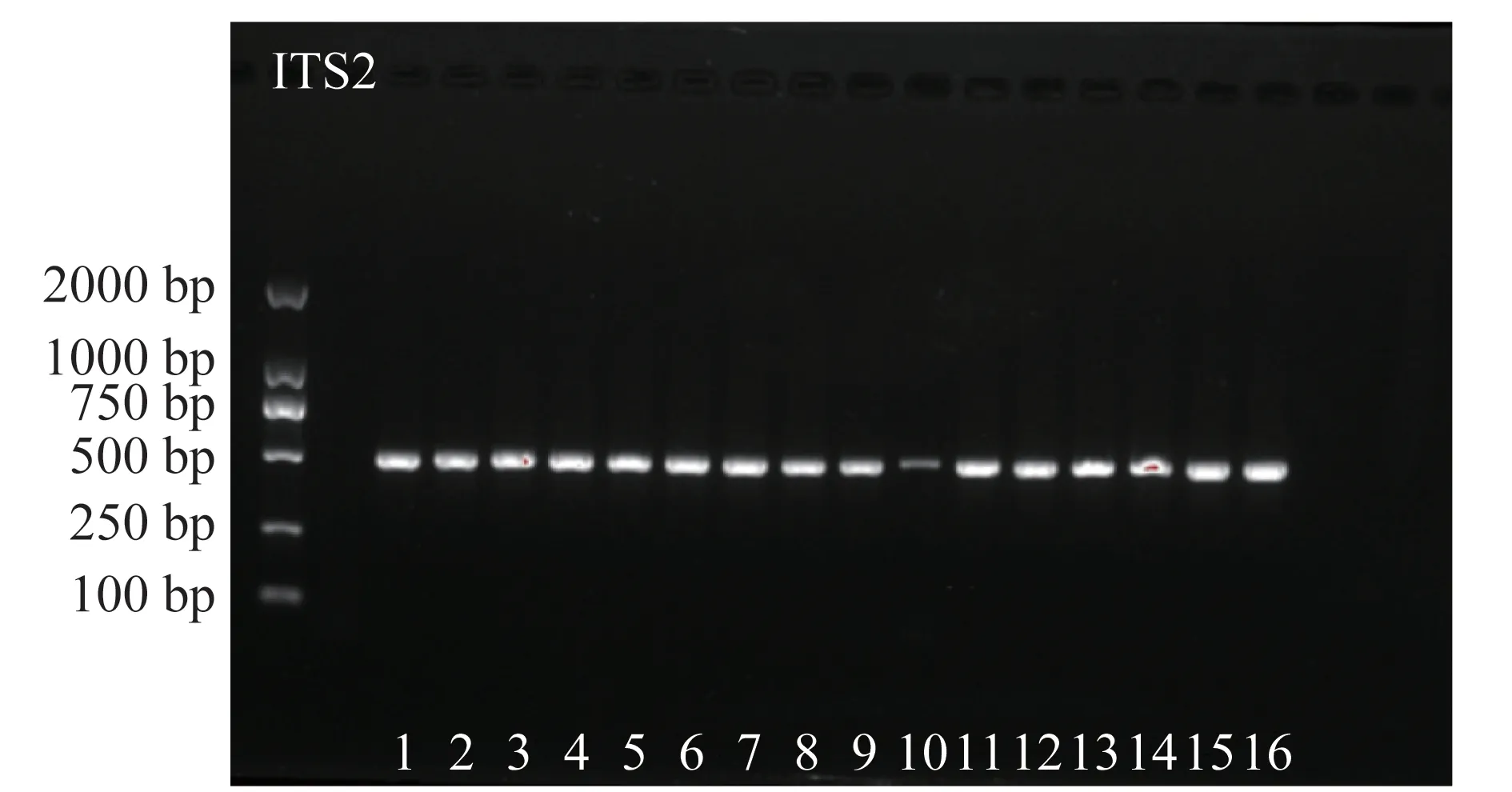
图2 ITS2序列的PCR扩增电泳图
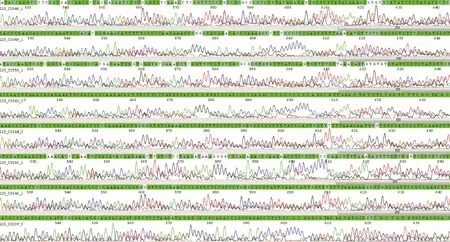
图3 6号苦水玫瑰样品ITS引物扩增产物的测序峰图
3.3 ITS2序列分析
3.3.1 ITS2 变异位点分析 测序序列使用Codon Code Aligner 3.7.1 软件校对拼接,去除两端5.8S 和28S 区段后,获得的ITS2 序列位点信息见图4~5。7 个苦水玫瑰样品获得了2 个ITS2 单倍型,分别为6 和8 序列,存在1 个变异位点。苦水玫瑰与其他样品ITS2 序列长度均为213 bp,且物种序列相近。苦水玫瑰与玫瑰及玫瑰对照药材存在1~2 个变异位点,与金边玫瑰和法兰西玫瑰存在2~3 个变异位点,主要变异区在156~208 bp,见表2。

表2 样品ITS2变异位点分析
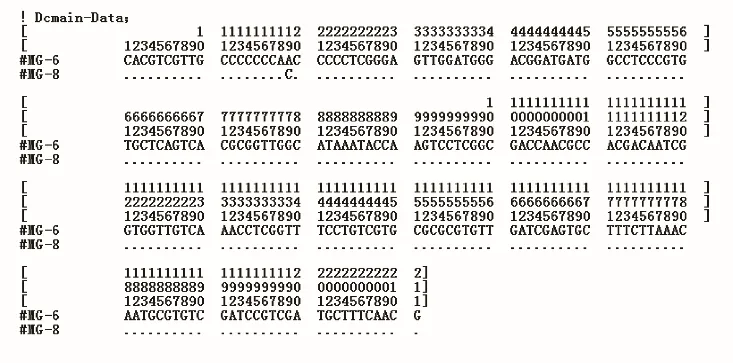
图4 苦水玫瑰变异位点
3.3.2 ITS2 遗传距离分析 苦水玫瑰6 与各物种间的平均遗传距离为0.006 74,苦水玫瑰8 与各物种间的平均遗传距离为0.011 58。苦水玫瑰种内遗传距离为0.004 80,苦水玫瑰与法兰西玫瑰和金边玫瑰的遗传距离最远,其中苦水玫瑰8 与法兰西玫瑰和金边玫瑰的遗传距离达0.014 51。苦水玫瑰6 与玫瑰对照药材、玫瑰和月季序列的遗传距离最近,仅为0.004 81,接近苦水玫瑰的种内遗传距离,见表3。
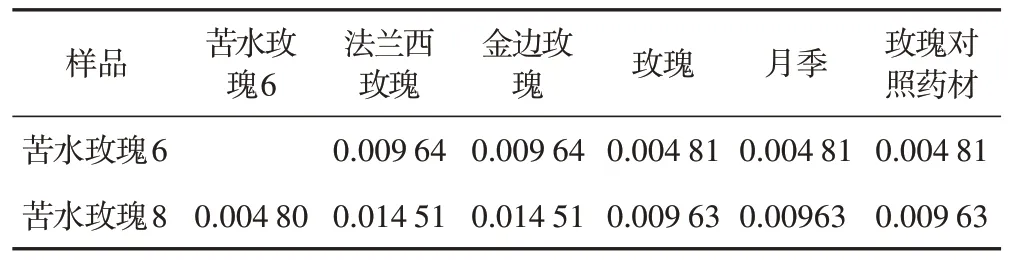
表3 样品ITS2遗传距离分析

图5 苦水玫瑰与其他物种比较的变异位点
3.3.3 ITS2序列NJ树聚类分析 利用MEGA 5.0软件对苦水玫瑰样品的ITS2 序列分析比对,邻接法进行聚类分析。聚类分析结果显示,不同种有明显区分,不同物种各聚为1 支,其中玫瑰和玫瑰对照药材的遗传距离相对接近,聚为1支。而2条苦水玫瑰序列种内存在1 个变异位点,使其分为2 个单支,见图6。

图6 基于ITS2序列构建的不同品种玫瑰的NJ系统聚类树
4 讨论与结论
被子植物的ITS 序列长度通常为600~700 bp,在具有高度保守性和稳定性的同时,又有一定的变异性,能够提供丰富的系统学信息。基于ITS 序列等分子标记的DNA 条形码鉴定是直接根据物种基因DNA 的多态特征进行的分子鉴定,ITS 序列种内差异<1%,种间差异为1.2%~10.2%,属间差异为9.6%~28.8%[5-10]。本研究中,苦水玫瑰及参考物种的ITS 序列测序结果双峰严重,无法进行序列比对与分析。
ITS2 序列相比于ITS 序列具有片段短、易扩增、易测序等优点,对于DNA 已有降解的药材也有较高的扩增成功率。Chen 等[11]基于6600 余个药用植物样本 对matK、rbcL、trnH-psbA、rpoC1、ycf5、ITS1、ITS2 序列进行对比研究,结果表明,ITS2 序列的种间准确鉴定率最高,达到92.7%,因此提出将ITS2作为药用植物的DNA条形码候选序列。
ITS2序列长度短,大多为200~300 bp,扩增效率高,序列高度保守又具有适合的变异度,本研究收集的部分样本为饮片,饮片的炮制加工可能会导致样本DNA 的降解,严重影响PCR 扩增效率,因此,选择序列长度较短的ITS2序列构建系统聚类树。
实验用平阴玫瑰与对照药材的ITS2 序列的质量最高,且序列完全一致,苦水玫瑰的主要序列(序列6 和8)与平阴玫瑰及玫瑰对照药材相比存在1~2个变异位点,月季、法兰西玫瑰与平阴玫瑰及玫瑰对照药材相比存在≥2个变异位点。
苦水玫瑰及其他同属物种样品的ITS2 序列相较于ITS 序列更易获得,且具有相对保守的二级结构,在物种鉴定中具有优势。对不同品种玫瑰ITS2 序列的变异位点、遗传距离和NJ 树聚类等分析表明,利用ITS2 序列能够有效区分平阴玫瑰、苦水玫瑰、月季、法兰西玫瑰的样品。
本研究利用DNA 条形码鉴定的方法进一步完善了苦水玫瑰的质量标准,为市场中药材及其混伪品的鉴别提供参考,同时为探讨其他物种间的亲缘关系提供了新的思路。
