肝动脉化疗栓塞联合阿帕替尼治疗中晚期肝细胞癌的疗效及对血清HSP90a及AFP的影响
2021-09-06余海涛杨惠芳姜之明
余海涛,杨惠芳,姜之明
原发性肝癌约90%以上为肝细胞癌(HCC),其发展迅速、易发生转移、预后较差,且早期症状较为隐匿,大部分患者就诊时已属中晚期[1]。手术治疗是原发性肝癌最主要的治疗方式之一[2],而伴随着科技的发展,肝动脉化疗栓塞术(TACE)的疗效也得到临床肯定[3],但TACE 并不能使肿瘤病灶完全坏死,残留肿瘤通过血管形成并建立侧支循环,易导致复发或转移,影响患者的远期疗效[4]。阿帕替尼作为一种新型口服小分子抗血管生成药,其能高度选择性抑制血管内皮生长因子受体-2(VEGFR-2)。既往研究表明,TACE 联合阿帕替尼治疗中晚期HCC的疗效优于单独使用TACE治疗,本研究采用TACE联合阿帕替尼治疗中晚期HCC,拟观察其疗效及对相关肿瘤标志物水平的影响,报道如下。
1 资料与方法
1.1 一般资料 收集2016 年1 月至2017 年9 月浙江省兰溪市人民医院收治的中晚期HCC患者68例,纳入标准:(1)诊断符合《原发性肝癌规范化病理诊断指南》[5](2015 年);(2)巴塞罗那肝癌临床分期(BCLC)为B 期或C 期;(3)肝功能Child-Pugh 分级A 级或B 级;(4)Karnofsky评分>60 分;(5)预计生存期>3 个月;(6)未接受其他抗肿瘤治疗;(7)无法接受外科手术或拒绝接受外科手术切除的患者;(8)自愿参加本研究并签署知情同意书,同时报医院伦理委员会批准通过。排除标准:(1)具备化疗禁忌证者;(2)合并其他恶性肿瘤者;(3)既往接受过化疗者;(4)本研究药物存在禁忌证者;(5)近期内有感染或手术史者;(6)严重凝血功能障碍者;(7)心、肝及肾等重要器官严重功能不全或障碍者;(8)大量腹水或顽固性腹水者;(9)自身免疫疾病及全身疾患者;(10)伴有远处转移者;(11)动脉-门静脉、肝静脉瘘、门静脉主干或左、右主干癌栓者;(12)妊娠期或哺乳期妇女。
采用随机数字表法分为观察组及对照组,各34例。观察组男20例,女14例;年龄40~65 岁,平均(56.3±5.3)岁;Child-Pugh A 级19例,B 级15例;Karnofsky 评 分 70~ 80 分,平 均(76.44±5.68)分;BCLC分期B期22例,C期12例;其中乙型病毒性肝炎18例,酒精性脂肪肝14例,其他2例。对照组男22例,女12例;年龄40~66 岁,平均(57.1±6.1)岁;Child-Pugh A 级20例,B 级14例;Karnofsky 评分70~80 分,平均(75.27±6.03)分;BCLC分期B期23例,C 期11例;其中乙型病毒性肝炎16例,酒精性脂肪肝15例,其他3例。两组一般资料具有均衡性(>0.05),有可比性。
1.2 方法 两组均接受术前常规影像学检查以明确肿瘤大小,并行常规实验室检查,术前禁水、禁食8 h,建立静脉输液道,保证术中心电监护。
对照组行TACE 治疗:患者取平卧位,采用碘伏常规消毒后采用Seldinger法行股动脉穿刺,插入导管成功后进行肝动脉造影,并经导管灌注表柔比星(浙江海正药业股份有限公司,国药准字H20041211,5 ml∶10 mg)40 mg,然后在肿瘤供血动脉插入微导管,并经微导管注入碘化油(上海旭东海普药业有限公司,国药准字H31021603,10 ml)3~5 ml 进行栓塞。术后予以止吐、保肝及抑酸等常规对症处理。
观察组在对照组治疗基础上予以口服阿帕替尼(江苏恒瑞医药股份有限公司,国药准字H20140103,0.25 g)治疗,于TACE 治疗后第2 天开始服用,500 mg/次,1 次/d,直至下一周期TACE术前停药,并于TACE术后第2 天继续服用。
1.3 观察指标(1)疗效。于首次TACE术后6 个月对患者行疗效评价,两组患者均行增强CT 检查,依据实体瘤疗效评价标准,分完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)及疾病进展(PD)。疾病控制率(CDR)=(CR+PR+SD)/总例数×100%,有 效 率=(CR+PR)/ 总例数×100%。(2)肿瘤标志物。治疗前及治疗后6 个月均于清晨抽取空腹静脉血3~5 ml,采用ELISA 方法检测两组血清热休克蛋白90(HSP90 )及甲胎蛋白(AFP)水平。(3)生活质量。采用欧洲癌症研究和治疗协作组编制的癌症患者生活质量评估量表(EORTC QLQC30)[6]评价,该量表从躯体功能、角色功能、情绪功能、认知功能、社会功能以及总体健康状况等6 个方面予以评估。(4)生存分析。首次TACE 术后采用电话随访的方式对两组患者进行为期1.5 年的随访,每3 个月进行1 次,以患者发展至疾病进展或随访截止时间为随访终点,比较两组的无进展生存期(PFS)。(5)不良反应。比较两组在随访期间不良反应的发生情况。
1.4 统计方法 数据采用SPSS 20.0 软件分析,计量资料以均数±标准差表示,采用 检验;计数资料采用2检验;绘制两组生存曲线,采用检验。<0.05 为差异有统计学意义。
2 结果
2.1 疗效比较 经治疗,观察组CR 3例,PR 14例,SD 10例,PD 7例,有效率50.00%(17/34),控制率79.41%(27/34);对照组CR 1例,PR 8例,SD 9例,PD 16例,有效率26.47%(9/34),控制率52.94%(18/34);观察组有效率及控制率均显著高于对照组(2=3.98、5.32,均<0.05)。
2.2 肿瘤标志物水平比较 治疗前,两组HSP90 及AFP 水平差异均无统计学意义(均>0.05);治疗后,观察组HSP90 及AFP 水平均显著低于对照组(均<0.05),见表1。
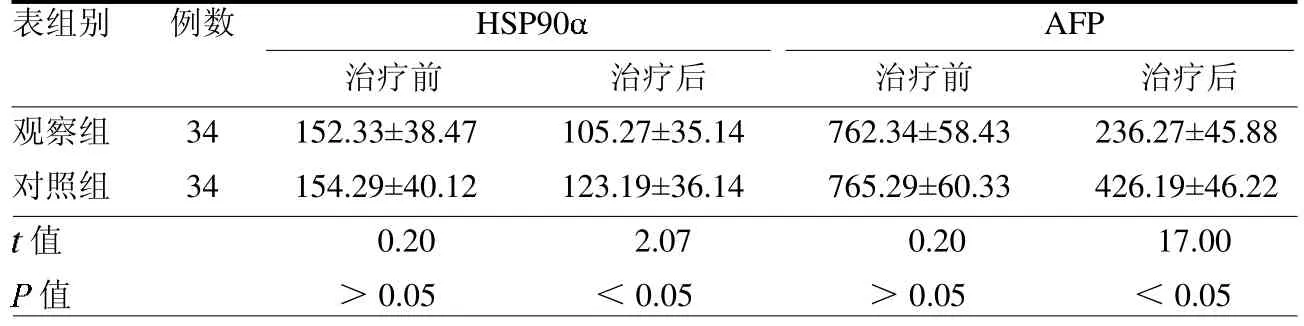
表1 两组治疗前后肿瘤标志物水平比较 ng/ml
2.3 生活质量评分比较 治疗前,两组各项生活质量评分及总体评分差异均无统计学意义(≤0.69,均>0.05);治疗后,观察组各项生活质量评分及总体评分均高于对照组(≥4.72,均<0.05),见表2。
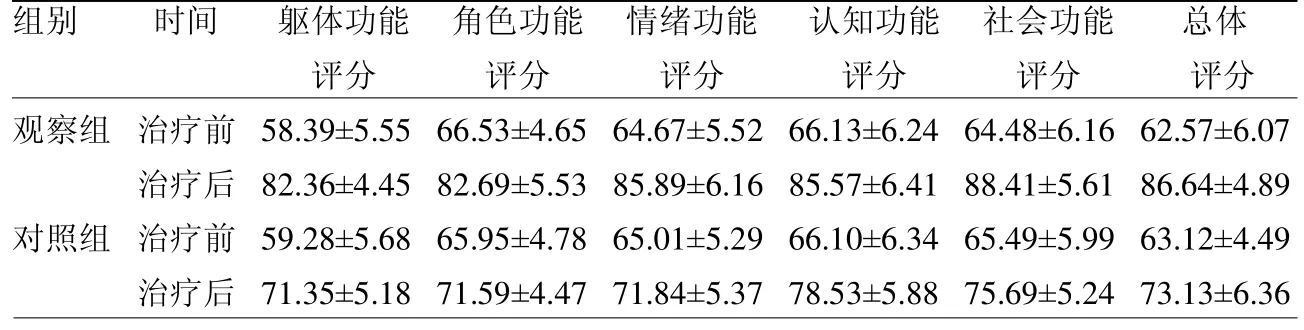
表2 两组生活质量EORTC QLQ-C30 评分比较(=34) 分
2.4 生存分析 截止至随访终点,观察组中位PFS为14.9个月(1.2~18.0个月),对照组为6.1 个月(1.1~18.0 个月),两组差异有统计学意义(<0.05),见图1。
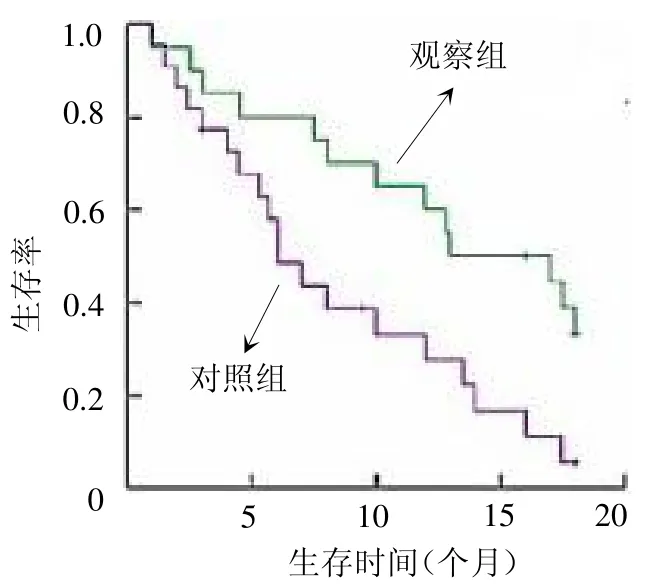
图1 两组PFS 生存曲线比较
2.5 不良反应情况 观察组发生蛋白尿2例,腹泻2例,口腔溃疡2例,高血压3例,不良反应发生率26.47%(9/34);对照组发生腹泻1例,高血压1例,不良反应发生率5.88%(2/34);观察组不良反应发生率高于对照组(2=5.31,<0.05)。
3 讨论
研究表明,TACE 能够有效延长HCC 患者的生存周期,但单纯的TACE完全杀死肿瘤细胞的可能性较低,且术后肿瘤易形成新生血管或者复发,加上TACE 需在较短时间进行多个周期的治疗,易对正常肝细胞造成损伤并加重肝硬化的风险,因而TACE 应配合多元化治疗才能利于患者获得更好疗效[7]。TACE 阻断HCC 细胞的血供,残癌组织能够在多种作用机制下调控促进VEGFR-2 等血管生成因子的表达,因此以VEGFR-2 为重要靶点的分子靶向治疗成为临床关注重点。阿帕替尼是一种抗血管生成小分子药物,其主要作用靶点为VEGF受体,并抑制VEGF与其结合,达到抑制VEGF/VEGF-2 通路活化的作用,从而减少血管形成,有效降低肿瘤微血管密度,对血管内皮细胞的增值、迁移、管腔形成等具有明显抑制作用;同时,与传统癌症药物相比较,阿帕替尼可减少肿瘤细胞对于化疗药物的耐药性[8]。
本研究结果显示,观察组有效率及控制率均显著高于对照组(均<0.05),说明TACE联合阿帕替尼治疗治疗中晚期HCC的临床效果更加显著,猜测原因是阿帕替尼作为VEGFR-2的高度选择抑制剂,能够明显抑制TACE 后残余组织中的VEGFR-2表达,抑制血管形成,降低恶性肿瘤的持续恶性增生,延长患者的生存周期。且本研究中观察组PFS 亦显著高于对照组(<0.05),进一步佐证上述观点。
HSP90 对于生理、病理及已经状态下的细胞正常生理作用具有重要的维持作用。AFP 则是临床常用的HCC 相关的特异性肿瘤标志物实验室指标。研究证实[9],HCC 患者的AFP 水平明显高于正常人,猜测其与肿瘤的发生、发展均具有一定联系,因此HSP90、AFP 可作为评估HCC 病情严重程度及疾病转归的重要血清标志物。本研究结果表明,观察组HSP90、AFP 下降幅度更为显著,提示TACE联合阿帕替尼更加有助于抑制肿瘤增生,利于病情改善。观察组不良反应发生率高于对照组(<0.05),猜测主要由阿帕替尼所引起。
综上所述,TACE 联合阿帕替尼治疗中晚期HCC疗效肯定,患者生存获益更加显著,且肿瘤相关标志物水平显著降低,虽具有相关不良反应,但总体均可耐受。
