基于FAERS 数据库的阿仑单抗不良事件信号挖掘与分析
2021-09-04赵尹瑜谢昊曹明浩陈晨陈力四川大学华西第二医院药学部循证药学中心成都610041出生缺陷与相关妇儿疾病教育部重点实验室成都610041四川大学华西药学院成都610041
赵尹瑜,谢昊,曹明浩,陈晨,陈力(1.四川大学华西第二医院药学部/循证药学中心,成都 610041;2.出生缺陷与相关妇儿疾病教育部重点实验室,成都 610041;3.四川大学华西药学院,成都 610041)
多发性硬化症(multiple sclerosis,MS)是中枢神经系统最常见的脱髓鞘疾病,由于中枢神经系统的任何部位都可受累,因此该病表现多样,常见症状包括疲劳、头晕、肢体麻木、行走困难、胃肠道功能障碍、膀胱功能障碍、认知功能障碍等。流行病学资料显示该疾病在儿童期发病率较低,青春期迅速增加,在25 ~35 岁达到高峰[1-2],是引起中青年人神经性运动障碍最常见的疾病[3-4],也是除创伤外导致年轻人残疾最常见的原因。目前该病的发病机制未明,较公认的是由反应性T、B 细胞介导的自身免疫性反应所致,并直接针对髓鞘抗原[5]。
2014年美国食品药品监督管理局(FDA)已批准阿仑单抗用于有复发性MS 患者的治疗。阿仑单抗是一种针对单核细胞和淋巴细胞表面CD52 的单克隆抗体,阿仑单抗结合CD52 后可启动抗体依赖细胞介导的细胞毒效应和补体依赖的细胞毒效应,导致淋巴细胞裂解,使机体很快进入严重淋巴细胞减少状态。1 个疗程治疗可耗竭T、B 和NK 细胞,尤其是CD4 +T 细胞[6]。
目前国内对于阿仑单抗研究较少,安全性研究缺乏。本次研究主要通过对美国FDA 不良事件报告系统(FDA adverse event reporting system,FAERS)收集到的数据进行挖掘,并对阿仑单抗可疑药品不良事件(AEs)信号进行整合分析,为国内临床合理用药提供参考。
1 资料与方法
1.1 数据来源
本次研究选择FAERS 数据库中2016年第一季度至2020年第四季度共20 个季度的美国信息交换标准代码(American Standard Code for Information Interchange,ASCII)[7]。将数据导入软件MySQL5.7,以人口统计和管理信息(demographic and administrative information,DEMO)表[8]中患者的信息数据为依据,对重复数据进行筛重。
1.2 数据筛选
以FDA 批准药品及不良反应公众数据库(public dashboard)中药品名称为标准,采用阿仑单抗的通用名(阿仑珠单抗)和商品名(LEMTRADA,CAMPATH,MABCAMPATH)为关键检索词进行模糊查询,筛选出报告。
1.3 数据分析
本研究同时应用基于比例失衡法四格表的报告比值比(reporting odds ratio,ROR)法和综合标准法(healthcare products regulatory agency,MHRA)分别计算ROR、比例报告比值(proportional reporting ratio,PRR)和卡方(χ2),筛选潜在AEs 信号,获取首要怀疑药物的目标 AEs报告数及AEs 发生的背景数等数据。ROR 法中95%CI下限>1 且报告数不少于3 例的事件和MHRA 法中 PRR >2、χ2>4 且报告数不少于3例的事件定义为AE 信号[9],所有统计分析采用Microsoft Excel 2016 软件完成。
1.4 数据标准化
FAERS 不良事件数据采用国际医学科学组织理事会《国际医学用语词典》(MedDRA)中首选语(preferred terms,PT)进行编码[10]。本研究中的AEs 采用MedDRA 药品不良反应术语集的首选系统器官分类(system organ class,SOC)和PT。在MedDRA 官方网站(https://www.meddra.org/)下载并运行网站提供的MedDRADesktop Browsers,将需要汉化的PT 英文名导入,则系统自动输出中英文映射表,本文中SOC 和PT 的中英文表达均按照该映射表。
2 结果
2.1 药物不良事件报告的基本情况
共下载AEs 背景信号共24 484 338 个,其中首要怀疑药物为阿仑单抗AEs 报告10 237 份。其中患者男女比为0.43∶1,女性占多数。在已知年龄的患者中,中位年龄为44 岁,平均年龄为41.63 岁。报告基本信息见表1。
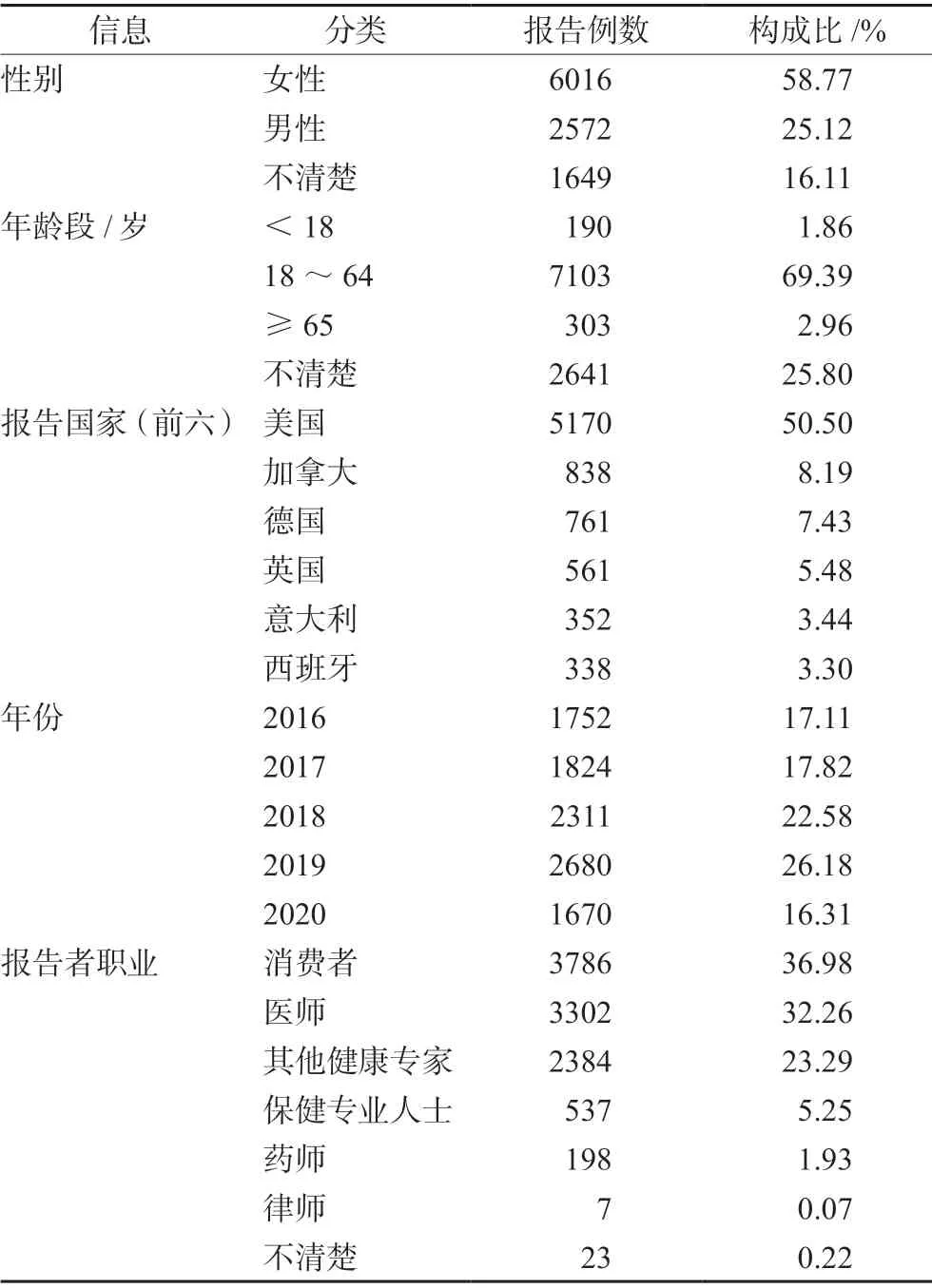
表1 阿仑单抗相关不良事件报告基本信息(n =10 237)Tab 1 Information of reported AEs for alemtuzumab (n =10 237)
2.2 不良事件信号挖掘结果
应用ROR 法和MHRA 法对获得的10 237 份AEs 进行分析,共获得具有统计学意义的信号965个,排除各种手术及医疗操作、社会环境等与药物无关的信号35 个,最终获得930 个信号PT。阿仑单抗报告数、PRR 和ROR 值前30 位的信号PT(剔除原发疾病相关PT,如多发性硬化复发、步态障碍、肌无力等)见表2。报告数多代表该AEs 报告率高,而PRR 和ROR 值大代表该AEs与药物的统计学意义上关联性更强[11]。将检出的信号PT 与阿仑单抗FDA 说明书对比,结果显示新的AEs 较多,表明说明书中的AEs 有待完善。
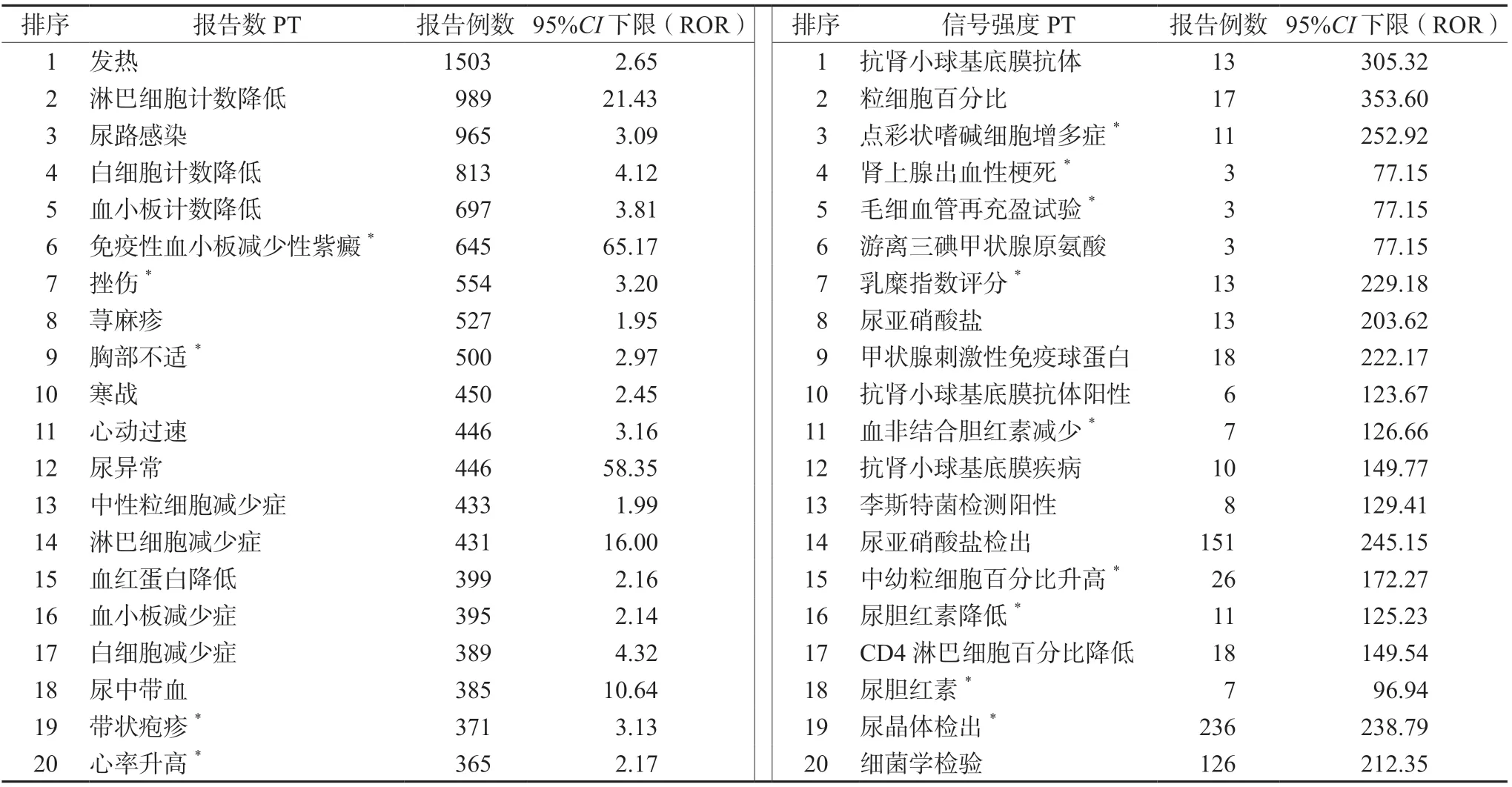
表2 阿仑单抗AEs 报告数及信号强度排名前30 位PTTab 2 Top 30 PT of alemtuzumab AEs frequency and signals strength
2.3 累及的器官、系统分布情况
使用MedDRA 系统器官分类SOC 对930 个有信号的AEs 进行分类,结果显示,阿仑单抗的AEs 涉及24 个SOC。930 个AEs 以SOC 分类的信号数和AEs 报告数的分布情况,见表3。AEs发生频数较高的SOC 为各类检查、胃肠系统疾病、各类神经系统疾病、全身性疾病及给药部位各种反应、肾脏及泌尿系统疾病等,提示阿仑单抗对这些器官系统的损害风险更高。各类检查分类项下多数PT 与肾脏及泌尿系统疾病相关,故取报告数前30 名单独列表,见表4。
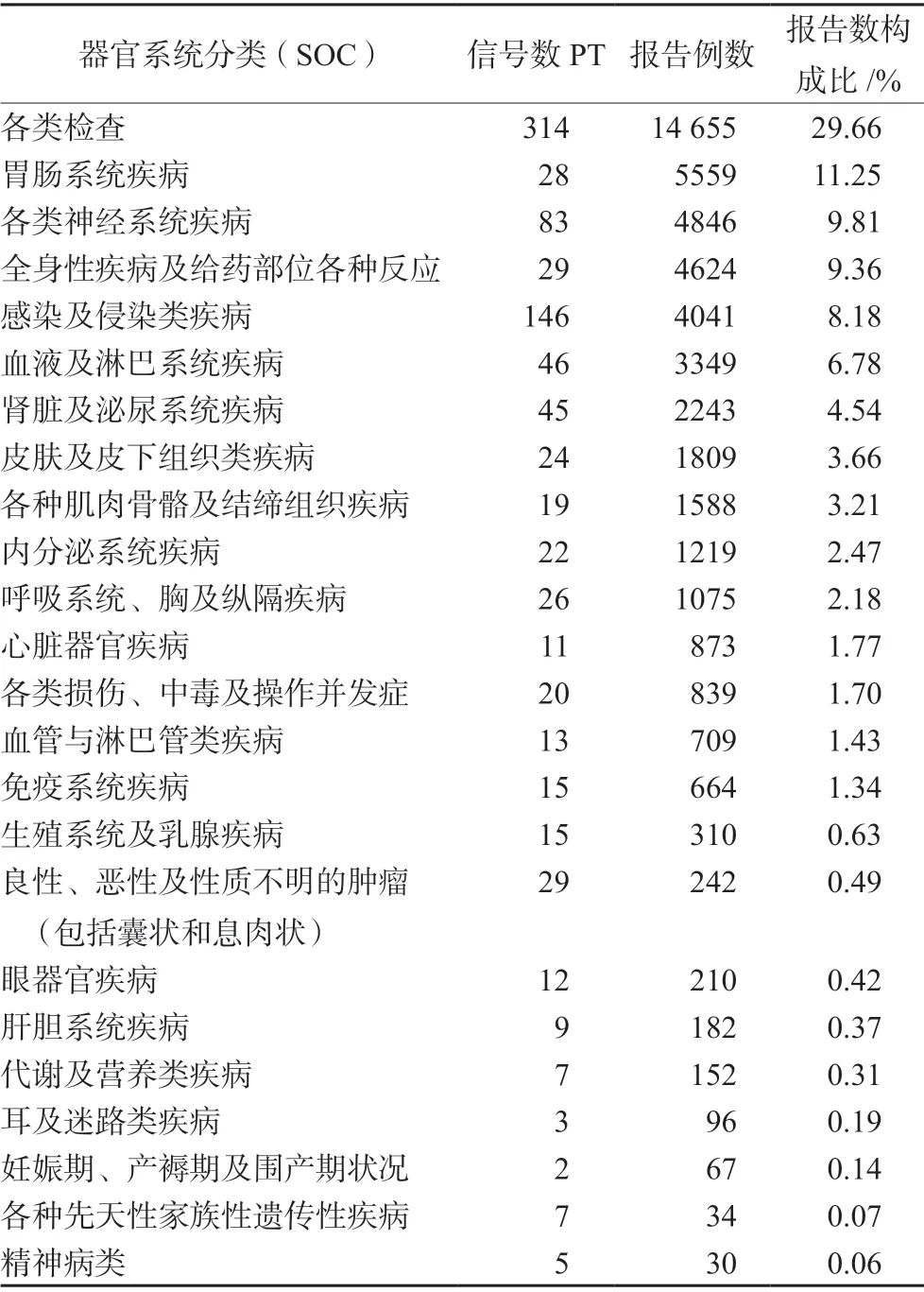
表3 阿仑单抗AEs 信号累及器官系统Tab 3 System and organ involved AEs signals of alemtuzumab
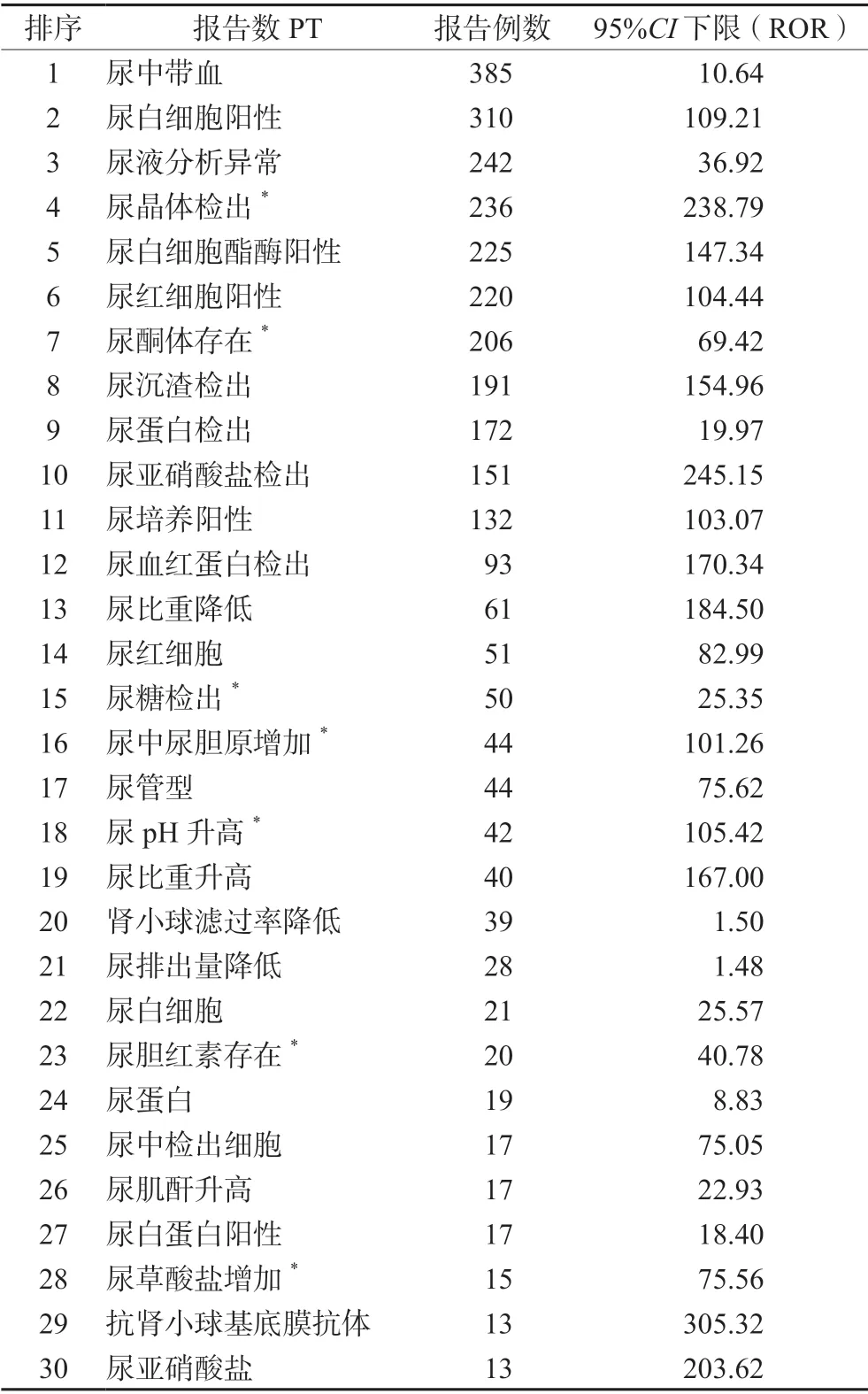
表4 各类检查项下与肾脏、泌尿系统疾病有关指标报告数排名前30 位PTTab 4 Top 30 PT of the indexes related to kidney and urinary system of various examination items
3 讨论
阿仑单抗是一种抗CD52 单抗,与治疗MS的其他药物相比,在降低复发率方面非常有效,并且在一些研究中已被证明可改善残疾[12-14]。但阿仑单抗的AEs 也不容忽视。
3.1 常见AEs 信号分析
阿仑单抗(商品名为Lemtrada)在FDA 中提交的最新修订说明书(2020年10月)中提及的AEs,如发热、寒战、中性粒细胞减少、血小板减少等在本研究中均被检出。本研究发现,阿仑单抗的 AEs 主要集中在各类检查(29.66%,14 655/49 416),胃肠系统疾病(11.25%,5559/49 416),各类神经系统疾病(9.81%,4846/49 416),全身性疾病及给药部位各种反应(9.36%,4624/49 416)。虽然侵袭类疾病报告数仅占8.18%(4041/59 416),但阿仑单抗的使用已经导致了许多相对不太常见感染的发生,如泛红细胞炎(可能由对阿仑单抗的过敏反应引发)[15]、李斯特菌脑膜炎[16]、巨细胞病毒感染和肺诺卡氏菌[17]。临床试验中最常见的感染是鼻咽炎、上呼吸道感染、尿路感染、疱疹病毒感染、鼻窦炎和流感[13-14]。其原因可能与阿仑单抗导致长期严重的淋巴细胞减少,影响体液和细胞介导的免疫反应有关[18]。由于使用阿仑单抗治疗导致疱疹病毒感染风险增加,一项临床试验引入了在阿仑单抗第1日和每个治疗周期1 个月内口服抗疱疹药物的预防性治疗[19]。
阿仑单抗在使用过程中可能会出现头痛、皮疹、发烧、恶心、呕吐和肌肉疼痛等输液相关反应,均是细胞因子释放综合征的一部分;虽然在反复输液的过程中,其发生率和严重程度都会降低[20],但仍应密切关注其输液相关反应。
说明书AEs 中涉及的所有器官系统,本次研究均检出一定信号数量的AEs,并检出新出现AEs 的器官系统如各类损伤、中毒及操作并发症、生殖系统及乳腺疾病、眼器官疾病、耳及迷路类疾病等,可为说明书 AEs 的完善提供参考。
3.2 新的信号和累及器官系统
肾脏及泌尿系统疾病中,新的有意义的信号包括尿晶体检出(ROR 值=238.79)、尿酮体存在(ROR 值=69.42),均属于信号强度前20 位。将各类检查中与肾脏、泌尿系统有关的指标进行筛选后,所得指标类型占比16.24%(51/314),报告数占比22.06%(3233/14 655),这些信号提示阿仑单抗可能存在肾脏及泌尿系统尚未被充分认识的安全性问题,而FDA 说明书中没有详细说明,只提及阿仑单抗治疗数月至数年后可能出现肾小球肾病症状。加拿大卫生部2020年6月发布公告称,在接受阿仑单抗(商品名为MabCampath)治疗的B 细胞慢性淋巴细胞白血病(B-CLL)患者中,有严重且致命的不良事件报告,其中包括肾小球肾炎[21]。一项临床研究中观察到4 例(0.3%)肾小球肾炎。肾病伴随着血清肌酐、血尿和/或蛋白尿的增加,在治疗结束后的4 ~39 个月内发展。这可能与自身免疫性肾病有关[22]。因此在治疗期间应对临床显著变化的血肌酐及异常的镜检尿液分析进行监测,在今后临床用药中充分关注。
未在说明书中出现的 AEs 信号累及器官系统7 个,新的且有意义的SOC 包括各类损伤、中毒及操作并发症,生殖系统及乳腺疾病,眼器官疾病,耳及迷路类疾病,妊娠期、产褥期及围产期状况,各种先天性家族性遗传性疾病。有关阿仑单抗对妊娠影响的数据仍然有限,已知阿仑单抗能穿过胎盘,对胎儿有危险[19]。Oh 等[23]进行怀孕前接受12 mg 或24 mg 阿仑单抗的临床试验发现,正常活产是最常见的结局,先天性异常或出生缺陷的风险没有增加。接受阿仑单抗治疗患者的自然流产率与普通人群和未接受治疗的MS 患者的自然流产率相当,并且在阿仑单抗暴露一年内妊娠的妇女,其自然流产的风险没有增加。现有的数据仍然不足以确定阿仑单抗对胎儿的风险,需要更进一步的研究。
3.3 研究局限性
本研究仍存在一定的局限性,如阿仑单抗AEs 报告数与挖掘后得到的相关性在关联方面存在一定程度的差异,例如发热、尿路感染、白细胞计数降低等报告数量多,但相关性差,这可能与ROR 法和MHRA 法挖掘AEs 的局限性有关;此外,FAERS 数据库中AEs 报告主要来源于美国,由于人种、地域等差异,结果应用于中国时可能存在一定偏差,因此应结合临床实际情况合理用药;由于FAERS 是自发呈报系统,收集的阿仑单抗 AEs 报告可能不全,有漏报、误报的可能性,即使样本量足够大,比例失衡法仍存在一定的局限性[9],且呈报的 AEs 和药品之间因果关系并不能完全保证,如本次研究检出较多与各类神经系统疾病的信号,与原发疾病MS 相关,无法判断其与药物的直接相关性。尽管本研究对术语进行了标准化,也不能完全排除由于数据的模糊、不规范引起的分析偏差。
4 结论
本研究对FAERS 数据库2016—2020年阿仑单抗的AEs 数据进行回顾性分析,利用实际患者用药的数据发掘潜在的且未被说明书收录的AEs,在一定程度上弥补了上市前药品临床试验的不足,为临床安全用药提供了参考。本研究获得的AEs 信号与阿仑单抗说明书和文献研究基本一致。虽然检出较多各类神经系统疾病的相关信号,但由于与原发疾病相关,难以推断其明确的因果关系。研究还检出较多的与肾脏及泌尿系统相关的各类检查指标与疾病,在临床应用过程中,应重点进行尿液分析和肌酐监测,防止出现泌尿系统严重的AEs 后果。本次研究获得了相对更加真实完整的药品安全信息,可为临床用药提供参考,促进临床合理用药。
