基于美国FAERS数据的索磷布韦维帕他韦与艾尔巴韦格拉瑞韦不良事件安全警戒研究
2021-09-04王娜夏暄周月阳陈晨杜明四川大学华西口腔医院药剂科成都610041四川大学华西药学院成都610041四川大学华西医院临床药学部药剂科成都610041四川大学华西公共卫生学院成都610041
王娜,夏暄,周月阳,陈晨,杜明(1.四川大学华西口腔医院药剂科,成都 610041;2.四川大学华西药学院,成都 610041;3.四川大学华西医院临床药学部(药剂科),成都 610041;4.四川大学华西公共卫生学院,成都610041)
丙型肝炎是由丙型肝炎病毒(hepatitis C virus,HCV)引起的、以肝脏病变为主的传染性疾病,表现为急性和慢性病毒性肝炎,其中慢性丙肝可发展成肝纤维化、肝硬化甚至肝细胞癌[1]。HCV 全球感染率约为2%~3%,我国约有4000万人感染HCV,占总人口的3.2%[2]。
近年来,丙型肝炎的治疗从以干扰素为基础的治疗发展为全口服治疗。新型直接抗病毒药物通过靶向不同的HCV 非结构蛋白抑制病毒的复制,根据作用的靶蛋白不同,DAAs 分为HCV非结构蛋白3/4A(non-structural 3/4A,NS3/4A)抑制剂、HCV 非结构蛋白5B(non-structural 5B,NS5B)抑制剂和HCV 非结构蛋白5A(nonstructural 5A,NS5A)抑制剂[3]。其中索磷布韦维帕他韦片于2016年6月经美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市,2018年5月由国家药品监督管理局批准上市,用于治疗基因型HCV-Ⅰ~Ⅵ的慢性HCV感染患者,其成分索磷布韦为NS5B 抑制剂,维帕他韦是NS5A 抑制剂。艾尔巴韦格拉瑞韦片于2016年1月在美国获准使用,2018年4月在我国批准上市,治疗基因型HCV-Ⅰ,Ⅳ的慢性HCV 感染患者,其中艾尔巴韦是NS5A 抑制剂,格拉瑞韦为NS3/4A 抑制剂。索磷布韦维帕他韦片与艾尔巴韦格拉瑞韦片适应证相似,且临床试验结果显示两种药物治疗结束后12 周,血清或血浆HCV-RNA 阴性率均可达100%,同时两种药物均被FDA 黑框警告称既往或当前感染乙肝病毒(hepatitis B virus,HBV)的丙肝患者,使用这两种药物存在HBV 再激活甚至导致严重的肝脏问题并死亡的风险[4]。因此,两种药物的安全性亟需进一步评估与比较。
本研究基于FAERS 数据对索磷布韦维帕他韦片与艾尔巴韦格拉瑞韦片的安全性进行对比分析,利用报告比值比法(reporting odds ratio,ROR)和联合综合标准法(The Medicines and Healthcare products Regulatory Agency,MHRA)定量挖掘索磷布韦维帕他韦片和艾尔巴韦格拉瑞韦片安全警戒信号,以期优化患者治疗方案、预防和应对药物不良反应。
1 数据与方法
1.1 研究数据
以FDA 批准药品及不良反应公众数据库中索磷布韦维帕他韦片(商品名:Epclusa;通用名:sofosbuvir/velpatasvir)和艾尔巴韦格拉瑞韦片(商品名:Zepatier;通用名:elbasvir/grazoprevir)为检索词,提取FAERS 2017年第一季度至2020年第三季度共15 个季度的不良事件数据,导入软件MySQL 中,并根据个人信息记录(DEMO)数据表对患者信息进行去重,限定检索以索磷布韦维帕他韦片和艾尔巴韦格拉瑞韦片为“首要怀疑(Primary Suspect,PS)”的不良事件报告。
1.2 方法
目前常用的药品不良反应检测方法是比例失衡法,其主要包括ROR 法和MHRA 法,具体算法基于比例失衡法四格表。ROR 法检测阈值为:报告数≥3,ROR 的95%置信区间(confidence interval,CI)下限>1;MHRA 法检测阈值为:报告数≥3,比例报告比值(PRR)≥2,卡方值≥4。满足以上条件即生成一个信号[5-6]。本研究参照《ICH 国际医学用语词典》(Medical Dictionary for Regularly Activities,MedDRA)[7]中药物不良反应术语集首选术语(Preferred Terms,PT)编码提取FAERS 不良事件数据,并将PT 映射到相应的系统器官(system organ class,SOC)中进行归类,对收集到的ADE 报告,按照信号强度(ROR 值)选取前10 的PT 以挖掘关联性强的不良事件。同时选择信号频次占比大于0.5%的PT 进行χ2检验分析索磷布韦维帕他韦片和艾尔巴韦格拉瑞韦片不良事件报告频次差异。计数资料采用例数和构成比描述,通过Microsoft Excel 2016 和SPSS 22.0 完成。
2 结果
2.1 不良事件报告病例基本特征
在删除重复报告后,获得PS 药物为索磷布韦维帕他韦片的药物不良事件(adverse drug event,ADE)共16 961 例,报告数7332 份;PS 药物为艾尔巴韦格拉瑞韦片的ADE 为5945 例,报告数2550 份。ADE 报告病例基本特征详见表1,其中索磷布韦维帕他韦片和艾尔巴韦格拉瑞韦片的不良事件报告男女比分别为1.36 和1.19;年龄分布以18 ~64 岁为主;报告者以消费者为主;报告国家集中于美国。严重不良事件占比索磷布韦维帕他韦片为22.21%,艾尔巴韦格拉瑞韦片为18.67%,其中两药均以导致住院或住院时间延长为主,而索磷布韦维帕他韦片导致死亡的不良事件占比更高。
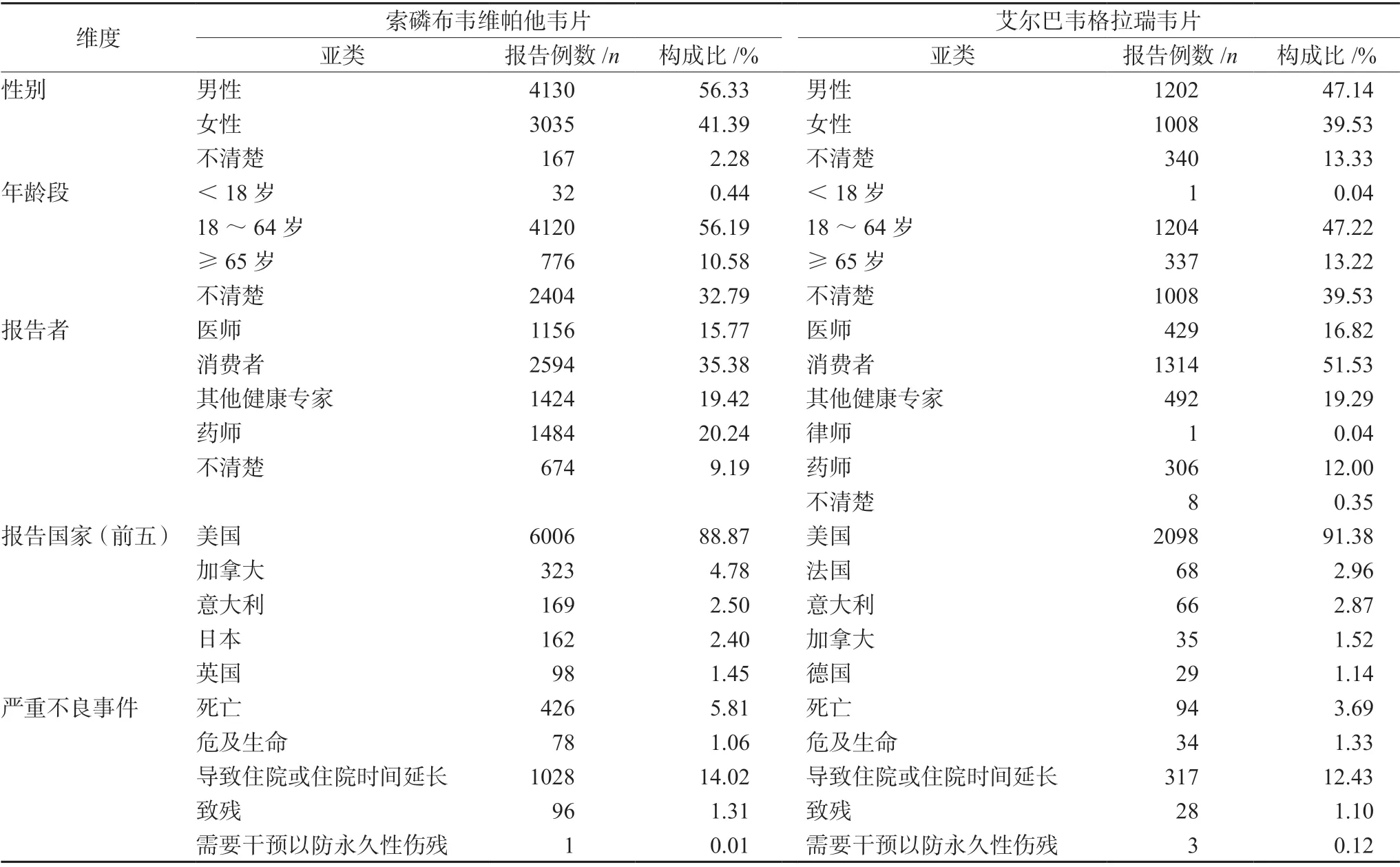
表1 索磷布韦维帕他韦片、艾尔巴韦格拉瑞韦片不良事件报告的基本信息Tab 1 Primary information of sofosbuvir/velpatasvir and elbasvir/ grazoprevir related ADE
2.2 不良事件安全警戒信号累及的系统器官
按照MedDRA 的SOC 进行分类合并,结果显示索磷布韦维帕他韦片的ADE 信号共172 个,来自7419 例次报告,涉及23 个SOC;艾尔巴韦格拉瑞韦片共85 个ADE 信号,来自2867 例次报告,涉及21 个SOC。
索磷布韦维帕他韦片和艾尔巴韦格拉瑞韦片均集中于全身性疾病及给药部位各种反应,各类神经系统疾病,胃肠系统疾病等。其中,两药新的ADE 信号均主要集中于胃肠系统疾病(见表2)。
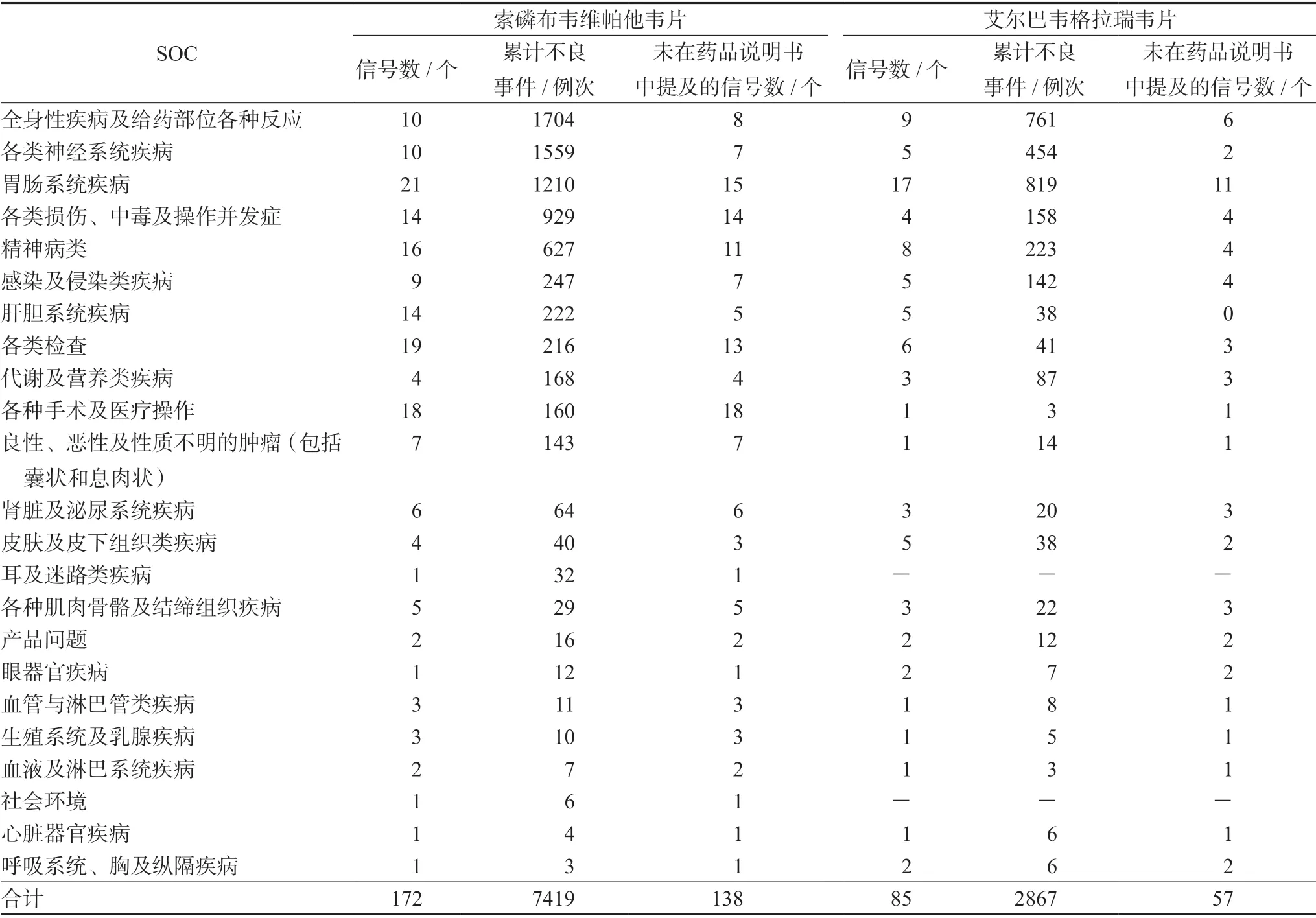
表2 索磷布韦维帕他韦片、艾尔巴韦格拉瑞韦片相关不良事件累及的系统和器官Tab 2 Sofosbuvir/velpatasvir and elbasvir/grazoprevir ADE signals and involved systems and organs
2.3 ROR 值前10 位不良事件报告及信号情况
按照ROR 值降序排序,排除肝硬化相关疾病、产品问题、各类检查、操作并发症等与药物无关的信号,获得排名前10 的ADE 信号(见表3)。索磷布韦维帕他韦片信号强度排名前三的ADE 信号为肾淤血、冷球蛋白血症、乙型肝炎再激活;艾尔巴韦格拉瑞韦片信号强度排名前三的ADE 信号包括直肠穿孔、感染性滑囊炎、头痛。
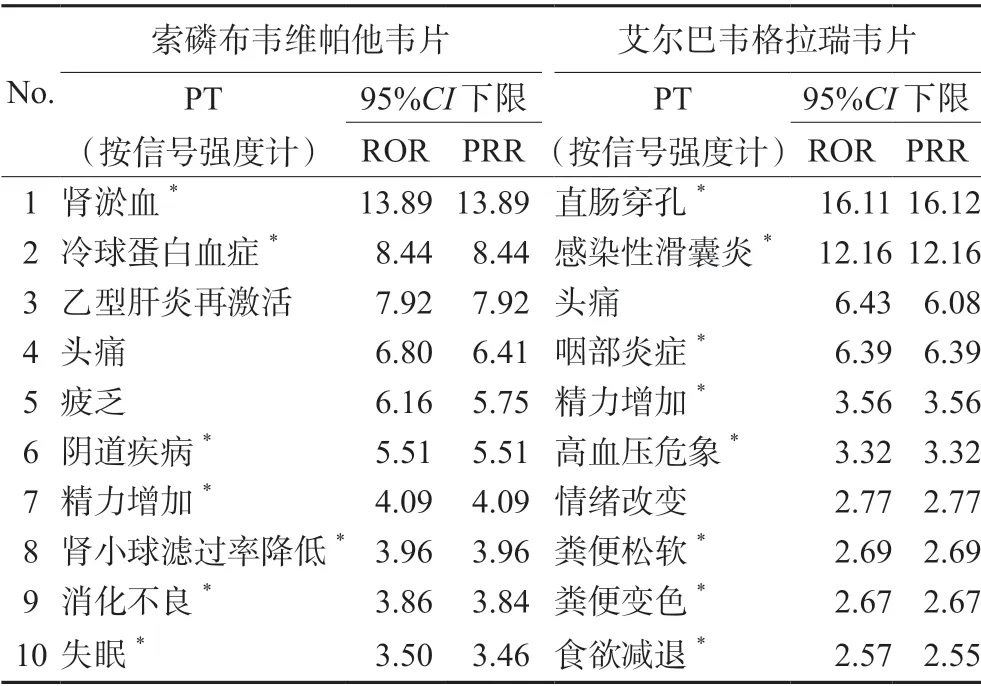
表3 索磷布韦维帕他韦片、艾尔巴韦格拉瑞韦片ROR 值居前10位的不良事件Tab 3 PT of the top 10 ROR related to sofosbuvir/velpatasvir and elbasvir/grazoprevir
2.4 两药常见不良事件的报告频次比较
报告频次占比大于0.5%的不良事件包括神经系统疾病、消化道反应等。由表4可知,嗜睡、胃食管反流病、孕产妇在妊娠过程中的暴露等仅在索磷布韦维帕他韦片中,而睡眠质量差、腹泻、呕吐等仅在艾尔巴韦格拉瑞韦片中。
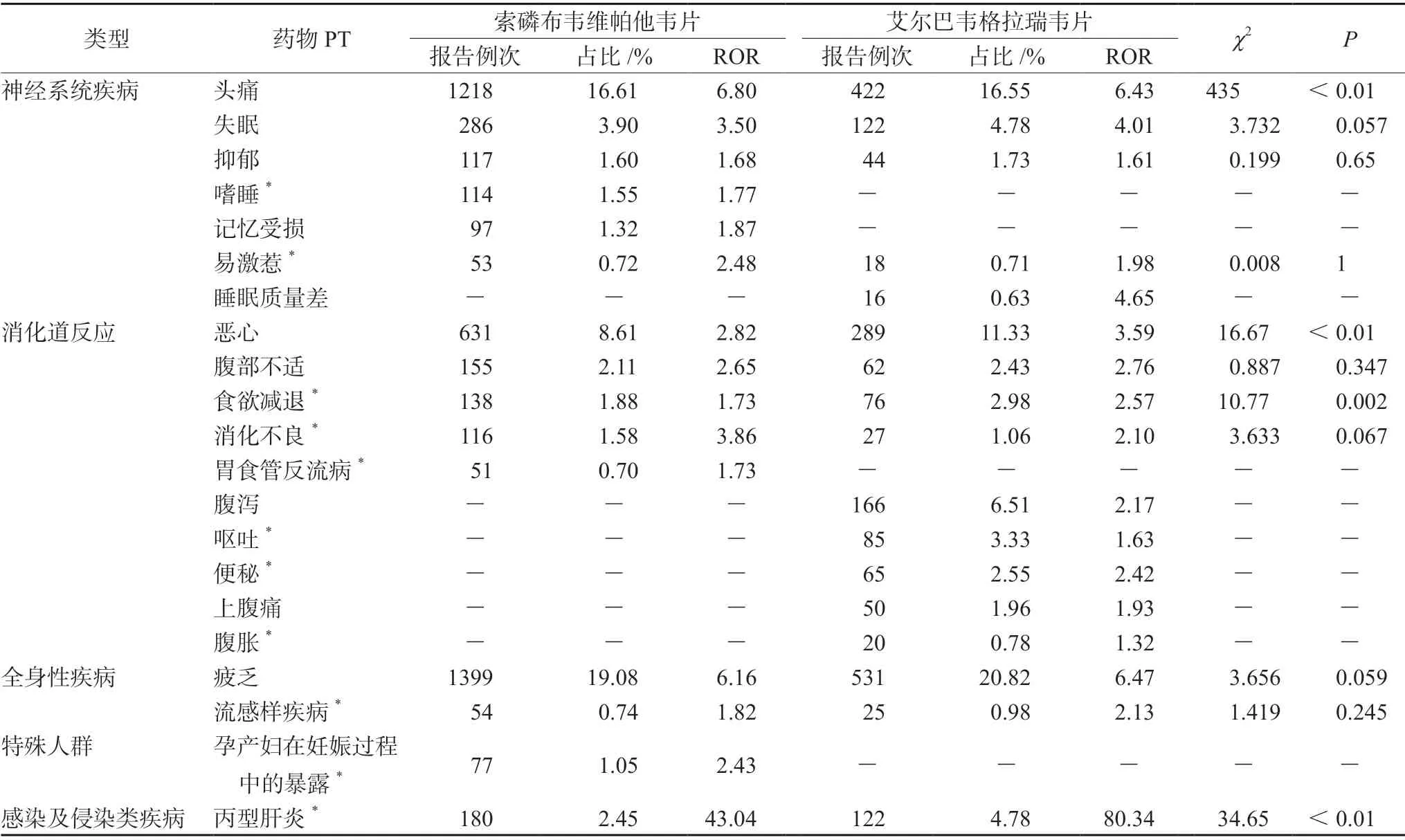
表4 索磷布韦维帕他韦片、艾尔巴韦格拉瑞韦片报告频次占比大于0.5%的不良事件Tab 4 PT with more than 0.5% reporting frequency related to sofosbuvir/velpatasvir and elbasvir/grazoprevir
对两药报告频次占比均大于0.5%的不良事件进行χ2检验,可见头痛、恶心、食欲减退、丙型肝炎的报告频次差异具有统计学意义(P<0.01)。
3 讨论
本文通过挖掘FAERS 数据库得到的索磷布韦维帕他韦片与艾尔巴韦格拉瑞韦片ADE 信号与FDA 说明书信息基本一致,说明书中警告的乙肝病毒再激活和常见的ADE 如头痛、恶心、疲乏等均被检测到,证实本研究可信。
3.1 信号关联性强且说明书未提及的ADE
由表3可知,索磷布韦维帕他韦片中,关联性最强的新的ADE 是肾淤血。研究者报告了使用索磷布韦治疗后导致肾病综合征的病例,可能的机制为索磷布韦恢复了由于慢性病毒感染而被抑制的适应性和先天性免疫反应,导致急性细胞排斥反应和复发性自身免疫疾病[8-10]。而肾病综合征的常见并发症为肾静脉血栓,提示索磷布韦维帕他韦片肾淤血ADE 的可能性。因此临床使用索磷布韦维帕他韦片应密切监测肾功能。
艾尔巴韦格拉瑞韦片关联性最强的ADE 为直肠穿孔。Jacobson 等[10]研究结果显示该药可导致结肠炎不良反应,结肠炎病变多自直肠开始,因此广泛结肠炎可并发急性直肠穿孔。同时Kumada 等[11]临床试验证实该药严重不良反应包括大肠息肉、结直肠腺癌(发生率<5%),Zamor 等[12]研究发现该药导致直肠出血的发生率为0.3%,以上均提示临床使用该药应考虑结直肠疾病发生的可能性。
3.2 信号频次占比较高的ADE 事件
神经系统中,信号频次占比>0.5%的不良事件包括易激惹、嗜睡、头痛、记忆受损等。其中头痛的信号频次占比索磷布韦维帕他韦片高于艾尔巴韦格拉瑞韦片且差异有统计学意义,同时在两药的随机临床对照试验中[13],头痛的不良反应发生率前者为17.26%,后者为14.16%,与本研究结果相符。Yang 等[14]研究也表示索磷布韦神经精神ADE 的发生率远高于空白对照组,提示存在神经系统疾病风险的丙肝患者选用艾尔巴韦格拉瑞韦片可能更佳。
消化系统中,便秘、腹泻、呕吐等事件为艾尔巴韦格拉瑞韦片常见ADE,在两药的随机临床对照试验中[15],艾尔巴韦格拉瑞韦片腹泻的不良反应发生率为6.78%,索磷布韦维帕他韦片为0%。同时恶心和食欲减退的信号频次占比索磷布韦维帕他韦片低于艾尔巴韦格拉瑞韦片且差异具有统计学意义,提示消化系统疾病患者选择索磷布韦维帕他韦片可能是更佳选择。但是胃食管反流患者在使用该药时应注意观察是否存在呕吐、反酸、烧心等症状,以防疾病进一步恶化。
在全身性疾病中,疲乏和流感样疾病均与两药具有一定的关联性,其中流感样疾病未在说明书中提及。然而多个临床研究均发现流感样疾病属于索磷布韦等DAAs 药物的主要ADE[15-17],与本研究结果一致。同时在两个药物的随机临床对照试验中[18],疲乏和流感样疾病的报告频率只有索磷布韦>10%,提示临床使用索磷布韦维帕他韦片应更加注意避免流感样疾病不良事件的发生。
在特殊人群中,索磷布韦维帕他韦片报告频次占比较高的ADE 为孕产妇在妊娠过程中的暴露,但暂无研究证明索磷布韦维帕他韦片影响妊娠。Chappell 等[19]研究发现索磷布韦-雷迪帕韦不影响妊娠结局,同时有研究认为妊娠期间的HCV 传播至少占1/3[20],因此妊娠期间使用索磷布韦-雷迪帕韦可降低产前传播风险,其益处超过胎儿药物暴露的风险。但索磷布韦维帕他韦片与试验药物成分部分不同,且缺乏维帕他韦对妊娠结局影响的研究。因此妊娠期妇女应根据个体情况权衡利弊,判断是否使用索磷布韦维帕他韦片,以保证最大的临床效益和最小的风险结局。
由表3可知,索磷布韦维帕他韦片相比艾尔巴韦格拉瑞韦片更易引起HBV 再激活。HBV 和HCV 共感染患者,由HCV 的核心蛋白、NS2 和NS5A 蛋白等介导[21-23]抑制HBV 复制。当HCV 被清除后,该抑制作用解除,出现HBV 快速复制,即HBV 再激活。本研究结果显示,丙型肝炎的信号频次占比索磷布韦维帕他韦片明显低于艾尔巴韦格拉瑞韦片且差异具有统计学意义,说明索磷布韦维帕他韦片抑制HCV 效果更佳,导致HBV 更易被激活,与前述机制吻合。因此,HBV 和HCV 共感染患者应谨慎使用索磷布韦维帕他韦片。
3.3 研究局限性
利用数据库开展对ADE 信号的探索仍需提高和改进:① FAERS 数据库为自发呈报数据库,存在漏报误报重复报的可能性。② 本研究挖掘到的不良事件信号仅表示研究药物与该信号存在统计学的关联性,但在临床选用药物时仍需进一步的临床试验研究。③ 本研究挖掘到索磷布韦维帕他韦片172 个不良反应信号,来自7332 名患者;艾尔巴韦格拉瑞韦片85 个不良反应信号,来自2550名患者。两种药物不良事件报告的患者数量相差较大,对结果的统计具有一定影响。④ 报告国家集中于美国、法国、意大利等欧美国家,缺少亚洲人群相关安全性数据,提示对索磷布韦维帕他韦片和艾尔巴韦格拉瑞韦片的安全性分析结果在我国普及性有待进一步研究。⑤ 本研究未对老年人和儿童等特殊人群进行分析,数据显示儿童不良事件报告占比不到1%,老年人仅有约10%。因此,特殊人群使用该药应注重药物安全性的监测。
综上所述,基于美国FAERS 数据库的分析结果,从上市后用药安全性的角度对索磷布韦维帕他韦片、艾尔巴韦格拉瑞韦片的不良事件信号进行比较,得到不良事件累及的主要系统较为一致,展示了相关的ADE 信号和频次间的差异,为临床治疗丙型肝炎提供一定的参考,以推进临床合理用药。
