高效液相色谱法测定拉莫三嗪片中的有关物质
2021-09-04姜金生石笑弋刘轶欧阳冬生陈俊陈开义胡杰三金集团湖南三金制药有限责任公司湖南常德4500湖南省药品检验研究院湖南药用辅料检验检测中心长沙4000中南大学湘雅医院临床药理研究所长沙4000复杂基质样本生物分析湖南省重点实验室长沙40000
姜金生,石笑弋,刘轶*,欧阳冬生,陈俊,陈开义,胡杰(.三金集团湖南三金制药有限责任公司,湖南 常德 4500;.湖南省药品检验研究院(湖南药用辅料检验检测中心),长沙 4000;3.中南大学湘雅医院临床药理研究所,长沙 4000;4.复杂基质样本生物分析湖南省重点实验室,长沙 40000)
拉莫三嗪(lamotrigine)是新一代的抗癫痫药,在临床上可单独使用也可联合使用治疗癫痫,疗效显著,基本上没有致畸性。临床上拉莫三嗪还可用于双相情感障碍的治疗,安全性较好[1]。在合成拉莫三嗪原料药中可能引入工艺杂质,比如2,3-二氯苯甲酰氯、2,3-二氯苯甲酰氰、2,3-二氯苯甲酸(拉莫三嗪杂质I,文中称为杂质B)等,在拉莫三嗪制剂储存过程中可能产生一些降解杂质,如2,3-二氯苯甲酸(杂质B)、3-氨基-6-(2,3-二氯苯基)-1,2,4-三嗪-5-(4H)-酮(杂质C)、6-(2,3-二氯苯基)-1,2,4-三嗪-3,5-(2H,4H)-二酮(杂质E)等(见表1)。目前关于这些杂质检测方法的文献报道不多[2-3],且各国药典与国内标准对杂质的命名各不相同。

表1 拉莫三嗪片有关物质Tab 1 Related impurity in lamotrigine tablets
英国药典(BE2018)[4]与欧洲药典(EP9.0)[5]中拉莫三嗪原料药与片剂的检测方法相同,均采用两个不同的液相色谱方法分别测定拉莫三嗪的有关物质,美国药典(USP41)[6]对拉莫三嗪原料药与片剂的有关物质采用不同的液相色谱方法分别偏重于工艺杂质与降解杂质的检测。黄诺哲等[7]在EP9.0 的基础上,把150 mm 长度的色谱柱改为250 mm 色谱柱同步改变洗脱持续时间并采用双波长的高效液相色谱方法,该方法虽能同时检测杂质B、杂质C、杂质D,但对BP 药典中杂质G 与某氧化降解杂质的分离度不理想,工艺杂质2,3-二氯苯甲酰氰、2,3-二氯苯甲酰氯和可能的降解杂质E 未见检测报道。Emami 等[8]以高效液相色谱等度洗脱的方法能同时检测杂质C和杂质D,但对杂质B、杂质E 以及工艺杂质等未能有效检出。文献采用以甲醇-0.5%三乙胺溶液(用磷酸调节pH 值至4.0)为流动相的高效液相色谱等度洗脱法对拉莫三嗪片进行有关物质检测[2-3],与企业标准[9-10]一样,由于流动相pH 值相同,杂质B 与拉莫三嗪主峰分离不好,杂质D与杂质E 出峰时间在100 min 左右,不能有效对拉莫三嗪有关物质进行同时检测。
本文在企业标准YBH0245 2014[9]、WS1-(X-119)-2012Z[10]、YBH04392010[11]的基础上结合国内外拉莫三嗪相关质量标准以及文献报道[2-7],参照《中国药典》2020年版四部[12]、《化学药物质量控制分析方法验证技术指导原则》[13]和《化学药物杂质研究技术指导原则》[14],进一步开发出能同时检测可能的工艺杂质和降解杂质的高效液相色谱方法,并对主要控制杂质进行相对保留时间和校正因子研究,为拉莫三嗪原料药与制剂的质量控制提供参考。
1 材料
1.1 仪器
MS205DU 十万分之一电子天平(Mettler Toledo 公司);LC-20A 岛津高效液相色谱仪(日本岛津公司);PHSJ-4F pH 计(上海仪电科学仪器股份有限公司)。
1.2 试药
拉莫三嗪片(批号:181208、181209、181210,自制);拉莫三嗪对照品(批号:100775-201902,中国食品药品检定研究院,纯度:99.7%);杂质B(拉莫三嗪杂质I)对照品(批号:510086-201401,中国食品药品检定研究院,供有关物质检测用);拉莫三嗪杂质C 对照品(批号:F3L329,USP,供有关物质检测用);2,3-二氯苯甲酰氯(批号:170037,自制);2,3-二氯苯甲酰氰(杂质F,批号:1703007,自制);缩合物(杂质A1,批号:10901-1806005y,自制);拉莫三嗪杂质D 对照品(批号:F1H279,USP,供有关物质检测用);拉莫三嗪杂质E 对照品(批号:L2011011,U.K,供有关物质检测用);甲醇(色谱纯,TEDIA)、磷酸(色谱纯)、三乙胺(色谱纯)、盐酸(分析纯)、氢氧化钠(分析纯)、30% 过氧化氢(分析纯)(国药集团化学试剂有限公司);纯化水(自制)。
2 方法
2.1 色谱条件
色谱柱为Kromasil C18柱(4.6 mm×250 mm,5 μm);流动相A 为甲醇,流动相B 为 0.5%三乙胺溶液(用磷酸调节pH 值至4.5),梯度洗脱(见表2);流速为0.8 mL·min-1;检测波长为230 nm;柱温为40℃;进样量为20 μL。

表2 梯度洗脱程序Tab 2 Gradient elution program
2.2 溶液配制
2.2.1 供试品溶液 取本品细粉适量(相当于拉莫三嗪约20 mg),精密称定,置于50 mL 量瓶中,加入稀释液(甲醇-0.1 mol·L-1盐酸溶液=20∶80,V/V)适量,制成每1 mL 中约含拉莫三嗪0.4 mg 的溶液,摇匀,作为供试品溶液。
2.2.2 对照溶液 精密量取供试品溶液适量,加稀释液定量稀释制成每1 mL 中约含拉莫三嗪0.8 μg 的溶液,作为对照溶液。
2.2.3 空白溶剂 以稀释液作为空白溶剂。
2.2.4 对照品储备溶液 分别称取拉莫三嗪、杂质B、杂质C、杂质D、杂质E、杂质A1、杂质F 自制对照品适量,精密称定,加甲醇适量溶解,再以稀释液稀释成适当浓度的溶液,作为对照品储备溶液。
2.2.5 系统适用性溶液 取拉莫三嗪约10 mg,加适量6 mol·L-1氢氧化钠溶液,置90℃加热约1 h,用6 mol·L-1盐酸溶液中和,再加入10 mL 杂质B 对照品溶液(精密称取杂质B 对照品适量,加甲醇溶解并稀释成 0.1 mg·mL-1)和杂质E 对照品溶液约2 mL(精密称取杂质E 对照品适量,加甲醇溶解并稀释成 0.1 mg·mL-1),用稀释液稀释至每1 mL 中约含拉莫三嗪0.4 mg、杂质B 0.04 mg、杂质E 0.008 mg 的混合溶液,作为系统适用性溶液。
2.3 专属性试验
2.3.1 系统适用性试验 取系统适应性溶液及空白溶剂,空白辅料溶液按“2.2.1”项下方法制备,进样测定,记录色谱图,杂质B、拉莫三嗪、杂质C、杂质E 依次出峰,分离度符合要求,拉莫三嗪理论塔板数不低于5000,杂质B 峰相对保留时间约为0.8,与拉莫三嗪峰分离度达到1.5,相对保留时间1.0 ~2.0 的杂质C(主要降解杂质)的相对保留时间约为1.7,系统适应性良好(见图1)。
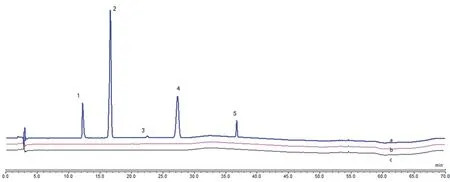
图1 系统适应性色谱图Fig 1 Chromatogram of system suitability test
取杂质A1、杂质D、杂质F 对照品储备液用稀释液稀释至适当浓度后按“2.1”项下条件测定,结果各杂质出峰时间分别约为46.61、48.96、50.36 min,分离度均大于6.5,能较好地检测分离。
2.3.2 破坏性试验
① 未破坏:取拉莫三嗪片(规格:50 mg,批号:181208)按“2.2.1”项下方法配制未破坏溶液。
② 酸、碱破坏:分别取本品粉末适量(约相当于拉莫三嗪20 mg),精密称定,分别加入1 mL 6 mol·L-1盐酸溶液或6 mol·L-1氢氧化钠溶液,90℃水浴加热分别约3 h(酸破坏)和1 h(碱破坏),放冷至室温,取6 mol·L-1氢氧化钠溶液或6 mol·L-1盐酸溶液中和,加稀释液溶解并稀释成每1 mL 约含拉莫三嗪0.4 mg 的溶液,滤过,取续滤液作酸、碱降解样品溶液;称取处方量空白辅料,同法配制,作为空白辅料降解溶液。
③ 氧化破坏:取本品粉末适量(约相当于拉莫三嗪20 mg),精密称定,加入30%过氧化氢溶液1 mL,90℃水浴加热约1 h,放置室温,加稀释液溶解并稀释成每1 mL 约含拉莫三嗪0.4 mg 的溶液,滤过,取续滤液作氧化降解样品溶液;称取处方量空白辅料,同法配制,作为空白辅料降解溶液。
④ 光照、高温破坏:分别取本品粉末适量,分别置105℃烘烤8 h、(4500±500)Lx 强度下光照3 d,精密称取细粉适量(约相当于拉莫三嗪20 mg),加适量稀释液溶解并稀释成每1 mL 中约含拉莫三嗪0.4 mg 的溶液,滤过,取续滤液即得光照、高温降解样品溶液;称取处方量空白辅料,同法配制,作为空白辅料降解溶液。
取上述各溶液,按“2.1”项下色谱条件进样,记录色谱图。结果空白辅料不干扰主成分峰、特定杂质峰的检测。拉莫三嗪峰与杂质B 和杂质C 分离较好。在高温、光照条件下,拉莫三嗪片较稳定,在酸、碱、氧化条件下所产生杂质均能与主峰良好分离,不干扰本品有关物质的测定(见图2)。

图2 样品破坏性试验色谱图Fig 2 Chromatogram of sample destruction test
2.4 相对保留时间
分别精密移取对照品储备液适量,加稀释液稀释成每1 mL 约含杂质B、杂质C 和拉莫三嗪均为0.5 μg 的混合液。对杂质B、杂质C 相对拉莫三嗪的保留时间在不同色谱柱[Welch、thermo、Agela、Kromasil C18(250 mm×4.6 mm,5 μm)]进行研究,杂质B 相对拉莫三嗪主峰保留时间(RRT)较稳定,均为0.8;杂质C 相对拉莫三嗪RRT 在1.5 ~1.7,其中Agela 色谱柱和Kromasil色谱柱的RRT 均为1.7。考虑到不同色谱柱对杂质C 的相对保留时间有一定的影响,对同一品牌(Kromasil)不同批次填料(色谱柱1 和色谱柱2)及不同序列号的色谱柱(色谱柱2 和色谱柱3)进行试验,结果杂质B 和杂质C 的相对保留时间都较稳定,相对拉莫三嗪主峰RRT 约为0.8、1.7,同时以系统适应性溶液按“2.3.1”项下条件进行杂质定位与验证。
2.5 线性关系与校正因子
根据“2.4”项下不同色谱柱考察结果,以Kromasil 色谱柱考察杂质B、杂质C 的校正因子。分别精密移取对照品储备液适量,稀释成一系列浓度的混合对照品溶液,取3 根不同色谱柱按“2.1”项下色谱条件进样,结果杂质B、杂质C与拉莫三嗪质量浓度在0.5 ~5 μg·mL-1与峰面积呈较好的线性关系,计算拉莫三嗪相对于杂质B、杂质C 的校正因子F(F=K杂质线性斜率/K拉莫三嗪线性斜率),结果杂质B 的平均校正因子为2.7,杂质C 的平均校正因子为1.4,结果见表3。
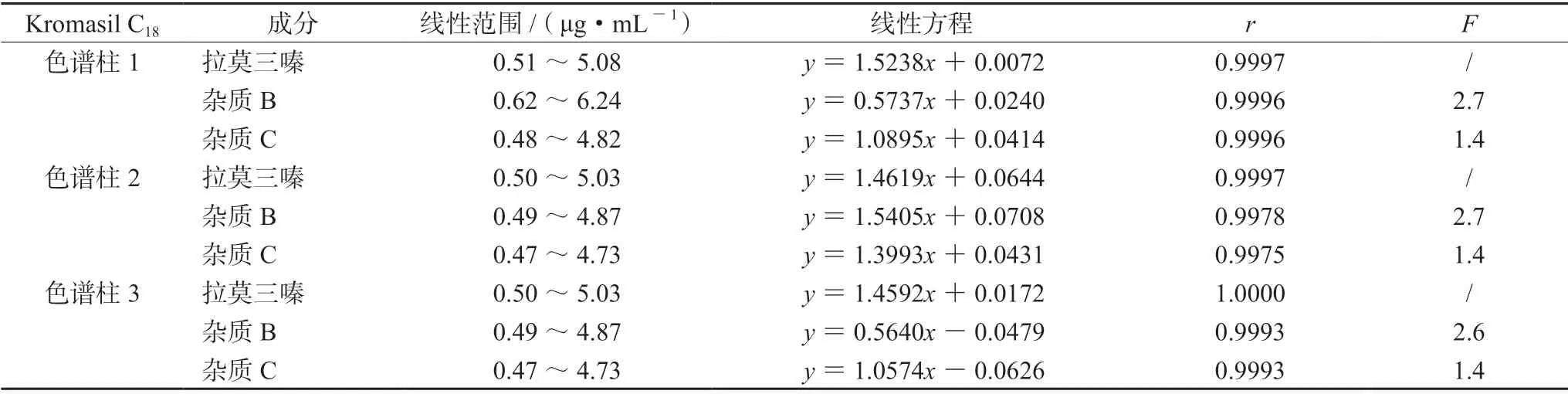
表3 杂质B、杂质C 和拉莫三嗪线性关系考察结果Tab 3 Linearity of impurity B,impurity C and lamotrigine
2.6 定量限和检测限
取“2.2.4”项下对照品储备溶液,精密移取对照品储备液适量,再用稀释液稀释成适当浓度的对照品溶液,照“2.1”项下方法进样。以信噪比(S/N)=3 为检测限,以S/N=10 为定量限,结果拉莫三嗪、杂质B、杂质C 的定量限分别为3.9、9.1、10.6 ng;检测限分别为1.3、2.7、3.3 ng。
2.7 稳定性试验
取“2.2”项下供试品溶液和对照溶液于室温下放置,另取杂质B、杂质C 对照品适量,精密称定,加适量甲醇溶解并用稀释液稀释成每1 mL 约含0.8 μg 杂质B 和2 μg 杂质C 的混合溶液,于室温下放置。供试品溶液于0、2、4.5、7、9.5、14、17.5、26 h 按“2.1”项下色谱条件分别进样;对照溶液于0、2、4.5、7、9.5、17.5、23.5、26 h 分别进样测定,杂质B 和杂质C 的混合溶液于0、2、4.5、6、8、10.5、13、19.5 h 分别进样测定。结果供试品溶液、对照溶液放置26 h,拉莫三嗪峰面积RSD分别为0.050%、1.7%,稳定性均较好。杂质B、杂质C 溶液放置19.5 h,峰面积RSD分别为0.90%、0.60%,稳定性均较好。
2.8 精密度与准确度
2.8.1 精密度试验 按“2.2”项下方法配制供试品溶液和对照溶液各 6 份,另取对照品储备溶液适量,分别加稀释液稀释成每1 mL 含杂质B 约0.8 μg、杂质C 约2 μg 的对照品溶液,按“2.1”项下色谱条件测定,结果供试品溶液拉莫三嗪、对照溶液拉莫三嗪、对照品溶液中杂质B 和杂质C 的保留时间和峰面积RSD均小于2.0%,表明仪器精密度良好。
2.8.2 中间精密度试验 由不同操作人员在不同时间和不同仪器分别按“2.8.1”项下方法测定,结果各成分峰面积RSD均小于2.0%,表明本法的中间精密度较好。
2.8.3 杂质回收试验与重复性 称取9 份拉莫三嗪片细粉(约相当于拉莫三嗪20 mg),置50 mL量瓶中,加适量稀释液溶解,再分别加每1 mL含杂质B 约 0.8 μg,杂质C 约2 μg 的对照品溶液1、2、3 mL(相当于杂质对照品溶液浓度的50%、100%、150%),各3 份,加入稀释液稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液。按“2.1”项下色谱条件进样检测,计算回收率并考察方法的重复性,结果各已知杂质回收率均满足0.1%杂质限度的回收率范围(90%~108%),回收率及重复性RSD均在5%以内,说明该方法的准确度及重复性较好。
2.9 耐用性试验
2.9.1 相对保留时间耐用性 取每1 mL 含杂质B约0.8 μg、杂质C 约2 μg、杂质E 0.4 μg 的对照品溶液,对流动相比例、柱温、流速、盐浓度、pH 值、色谱柱进行适当调整,考察方法的耐用性。结果表明主峰和各杂质峰均能达到良好的分离效果;杂质C 的相对保留时间主要受流动相的比例、柱温、流动相pH 值的影响,杂质B 的相对保留时间受的影响均较少。从耐用性试验的数据看,杂质B 和杂质C 的相对保留时间均较稳定,结果见表4。
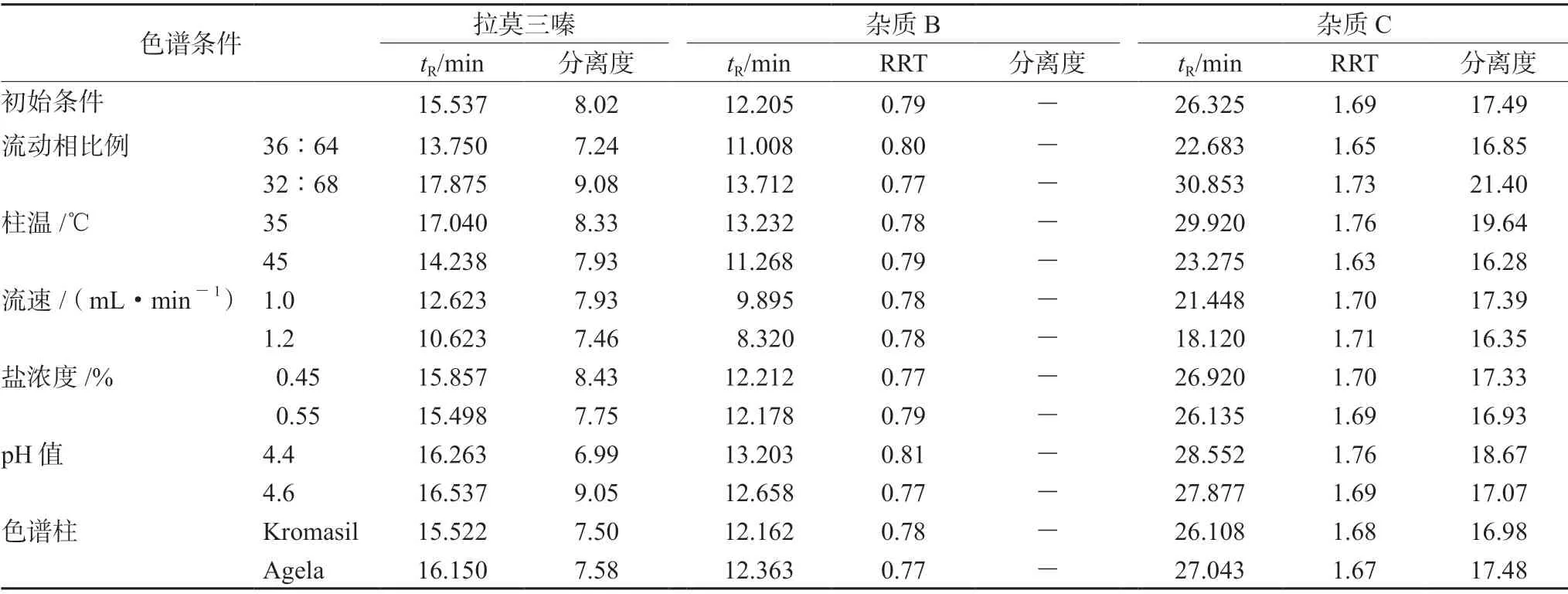
表4 耐用性试验结果汇总Tab 4 Summary of durability test
2.9.2 校正因子重现性 在确定好杂质B 和杂质C相对保留时间的基础上进行了校正因子的研究。对比了3 个实验室的方法学验证与校正因子复核数据,发现在拟定的液相色谱条件下,流动相种类和初始比例、检测波长、盐浓度、经系统适应性溶液验证后的仪器状态和色谱柱对校正因子的赋值没有明显影响,该方法的校正因子重现性主要受流动相pH 值以及实验员称量对照品的细微偏差的影响,但各实验室计算所得的校正因子数值均未高于本方法拟定的值,数据显示杂质B 和杂质C 校正因子在流动相pH 值4.45 ~4.55 内相对稳定。
2.10 有关物质的检查
照“2.1”项下方法,对3 批拉莫三嗪片长期稳定性(22 个月)考察样品进行有关物质的测定,按“2.2”项下方法配制供试品溶液、对照溶液、空白溶液进样测定,计算各杂质的含量、其他单个杂质的含量和杂质总量。结果3 批样品的杂质检查均符合规定,见表5。
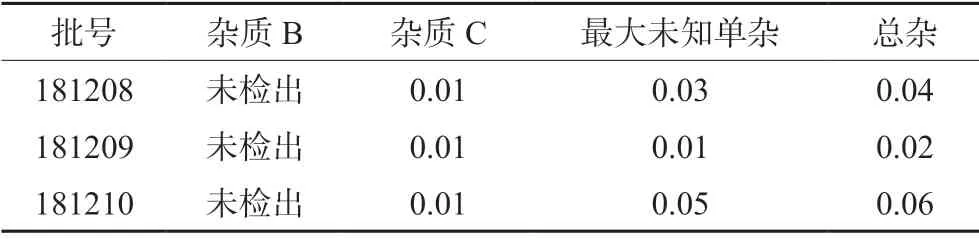
表5 拉莫三嗪片中有关物质的检测结果(%,校正因子法)Tab 5 Determination of related substances in lamotrigine tablets(%,calibration factor method)
3 讨论
3.1 流动相pH 值的考察
前期研究中发现流动相为甲醇-0.5%三乙胺溶液(用磷酸调节pH 值至3.0 ~5.0)时,拉莫三嗪与杂质B 分离度随流动相pH 值增加而增大,流动相调节pH 值至4.2 ~5.0 时拉莫三嗪与杂质B的分离度在5.61 ~13.08,本文选择pH 4.5 作为本方法流动相pH 值,能有效分离拉莫三嗪主峰与杂质B,且该pH 值条件下色谱柱的耐受性较好。
3.2 检测波长的考察
通过对氧化降解样品进行DAD 全波长扫描,发现在230 nm 波长处检测的杂质个数较多且基线平稳,结合各已知杂质的紫外扫描图,优选230 nm 作为本品有关物质的检测波长。
3.3 破坏试验方法的考察
拉莫三嗪在常规的高温、光照条件下,未见明显的杂质产生,说明拉莫三嗪在常规环境中相对较稳定。拉莫三嗪在加酸或碱的同时置90℃水浴中高温破坏,能生成杂质C 和少量的杂质E,氧化降解虽然能够同时产生杂质C、杂质B和少量的杂质E,但产生杂质C、杂质B 的量较少且氧化降解的产物复杂。本研究中以拉莫三嗪10 mg 加6 mol·L-1NaOH 溶液1 ~5 mL 置90 ℃水浴30 ~90 min 降解产生杂质C,放冷后用6 mol·L-1HCl 溶液中和,并加杂质B 对照品溶液的方法来制备系统适用性溶液,从而节省了从国外购买杂质C 的时间和成本。该系统适用性溶液可用于杂质B 和杂质C 相对保留时间的验证,进而用于拉莫三嗪原料药和制剂的有关物质分析。黄诺哲等[7]取拉莫三嗪加30%过氧化氢溶液3 mL 在80 ℃水浴15 min,色谱图显示可能氧化降解产生了少量的杂质D,本研究取拉莫三嗪加30%过氧化氢溶液1 mL 在90 ℃水浴1 h,在约49 min 杂质D 出峰处未见明显出峰或低于检测限,而在约37 min 处检出了少量的杂质E。本研究与文献报道不同[7],可能是由于氧化降解试验方法或者液相色谱检测方法不同引起的。
3.4 杂质含量的限定
拉莫三嗪片长期稳定性样品的检测数据显示杂质C 有增长趋势,从0 个月时的未检出到22 个月时检出0.01%,但未检出杂质E,最大单杂0.05%,总杂质0.06%,均符合企业制订的质量标准和国外药典标准,即杂质B(相对保留时间约0.8)按校正后的峰面积计算(乘以校正因子2.7),不得大于对照溶液主峰面积(0.2%);杂质C(相对保留时间约1.7)按校正后的峰面积计算(乘以校正因子1.4),不得大于对照溶液主峰面积的2.5 倍(0.5%);其他单个杂质峰面积不得大于对照溶液主峰面积(0.2%);各杂质峰面积的和按校正后的峰面积计算不得大于对照溶液主峰面积的3.75 倍(0.75%)。
3.5 本研究的不足
本试验中氧化降解还产生了4 个未知杂质,文献报道[7]氧化降解未知杂质,可能是3,5-二氨基-6-(2,3-二氯苯基)-2-氧基-1,2,4-三嗪或3,5-二氨基-6-(2,3-二氯苯基)-4-氧基-1,2,4-三嗪。本方法分离检测到的4 个未知氧化降解杂质有待进一步的LC-MS/MS 结构确证。拉莫三嗪虽然在60 ℃以内的条件下仍较稳定[7],但在加强酸或强碱或30%双氧水情况下并90 ℃水浴破坏试验中,可产生少量的杂质E,考虑到该杂质有降解途径,后续将对杂质E 进行质量标准制订的研究。此外,基于企业生产检验实际考虑,本研究未对影响杂质B 和杂质C 相对保留时间和校正因子的流动相比例、柱温、流动相pH 值进行更广泛、更深入的耐用性与验证研究。
3.6 小结
综上所述,本方法专属性强,能有效分离和检测样品中可能的工艺杂质和降解杂质,采用相对保留时间和校正因子来定量相关杂质,可应用于拉莫三嗪片和拉莫三嗪原料药中有关物质的质量控制。
