牛蒡根提取物指纹图谱研究
2021-09-04吴琼马群胡北崔亚玲何静王卓许子华北部战区总医院沈阳110016
吴琼,马群,胡北,崔亚玲,何静,王卓,许子华(北部战区总医院,沈阳 110016)
牛蒡根,又称恶实根,为菊科牛蒡属植物牛蒡Arctium lappaL.的肉质直根,牛蒡主要分布于广西、山东、安徽、辽宁、湖北、浙江等地,有去热、消肿的功效[1],常用于感冒、头痛、咳嗽、咽喉肿痛等疾病。中药是以多组分多靶点的作用方式对机体代谢网络综合作用而产生结果,因此用中药的指纹图谱来结合指标成分含量对中药材进行质量控制,既可量化、综合性地阐述中药的特征,又可以弥补单一有效成分定量控制模式的缺陷[2]。中药成分复杂,分离和测定均有一定的难度,因此能否选择主要的药物成分进行准确的分析,直接关系到对于该中药质量的评价[3]。并且考虑到实际应用的情况,成分是否可测又是指标成分选择的前提[4]。近年来,随着多种多样的仪器分析技术的出现,以及其在天然产物结构鉴定中的应用,牛蒡根中发现了越来越多的绿原酸类化合物[5],目前主要发现的已分离出来的化合物有1,5-二咖啡酰-3-苹果酰奎尼酸、3,5-二咖啡酰-1-(2-咖啡酰-4-苹果酰甲酯)-奎尼酸、3,5-二咖啡酰-1-(2-咖啡酰-4-苹果酰)-奎尼酸等[6]。有药理学研究表明,该类化合物具有明显的神经保护、抗癌、抗菌、抗氧化、降血脂及免疫调节等作用[7-14]。笔者通过文献检索发现,目前对牛蒡根药材质量控制标准研究尚不完整,对其化学成分的测定方法和指纹图谱研究尚浅。
中药指纹图谱是一种综合的、宏观的、可量化的手段,可反映中药化学成分的整体组成和特征。为进一步完善牛蒡根药材质量评价体系,本研究参考相关文献[15-16],采用高效液相色谱(HPLC)法建立了14 批牛蒡根药材的HPLC 指纹图谱,得到能够标示其特性的共有色谱峰图谱,为牛蒡根药材的应用及其内在质量的均一性提供全面的质量控制依据。
1 仪器与试药
1.1 仪器
岛津LC-16 系列高效液相色谱仪(SPD-16型紫外检测器、LC-16 型泵、SIL-16 型进样器、CTO-16 型柱温箱)(日本岛津仪器有限公司);Shimadzu AUW 120 D 十万分之一分析天平(日本Shimadzu 公司);2012 版中药色谱指纹图谱相似度评价系统(国家药典委员会);KQ3200 型超声波清洗器(昆山超声仪器有限公司,150 W,40 kHz);Agilent ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5 μm)(安捷伦)。
1.2 试药
3,5-二咖啡酰奎宁酸对照品(HPLC 纯度,四川省维克奇生物科技有限公司,批号:wkq20020403,纯度≥98%);甲醇、乙腈(色谱纯,Sigma 公司);磷酸(分析级,天津永大化学试剂有限公司);95%乙醇(美华公司,沈阳市辽河化工厂);双蒸水为自制。
14 批牛蒡根药材,产地分别为辽宁、山东、安徽、浙江、江西、吉林、广西、河北、湖北。将各产地编号为S1 ~S14,其中,S1(批号:191115)、S2(批号:191001)产地为安徽;S3(批号:191026)、S4(批号:20191103)产地为广西;S5(批号:191225)产地为河北;S6(批号:191101)、S7(批号:191201)产地为湖北;S8(批号:191210)产地为吉林;S9(批号:191210)产地为江西;S10(批号:20200326)产地为辽宁;S11(批号:200301)、S12(批号:200115)、S13(批号:200322)产地为山东;S14(批号:200325)产地为浙江。药材购于辽宁九州通医药有限公司、亳州三峰中药饮片有限公司。经北部战区总医院药检室何静副主任药师鉴定为菊科植物牛蒡Arctium lappaL.的干燥块根。
2 方法与结果
2.1 HPLC 色谱条件
色谱柱为Agilent ZORBAX SB-C18(250 mm×4.6 mm,5 μm);流动相为0.4%磷酸水溶液(A)-乙腈(B),梯度洗脱(0 ~25 min,10%→15%B;25 ~35 min,15%→20%B,35 ~60 min,20%→30%B);流速1.0 mL·min-1;检测波长330 nm;柱温35℃;检测时间为60 min;进样量:10 μL。
2.2 溶液的制备
2.2.1 对照品溶液的制备 取适量3,5-二咖啡酰奎宁酸对照品,精密称定,置于棕色量瓶中,加入少量甲醇,振摇使溶解,后加甲醇定容至刻度,制成每1 mL 含有3,5-二咖啡酰奎宁酸45 μg 的溶液,即得对照品溶液。
2.2.2 牛蒡根提取物的制备 称取各产地的牛蒡根药材适量置于圆底烧瓶中,加入10 倍量55%乙醇溶液浸泡过夜,次日回流提取,每次2 h,共2 次,合并提取液并过滤,分产地合并提取液。将各产地的提取液分别加热浓缩至含药材1 g·mL-1,4 ℃冰箱保存。
2.2.3 供试品溶液的制备 取浓缩后的提取液4 mL,置10 mL 棕色量瓶中,加入甲醇定容,静置24 h,取上清液,经0.45 μm 微孔滤膜过滤,取续滤液,即得。
2.3 指纹图谱
2.3.1 精密度试验 取牛蒡根提取物(S6)样品溶液,按照“2.2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件连续进样6 次,记录色谱图,将图谱导入《中药色谱指纹图谱相似度评价体系》(2012 版),计算相似度,相似度均为1.000。以6 号峰的保留时间(tR)和峰面积(A)为参照,计算得其他各共有峰相对于6 号峰的tR和A,结果显示指纹图谱中11 个共有峰的相对保留时间、相对峰面积的RSD值分别小于0.24%、3.7%,表明仪器精密度良好。
2.3.2 稳定性试验 取牛蒡根提取物(S6)样品溶液,按照“2.2.3”项下方法制备供试品溶液,分别在0、2、4、8、12、24 h 进样,按“2.1”项下色谱条件记录色谱图。将其导入《中药色谱指纹图谱相似度评价体系》(2012 版),得到各个样品的相似度,结果显示相似度均大于0.999。以6 号峰的相对保留时间(tR)和相对峰面积(A)为参照,计算得其他各共有峰相对于6 号峰的tR和A的RSD值分别小于0.32%、5.5%,表明牛蒡根提取物供试品溶液在常温下24 h 内稳定性良好。
2.3.3 重复性试验 取牛蒡根提取物(S6)样品溶液,按照“2.2.3”项下方法平行制备6 份供试品溶液,按“2.1”项下色谱条件进样,记录色谱图。将图谱导入《中药色谱指纹图谱相似度评价体系》(2012 版),得到各个样品的相似度,结果显示均大于0.999,以6 号峰的相对保留时间(tR)和相对峰面积(A)为参照,计算得其他各共有峰相对于6 号峰的tR和A的RSD分别小于0.090%、5.0%,表明该种分析方法的重复性良好。
2.3.4 指纹图谱建立 取14 批不同产地的药材,按“2.2.3”项下方法制备供试品溶液,根据“2.1”项下色谱条件进样测定,记录HPLC 色谱图,样品的色谱图导入《中药色谱指纹图谱相似度评价系统》(2012 版)软件进行分析,以中位数法生成对照图谱,时间窗宽度为0.1 min,经多点校正、自动匹配后生成牛蒡根提取物指纹图谱的共有模式如图1,对照指纹图谱见图2。
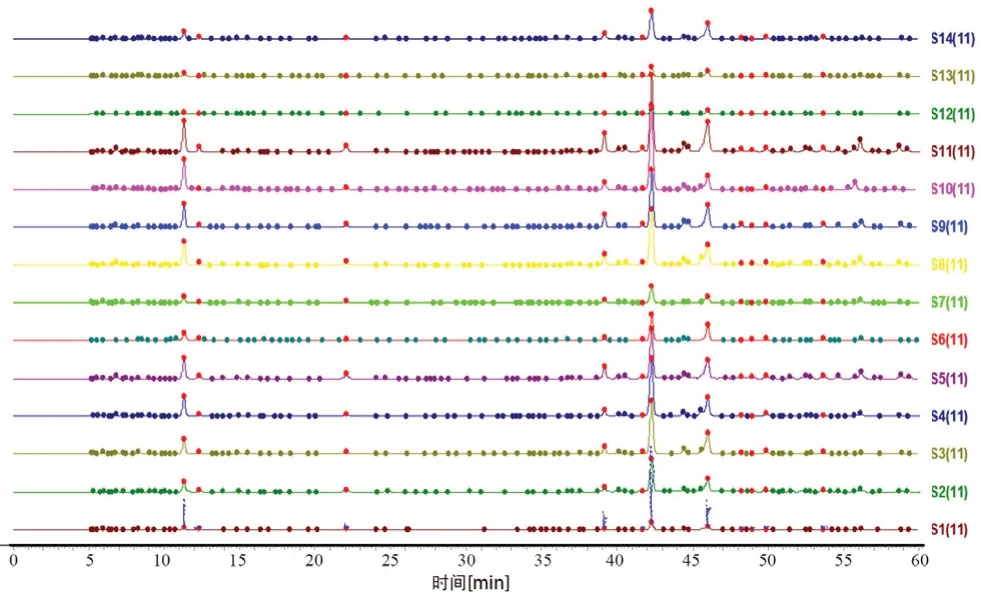
图1 14 批次牛蒡根提取物的指纹图谱Fig 1 HPLC fingerprints of 14 batches of Arctium lappa L.root
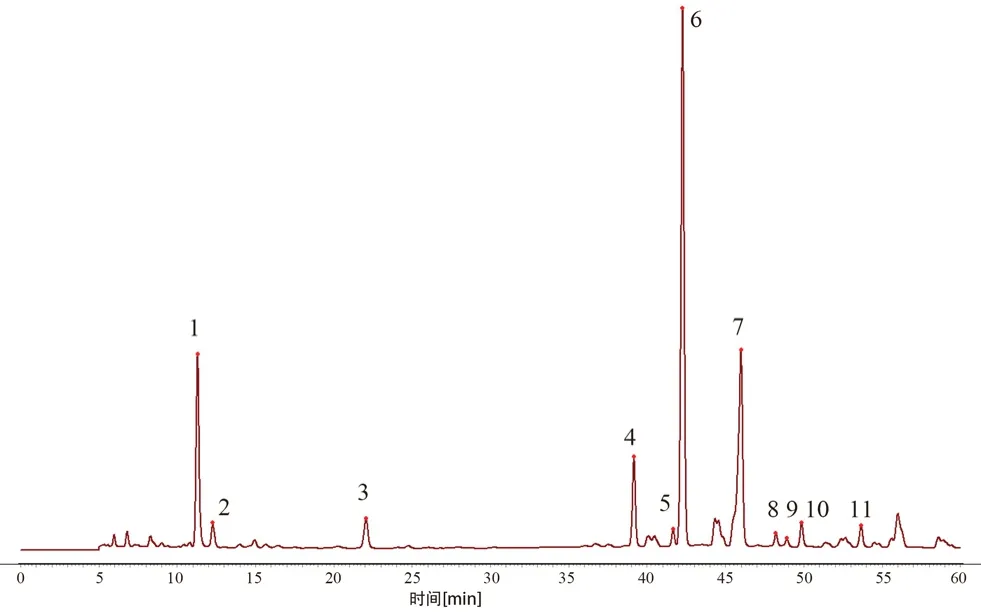
图2 牛蒡根提取物HPLC 对照指纹图谱Fig 2 Common HPLC model fingerprint of Arctium lappa L.root
2.3.5 共有峰的标定 通过对14 批牛蒡根提取物中的共有峰进行比对分析,利用《中药色谱指纹图谱相似度评价体系》(2012 版)的数据匹配功能,在对照指纹图谱上标定共有峰,牛蒡根提取物HPLC 指纹图谱共有11 个共有峰。同时与对照品色谱图(见图3)比对,可确认6 号峰为3,5-二咖啡酰奎宁酸。选择出峰时间适中、峰面积较大、对称性较好的6 号峰作为参照峰(S),分别计算其他各共有峰的相对保留时间和相对峰面积。结果见表1和表2。
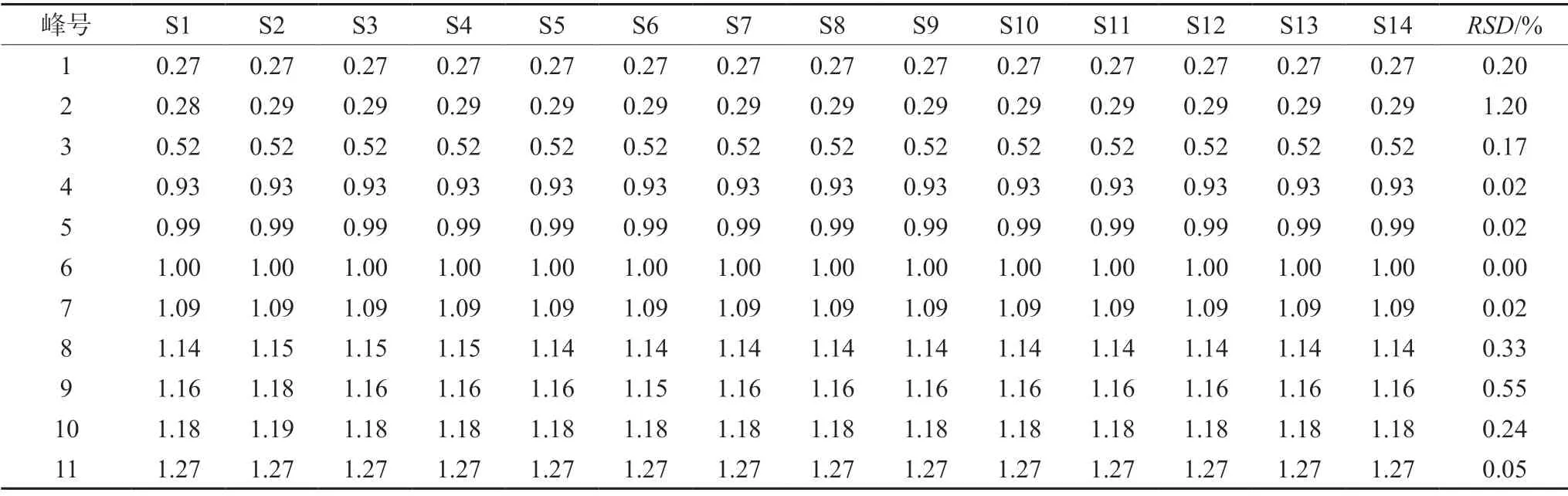
表1 牛蒡根提取物共有峰的相对保留时间Tab 1 Relative retention time of common peaks of Arctium lappa L.root
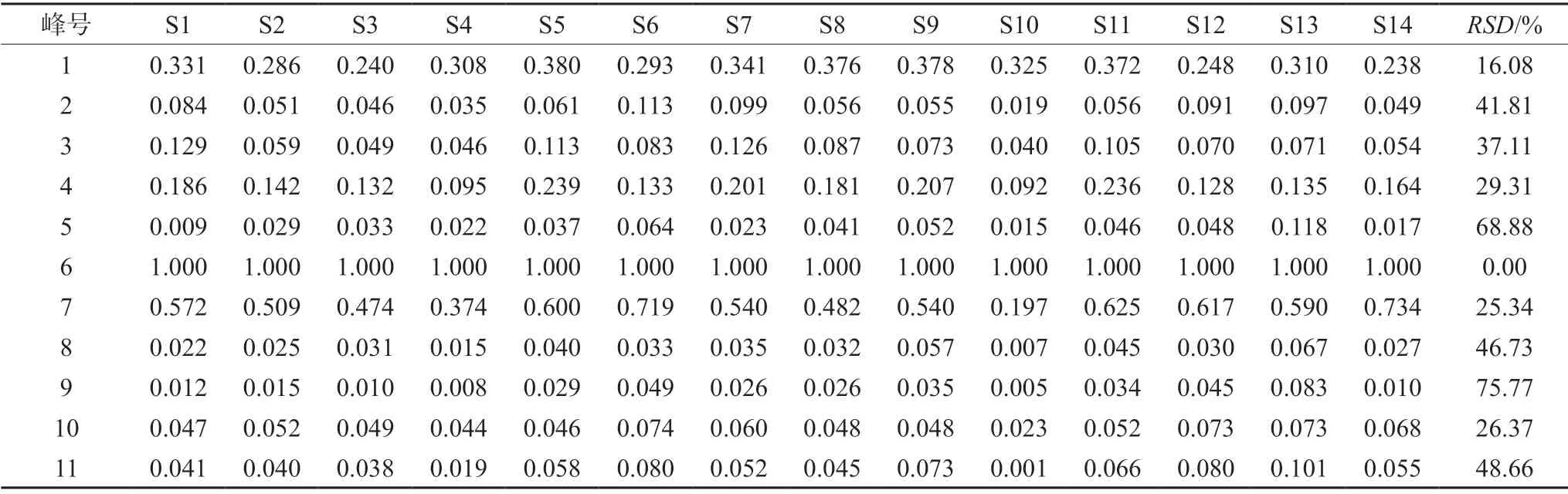
表2 牛蒡根提取物共有峰的相对峰面积Tab 2 Relative peak areas of common peaks of Arctium lappa L.root
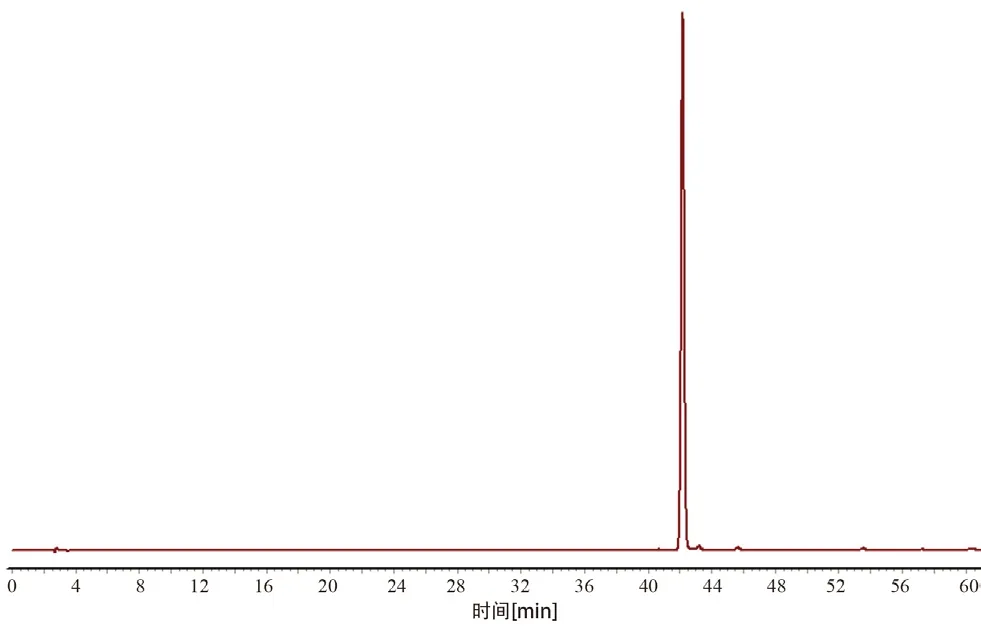
图3 对照品3,5-二咖啡酰奎宁酸的色谱图Fig 3 HPLC chromatogram of 3,5-dicaffeoylquinic acid
2.3.6 相似度评价 将各个批次的牛蒡根提取物指纹图谱分别导入《中药色谱指纹图谱相似度评价系统》(2012 版)软件,对各批次样品的指纹图谱与对照图谱进行相似度评价。从图1可以看出14 批牛蒡根药材的整体图貌基本一致。14 个产地的牛蒡根药材的相似度达到了0.966,有较好的相似性,见表3。
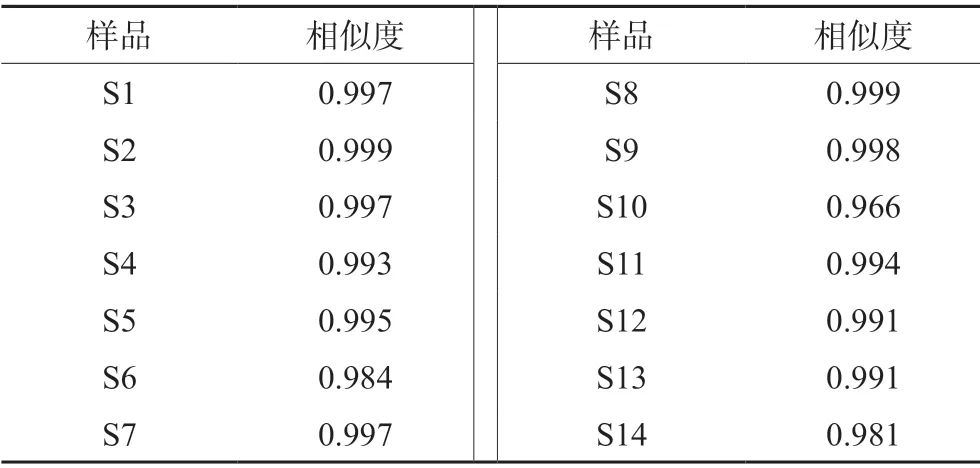
表3 牛蒡根提取物相似度Tab 3 Similarity of Arctium lappa L.root
2.3.7 系统聚类分析 分别将14 批牛蒡根提取物样品的HPLC 指纹图谱中各自的共有峰的峰面积数据导入SPSS 17.0 统计分析软件,采用组间联接法,以欧式平方距离作为分类的依据,对样品进行聚类分析,结果见图4。当欧氏距离大于10时,14 批牛蒡根药材主要被聚为两类,Ⅰ类包括S1 ~S9、S11 ~S14,各个批次的样品相似度较高(0.981 ~0.999),产地包括山东、安徽、浙江、江西、吉林、广西、河北、湖北,Ⅱ类为S10(辽宁产地,相似度0.966)。表明这14 批样品不完全相同,存在一定差异,但差异不大(整体在0.966 以上)。
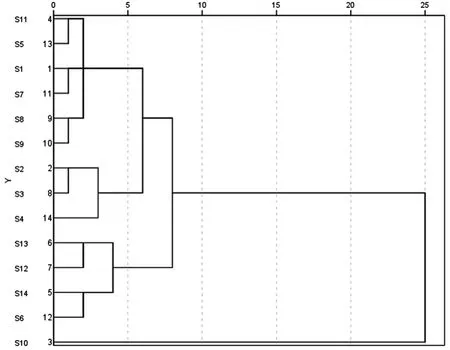
图4 14 批药材指纹图谱聚类分析的树状图Fig 4 Dendrogram of hierarchical clustering analysis of 14 batches of samples
3 讨论
本研究对牛蒡根检测的色谱条件进行了选择及优化,分别考察了甲醇/水、乙腈/水、甲醇/磷酸水、乙腈/磷酸水不同比例洗脱溶剂对HPLC 色谱图的影响,结果显示乙腈-0.4%磷酸水为较优溶剂;并进行了全波长扫描,结果显示330 nm 下色谱峰的数量较多,峰面积较大且分离度较好,故选择330 nm 作为检测波长。
对提取方法进行考察,比较了提取溶剂(水、甲醇、乙醇)和不同浓度乙醇(55%乙醇、65%乙醇、75%乙醇)溶液的提取效果。发现以55%的乙醇溶液为溶剂加热回流提取120 min,提取效果最优。同时比较了多种流动相的比例对于牛蒡根提取物的分离效果,结果表明使用乙腈(B)-0.4%磷酸水(A)梯度洗脱:0 ~25 min,10%~15%B;25 ~35 min,15% ~20%B;35 ~60 min,20%~30%B,并使用Agilent ZORBAX SB-C18色谱柱可以使样品中各组分得到良好的分离,且保留时间适中。该方法简洁方便,易于操作,还可减少对色谱仪的损耗,可准确测定牛蒡根药材中的指标成分。
指纹图谱中11 个共有峰相对保留时间的RSD值均小于 1.2%,表明本文建立的指纹图谱研究方法为一种稳定的共有模式,可以作为牛蒡根药材品质评价的方法。14 批样品相对峰面积RSD值较大,说明各批样品间组分含量差异较大,提示牛蒡根的品质与其产地密切相关,需对牛蒡根化学成分进行含量测定,阐明药材品质与产地之间的关系,进一步为临床使用牛蒡根提供依据。
从相似度分析结果可知,除 S10(辽宁)外,其他相似度均在 0.98 以上,说明不同产地的牛蒡根药材存在一定差异,但差异不大。同时从聚类分析结果可知,14 批牛蒡根药材聚为两类,区域特征不明显,与相似度分析结果相一致,说明牛蒡根药材质量稳定。
HPLC 在检测中药等物质中有很高的的应用价值,可以清晰指认分离药物中的各类活性物质[17]。本文通过建立牛蒡根药材的HPLC 指纹图谱,9 个产地的牛蒡根药材的图谱整体外形相近,且相似度也达到了0.966 以上,有较好的相似性。所建立的指纹图谱,共有峰数目达到11 个,且分离度较好、保留时间合适,相邻色谱峰之间的分离度较高,色谱峰强度也较大,且根据方法学的验证结果均满足要求。综上可采用HPLC 法对牛蒡根药材进行质量把控,并对牛蒡根药材进行综合宏观分析,可促进牛蒡根药材及其相关制剂的研发并对其质量的控制得到全面提高。
