黄芪增益方对小鼠免疫功能的影响
2021-09-04田俊娜王婷婷王双赵思俊朴晋华张蕻山西中医药大学山西晋中03069山西省食品药品检验所太原03003
田俊娜,王婷婷,王双,赵思俊*,朴晋华*,张蕻(.山西中医药大学,山西 晋中 03069;.山西省食品药品检验所,太原 03003)
免疫力是人体自身的一种防御机制,是人体识别和消灭外来入侵异物,清除衰老、死亡、病变细胞的能力,对维持生理生命活动具有十分重要的意义[1-3]。免疫力低下会诱导多种疾病的发生,严重影响人们的身体健康[4-5]。黄芪增益方是在六味地黄汤基础上化裁重组,去其“三泄”,取其“三补”,加黄芪[6]和党参[7],强化其增强免疫功能而制成的复方中药。本文通过小鼠腹腔注射环磷酰胺[8]制备免疫低下模型小鼠,评价黄芪增益方对小鼠的免疫功能的保健作用。
1 材料
1.1 仪器
HEMAET 950FS 五分类动物血液分析仪(美国DREM),YJ13B-G 煎药机(北京东华原医疗设备有限公司),ZC/LS-25A 电动耳肿打耳器(上海洛维生物科技有限公司),TU-1901 双光束紫外可见分光光度计(北京普析通用仪器有限责任公司),涡旋混匀器(德国IKA)。
1.2 试药
黄芪增益方,按黄芪-党参-熟地黄-山茱萸-山药=3∶3∶4∶2∶2 的比例称取中药饮片,加10 倍量水煎煮两次,每次1 h,合并滤液,85 ℃浓缩至1 g(生药)·mL-1,得黄芪增益方水提液。经紫外分光光度计,采用蒽酮-硫酸法,得出方中多糖含量为65.72%。
匹多莫德分散片(北京金城泰尔制药有限公司,批号:190706),注射用环磷酰胺(山西普德药业有限公司,批号:04200501),2,4-二硝基氟苯(DNFB,麦克林,批号:C10654004),印度墨汁(Phygene,批号:20200710),小鼠免疫球蛋白A(lgA)及小鼠白介素4(IL-4)ELASA试剂盒(武汉默沙克生物科技有限公司,批号:202012、202012)。
1.3 实验动物
SPF 级ICR 小鼠,雄性,240 只,体质量18 ~22 g [斯贝福(北京)生物技术有限公司,合格证号110324200101980161],饲养于SPF 级动物室,环境温度控制在20 ~25℃,相对湿度40%~70%,12 h 明暗交替,小鼠可自由摄食饮水。
2 方法
2.1 模型的制备与分组给药
取小鼠90 只,分为6 组,即空白组,模型组,阳性药组,黄芪增益方高、中、低剂量组,每组15 只。空白组与模型组以纯化水10 mL/(kg·d)灌胃;阳性组以匹多莫德分散片0.12 g/(kg·d)灌胃,高剂量组以9.6 g(生药)·kg-1、中剂量组4.8 g(生药)·kg-1、低剂量组2.4 g(生药)·kg-1灌胃,灌胃体积10 mL /(kg·d),连续给药4 周。在第3 周后开始腹腔注射环磷酰胺80 mg/(kg·d)造模,空白组动物腹腔注射0.9%氯化钠注射液10 mL/(kg·d),每日一次,连续3 d,制备免疫功能低下模型小鼠。造模期间,连续给药,直至给药结束。
2.2 观察指标及检测方法
2.2.1 外周血白细胞数量的测定 给药4 周后,从小鼠眼内眦静脉采血于抗凝管中,送全自动血细胞分析仪测定白细胞、淋巴细胞、嗜中性粒细胞数量。
2.2.2 小鼠脏器指数的计算 实验结束后,称取各组小鼠体重后,拉颈处死小鼠,取脾脏和胸腺,滤纸吸取表面残留血液、水分,称量脾脏、胸腺重量,计算脏器指数。小鼠胸腺指数=胸腺质量(mg)/体质量(g);小鼠脾脏指数=脾脏质量(mg)/体质量(g)。
2.2.3 小鼠脾淋巴细胞增殖能力 取小鼠脾脏,无菌操作,制成单细胞悬液,用Hank’s 液洗细胞2 次,每次离心10 min(1000 r·min-1),取1 mL RPMI1640 细胞完全培养液悬浮细胞,调整细胞浓度至3×106个·mL-1。将细胞悬液加入24 孔培养板中,每孔1 mL,每只小鼠脾细胞设置两个复孔,一孔加75 μL ConA 液(终浓度7.5 μg·mL-1),另一孔作为空白对照,37℃5%CO2培养72 h。培养结束前4 h,每孔轻轻吸去上清液0.7 mL,加入0.7 mL 不含小牛血清的RPMI1640培养液,同时加入MTT(5 mg·mL-1)50 μL,继续培养4 h。培养结束后,每孔加入1 mL DMSO,充分震荡,使紫色结晶完全溶解。然后分装到96孔培养板中,每孔分装3 孔作为平行样,用酶标仪,在570 nm 波长处,测定光密度值(OD)。用加ConA 孔的OD减去不加 ConA 孔的OD代表淋巴细胞增殖能力,分别比较各组与空白对照组的OD差值的情况。
2.2.4 小鼠组织病理 取各组脾脏、胸腺、骨髓组织用固定液固定,石蜡包埋、切片,HE 染色,显微镜下观察小鼠脾脏、胸腺、胸骨骨髓病理变化。
2.2.5 小鼠血清中lgA、IL-4 的测定 采用ELASA试剂盒,严格按照说明书操作,检测血清中lgA、IL-4 的含量。
2.2.6 对正常小鼠单核-巨噬细胞功能的影响 取ICR 小鼠,随机分为空白组,阳性药组,黄芪增益方高、中、低剂量组,每组15 只,给药剂量同“2.1”项下。给药4 周后,称取小鼠体质量,从小鼠尾静脉注入0.1%Na2CO3稀释的印度墨汁(1∶25,0.1 mL/10 g)。2、10 min 后分别从内眦静脉丛取血20 μL,并立即将其加到2 mL 0.1%Na2CO3溶液中,用紫外分光光度计在600 nm 波长处测定其光密度值(OD),分别记为OD1和OD2,以0.1%Na2CO3溶液作空白对照,计算校正系数(K),K=(lgOD1-lgOD2)/(t2-t1)。将小鼠处死,取肝脏和脾脏,用滤纸吸干脏器表面血污,称质量。以吞噬指数表示小鼠碳廓清的能力,吞噬指数=体质量/(肝质量+脾质量)×K1/3。
2.2.7 对正常小鼠迟发型变态反应的作用 取ICR 小鼠,分为空白组,阳性药组,模型组,黄芪增益方高、中、低剂量组,每组15 只,给药剂量同“2.1”项下。给药3 周后,将小鼠腹部脱毛,范围约 3 cm×3 cm、用 DNFB 溶液50 μL 均匀涂抹致敏造模。5 d 后,取10 μL DNFB 溶液(10 mg·mL-1)均匀涂抹于小鼠右耳(两面)进行攻击,攻击后 24 h 后颈椎脱臼处死小鼠,剪下左右耳壳。用打孔器取下直径8 mm 的耳片,称重,以左右耳重量之差作为肿胀度。
2.3 统计学方法
采用 SPSS 22.0 统计软件对数据进行分析,结果用均数±标准差表示,以P<0.05 为差异有统计学意义,方差齐且呈正态分布的计量资料采用单因素方差分析(One-Way ANOVA),组间有差异者进一步采用 Dunnet-t检验分析,其他计量资料采用秩和检验两两比较等非参数检验(本实验中脾淋巴细胞方差不齐,采用非参数检验)。
3 结果
3.1 对免疫功能低下小鼠的影响
3.1.1 一般情况 空白组小鼠精神状态良好,活动自如,毛色光滑;模型组小鼠蜷缩,活动不佳,毛色欠佳,粗糙,蓬松;与模型组相比,黄芪增益方各剂量组和阳性对照组小鼠精神状态较好,明显优于模型组,毛色较光滑。
3.1.2 对小鼠外周血白细胞数量的影响 与空白组相比,模型组白细胞、淋巴细胞、嗜中性粒细胞数量显著降低(P<0.01);与模型组相比,黄芪增益方高剂量组、阳性组白细胞、淋巴细胞、嗜中性粒细胞数量均显著升高(P<0.05 或P<0.01),黄芪增益方中剂量嗜中性粒细胞数量显著升高(P<0.01),提示黄芪增益方可上调免疫功能低下小鼠的外周血细胞增强细胞免疫(见图1)。
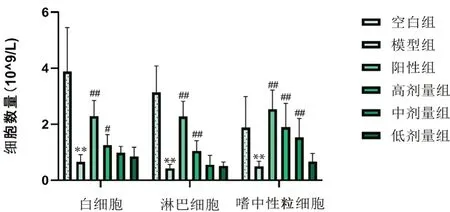
图1 黄芪增益方对免疫抑制小鼠外周血细胞的影响Fig 1 Effect of Huangqi Zengyi formula on the peripheral blood cells of immunosuppressive mice
3.1.3 对小鼠脏器指数的影响 由图2可知,模型组脾脏指数、胸腺指数明显低于空白组(P<0.01),环磷酰胺可使小鼠免疫功能受到抑制,提示免疫低下模型小鼠制备成功。与模型组相比,黄芪增益方高剂量组脾脏指数、胸腺指数显著升高(P<0.01),说明其可促进免疫低下小鼠免疫器官的发育。
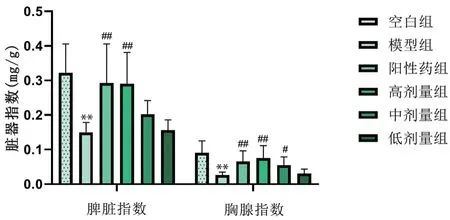
图2 黄芪增益方对小鼠脏器指数的影响Fig 2 Effect of Huangqi Zengyi formula on the organ index
3.1.4 对小鼠脾淋巴细胞增殖的影响 由图3可以看出,模型组小鼠脾淋巴细胞增殖能力显著低于空白组(P<0.01);与模型组相比,高剂量组脾淋巴细胞转化能力显著提高(P<0.01),提示黄芪增益方可能增强免疫低下小鼠的细胞免疫功能。
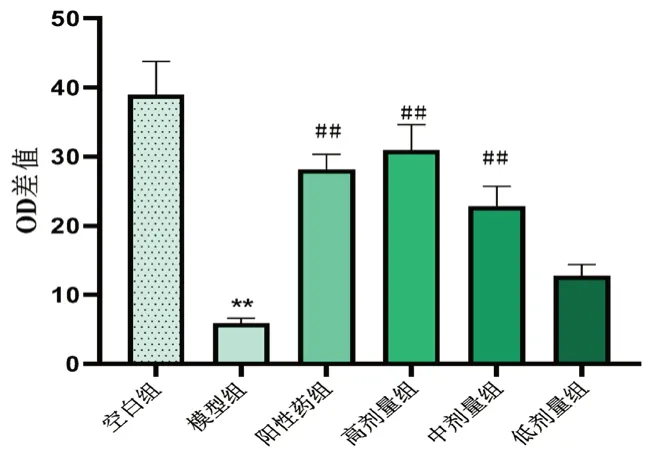
图3 黄芪增益方对免疫抑制小鼠脾淋巴细胞转化的影响Fig 3 Effect of Huangqi Zengyi formula on the splenic lymphocyte transformation in immunosuppressive mice
3.1.5 对小鼠组织病理的影响 生物光学显微镜下观察各组织病理变化,见图4~6。脾脏空白组白髓与红髓分布均匀,而模型组红髓偏多,且出现空泡状。与模型组相比,黄芪增益方各剂量组白髓显著增多,且分布均匀,说明淋巴细胞增多。空白组可见胸腺细胞分布均匀,未发现组织细胞病变坏死,而模型组胸腺组织稀疏,胸腺细胞减少。与模型组相比,黄芪增益方各剂量组胸腺细胞显著增多。骨髓空白组可见骨髓细胞分布均匀,而模型组骨髓细胞明显稀疏。与模型组相比,黄芪增益方各剂量组胸骨骨髓细胞明显增多,提示黄芪增益方可改善免疫抑制小鼠免疫器官脾、胸腺与骨髓的免疫功能。
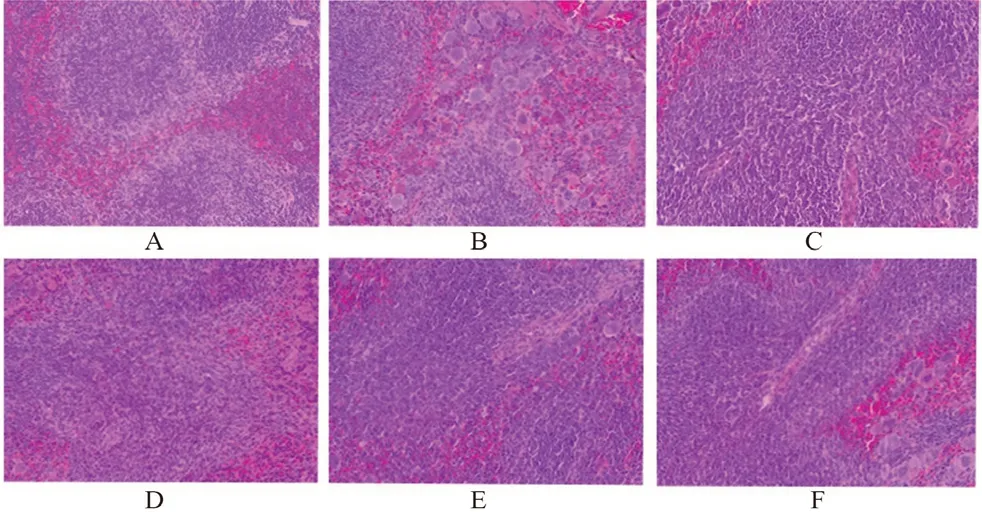
图4 黄芪增益方对小鼠脾脏病理形态影响(HE,200×)Fig 4 Effect of Huangqi Zengyi formula on the pathomorphology of spleen in mice(HE,200×)
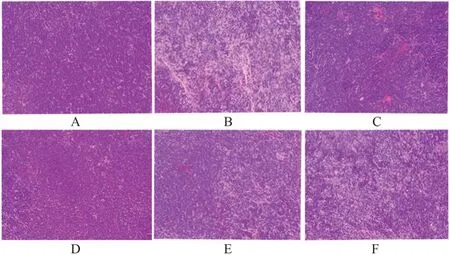
图5 黄芪增益方对小鼠胸腺病理形态影响(HE,200×)Fig 5 Effect of Huangqi Zengyi formula on the pathomorphology of the thymus in mice(HE,200×)
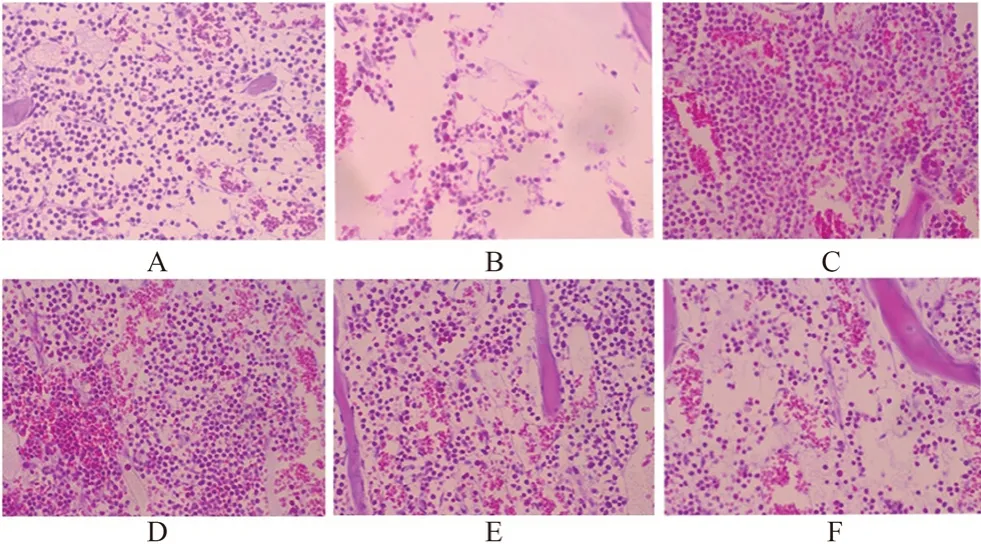
图6 黄芪增益方对小鼠胸骨骨髓病理形态影响(HE,400×)Fig 6 Effect of Huangqi Zengyi formula on the pathomorphology of the sternal bone marrow in mice(HE,400×)
3.1.6 对小鼠血清中lgA、IL-4 的调节作用 与空白组相比,模型组血清中细胞因子lgA、IL-4含量显著降低(P<0.05)。与模型组比较,除低剂量组之外,其余各剂量组lgA、IL-4 均上调(P<0.01),提示黄芪增益方可通过上调免疫低下小鼠血清体液因子的含量,增强体液免疫功能(见表1)。
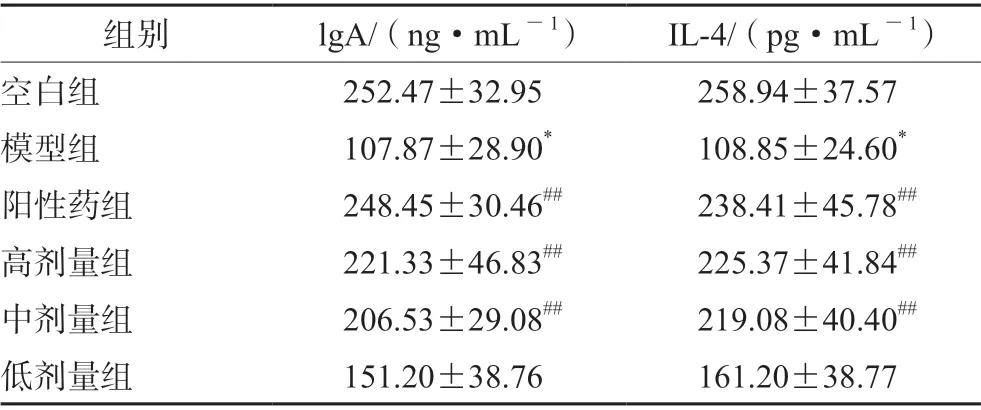
表1 黄芪增益方对小鼠细胞因子lgA、IL-4 水平的影响Tab 1 Effect of Huangqi Zengyi formula on the level of cytokines lgA and IL-4 in mice
3.2 对正常小鼠单核-巨噬细胞功能的影响
与空白组相比,阳性药组,黄芪增益方高、中剂量组吞噬指数显著升高(P<0.01),结果见图7,提示黄芪增益方可能通过促进小鼠巨噬细胞的吞噬能力,提高机体固有免疫应答。
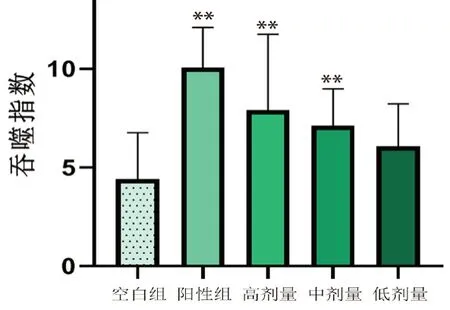
图7 黄芪增益方对正常小鼠巨噬细胞吞噬细胞的影响Fig 7 Effect of Huangqi Zengyi formula on the phagocytes of macrophages in normal mice
3.3 对小鼠迟发型变态反应的抑制作用
与空白组相比,模型组小鼠耳廓肿胀度明显升高(P<0.01),与模型组相比,黄芪增益方高、中剂量组对耳肿胀度有明显抑制作用(P<0.01),提示黄芪增益方具有增强免疫的作用,结果见图8。
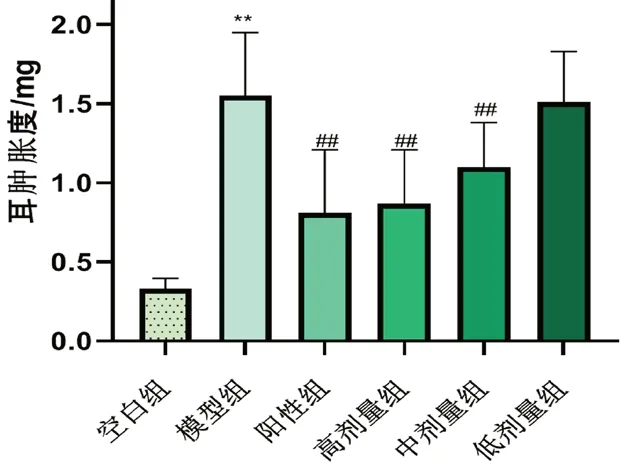
图8 黄芪增益方对小鼠的迟发型变态反应的抑制作用Fig 8 Effect of Huangqi Zengyi formula on the delayed allergic in mice
4 讨论
免疫系统包括免疫器官、免疫细胞和免疫分子,共同发挥作用保护人体免受病原体的侵害[9]。胸腺和脾脏是主要的免疫器官,在产生和维持免疫细胞中起着至关重要的作用[10-12]。巨噬细胞是机体抗病原生物入侵的第一道防线,吞噬病原生物并将抗原信息呈递给T 细胞激活适应性免疫反应[13]。淋巴细胞是免疫系统中的重要细胞,在人体的外周血和淋巴液中循环,促进机体的体液免疫与细胞免疫,参与抗癌的重要细胞[14-15]。
2020年版《允许保健食品声称的保健功能目录 非营养素补充剂(征求意见稿)》中关于增强免疫力功能部分新增,可采用免疫功能低下的模型动物进行实验,因此本实验采用免疫低下模型与正常小鼠进行实验,采用腹腔注射环磷酰胺建议免疫低下模型[16-18]。在脾淋巴细胞转化实验中,对ConA液浓度进行了预试,分别采用终质量浓度为4、5、6、7.5、8、9、10、11 μg·mL-1,结果表明,7.5 μg·mL-1是刺激脾淋巴细胞增殖的最佳浓度。
本文探讨了黄芪增益方对小鼠免疫功能的调节作用,结果表明,连续给药4 周后,免疫低下模型小鼠外周血白细胞、淋巴细胞、嗜中性粒细胞数显著升高,且胸腺、脾脏指数显著升高;脾淋巴细胞转化能力显著提高;HE 染色结果表明黄芪增益方可改善免疫器官与胸骨骨髓的免疫功能;ELASA 实验表明黄芪增益方可显著提高细胞因子lgA、IL-4 的表达;黄芪增益方对非特异免疫也具有很好的效果,可显著提高免疫抑制小鼠的单核-巨噬细胞吞噬能力;在细胞免疫中,随着黄芪增益方剂量的增大,小鼠耳肿胀度呈现显著降低趋势;说明黄芪增益方可增强小鼠的免疫调节作用。
综上所述,黄芪增益方可从多方面改善免疫状态,增强机体免疫效果,但其作用机制还需进一步进行深入的探究。
