人参皂苷Rh3联合多西他赛抑制PC3肿瘤细胞的增殖、迁移和侵袭
2021-09-04孟佳佳王丹丹王陈萍南通市第三人民医院临床药学部江苏南通226003
孟佳佳,王丹丹,王陈萍(南通市第三人民医院临床药学部,江苏 南通 226003)
前列腺癌(prostate cancer,PCa)是常见的男性泌尿生殖系统的恶性肿瘤,在西方国家中PCa 位居男性新发恶性肿瘤的第1 位,病死率在恶性肿瘤中居第3 位[1]。我国PCa 的发病率呈现逐年上升的趋势,已成为我国男性常见的恶性肿瘤之一[2]。目前对PCa 缺乏安全有效的治疗措施。
多西他赛(docetaxel)属于第二代紫杉醇类化疗药物,能减轻PCa 患者的症状,提高生存率和生活质量,但其产生的不良反应和耐药性不可忽视[3]。然而,在治疗PCa 中,多西他赛与药物最佳联合及最小不良反应的治疗方案仍然缺乏。
人参在中国已有数千年的食用和药用历史,经常被用于预防和治疗多种疾病,是非常宝贵的补品。人参皂苷是人参的主要药理活性成分,因其广泛的生物活性而闻名。人参皂苷有几种不同的化合物,包括Rb1、Rb2、Rc、Rd、Re、Rf、Rg1、Rg2、Rg3、Rh1、Rh2、Rh3等。 其中最常研究的人参皂苷为Rg3、Rg1、Rb1、Rh1、Re 和Rd[3]。有研究表明,某些人参皂苷,例如Rg1、Rg2、Rg3和Rh2具有诱导凋亡,抑制增殖或抑制迁移的抗肿瘤活性[4-5]。由于人参皂苷Rh3是稀有的人参皂苷之一,因此对其生物活性了解甚少。
本研究旨在评价人参皂苷Rh3联合多西他赛化疗对PC3 前列腺肿瘤细胞的细胞增殖、迁移和侵袭的影响。
1 材料
1.1 肿瘤细胞
人前列腺癌细胞PC3(中国科学院上海细胞库),复苏后接种于F-12K 培养基、10%胎牛血清和1%青链霉素混合液组成的培养液中,37℃、5% CO2条件下常规培养。
1.2 仪器
酶标仪(德朗公司,DR-200Bs);细胞培养箱(赛默飞世尔科技公司,150iC02);生物净化工作台(苏州苏洁净化设备公司,VS-1300U);离心机(德国Eppendorf 公司,5424r);4℃、-20℃和80℃超低温冰箱(海尔公司);移液器(德国Eppendorf 公司);显微镜(OPTEC 公司,TP510);电泳槽(北京百晶生物,BG-transBLOT);Transwell小室(353097,Falcon),细胞培养瓶(Corning 公司,25 cm2);培养皿(Corning 公司,100 mm2),1.5 mL EP 管(AXYGEN,MCT-150-C)。
1.3 试药
多西他赛(批号:D107320,规格:10 mg,上海阿拉丁生化科技股份有限公司),人参皂苷Rh3(批号:89007,规格:20 mg,北京中科质检生物技术有限公司),WST-1 细胞增殖及细胞毒性检测试剂盒(批号:C0036,碧云天生物技术有限公司),Matrigel(批号:354234,BD),结晶紫染色液(批号:C0121)、BCA 蛋白浓度测定试剂盒(批号:P0012S)、HRP 标记二抗(批号:A0201)(碧云天生物技术有限公司),E-cadherin 抗体(批号:20874-1,00082672,Proteintech),N-cadherin 抗体(批号:A01577-2,15D39,博士德),GAPDH 抗体(批号:60004-1,0004237,Proteintech)。
2 方法
2.1 细胞活力检测
使用WST-1 细胞增殖及细胞毒性检测试剂盒分别检测人参皂苷Rh3和多西他赛对PC3 细胞活力的影响。在96 孔板每孔加入100 μL(2000个)PC3 细胞,人参皂苷Rh3实验组分别加入0、5、10、20、40、80、160 和320 μmol·L-1人参皂苷Rh3[6-7];多西他赛实验组分别加入0、1、2、4、8、16、32 和64 nmol·L-1的多西他赛(用二甲基亚砜配制)[8-9]。0 浓度组为阴性对照组,加入等体积溶剂。培养24 h 后,每孔加入10 μL WST-1 溶液,孵育2 h,把96 孔板置于摇床上摇动1 min,在450 nm 测定吸光度(A值)。细胞增殖抑制率 =(1-实验组平均A值/阴性对照组平均A值)×100%。
2.2 细胞划痕方法
PC3 肿瘤细胞常规方法扩增细胞数量,用胰酶消化,制备1×106个·mL-1细胞悬液,将500 μL 细胞悬液加入预先放置隔板的24 孔板中,实验分为对照组、人参皂苷Rh3组(Rh3组,10 μmol·L-1)、多西他赛组(Doc 组,2 nmol·L-1)、人参皂苷Rh3和Doc 联合用药组(Rh3+Doc组),细胞培养箱中孵育24 h,取出隔板,拍摄所形成划痕的初始宽度。加入干预药物后继续培养24 h 和48 h 后拍摄划痕宽度。
2.3 细胞侵袭实验-Transwell 法
同“2.2”项下方法分组,用预冷的基础培养基稀释Matrigel,并取40 μL 加入预冷的Transwell 小室中;将PC3 肿瘤细胞制成2×105个·mL-1含干预药物的单细胞悬液,取200 μL体积细胞悬液加入Transwell 小室。下室加入500 mL 完全培养基,细胞培养箱中培养24 h 后取出Transwell 小室,4%多聚甲醛溶液固定25 min,0.1%结晶紫染色30 min,晾干后包被基底膜,显微镜拍照后进行细胞记数。
2.4 Western blot 法
同“2.2”项下方法分组,收集各组细胞,提取总蛋白质,用BCA 蛋白浓度测定试剂盒对蛋白浓度进行测定,严格按照试剂盒说明书进行操作。制备电泳胶,在上样孔加入10 μL 蛋白和蛋白电泳marker,电泳并转PVDF 膜,封闭后。分别加E-cadherin 抗体(1∶10 000),N-cadherin 抗体(1∶1000),GAPDH 抗体(1∶20 000),孵育过夜,继续孵育HRP 标记的二抗,HRP-ECL 发光法进行分析并扫描。
2.5 统计学方法
数据采用SPSS 19.0 统计软件分析,计量资料用±s表示,组间差异比较采用方差分析或t检验,P<0.05 为差异具有统计学意义。
3 结果
3.1 人参皂苷Rh3 和多西他赛抑制PC3 肿瘤细胞增殖
人参皂苷Rh3和多西他赛处理PC3 细胞24 h的细胞增殖抑制率,结果见表1。随着人参皂苷Rh3、多西他赛的浓度增大,PC3 细胞增殖抑制率逐渐升高。根据浓度梯度和细胞抑制率结果,后续实验Rh3和多西他赛分别选择10 μmol·L-1和2 nmol·L-1浓度进行处理。

表1 人参皂苷Rh3 和多西他赛对PC3 细胞增殖抑制率(24 h)Tab 1 Inhibition rate of PC3 cell proliferation by ginsenoside Rh3 and docetaxel (24 h)
3.2 人参皂苷Rh3 和多西他赛抑制PC3 肿瘤细胞迁移
划痕法测细胞的迁移能力结果见图1。结果显示,细胞愈合24、48 h,与对照组比较,人参皂苷Rh3组和多西他赛组明显抑制PC3 细胞迁移(P<0.05,P<0.01),两者联合处理效果更佳(P<0.01)。

图1 人参皂苷Rh3 和多西他赛对PC3 细胞迁移的影响(100×)Fig 1 Effect of ginsenoside Rh3 and docetaxel on PC3 cell migration(100×)
3.3 人参皂苷Rh3 和多西他赛抑制PC3 肿瘤细胞侵袭
通过Transwell 法测细胞的侵袭能力。结果显示,人参皂苷Rh3和多西他赛组PC3 细胞数量明显少于对照组,表明人参皂苷Rh3和多西他赛明显抑制细胞侵袭(P<0.05),联合处理组效果更好(P<0.01)(见图2)。
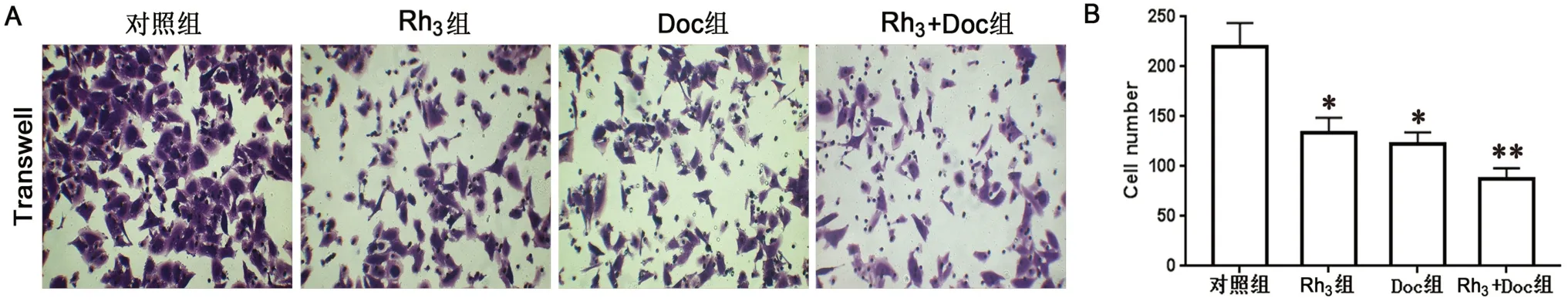
图2 人参皂苷Rh3 和多西他赛对PC3 细胞侵袭的影响(100×)Fig 2 Effect of ginsenoside Rh3 and docetaxel on the invasion of PC3 cells (100×)
3.4 人参皂苷Rh3 和多西他赛抑制PC3 肿瘤细胞上皮-间质转化
E-cadherin 为上皮标记蛋白,N-cadherin 为间质标记蛋白,通过Western blot 法检测两者表达水平,进一步说明肿瘤细胞的迁移和侵袭能力及其分子机制。结果显示,人参皂苷Rh3和多西他赛均能上调E-cadherin 蛋白表达水平和下调N-cadherin 蛋白表达水平(P<0.05),两药联用作用效果更为显著(P<0.01)(见图3)。

图3 人参皂苷Rh3 和多西他赛对PC3 细胞上皮-间质关键蛋白E-cadherin 和N-cadherin 表达水平的影响Fig 3 Effect of ginsenoside Rh3 and docetaxel on the expression of E-cadherin and N-cadherin in PC3 cells
4 讨论
PCa 是临床泌尿外科常见的恶性肿瘤,中晚期PCa 的发病率逐年升高。多数PCa 患者确诊时已为中晚期,经过内分泌治疗后,逐渐发展为去势抵抗前列腺癌(castration-resistant prostate cancer,CRPC),化疗是CRPC 的重要治疗手段[9]。紫杉类药物被认为是治疗PCa 最有效的化疗药物。多西他赛为紫杉醇的半合成衍生物,虽然已广泛应用于PCa 患者的辅助化疗和CRPC 的治疗[10],但绝大多数患者在用药过程中出现药物耐药现象和不良反应[5,11]。因此,寻求一种新的有效的治疗PCa 方法是有必要的。
人参皂苷是人参中最重要和最主要的药理活性成分,研究表明,人参皂苷Rg1、Rg2、Rg3和Rh2具有诱导细胞凋亡、抑制增殖或抑制迁移的抗肿瘤活性[3,12]。人参皂苷Rh3在人参属药材中含量很低,为稀有的人参皂苷,但其制备工艺已得到大幅提升,为人参皂苷Rh3的研究和应用提供了极大地便利[13]。
人参皂苷Rh3通过抑制乙酰胆碱酯酶(AChE)活性、增加脑源性神经营养因子表达和cAMP 反应元件结合蛋白激活来保护记忆受损[14]。人参皂苷Rh3通过调节5′-单磷酸腺苷激活的蛋白激酶信号通路在小胶质细胞中发挥抗炎作用[15]。它通过激活Nrf2 来保护视网膜色素上皮细胞和视网膜神经节细胞免受紫外线的伤害[16]。人参皂苷Rh3可以抑制紫外线照射角质形成的细胞中GMCSF 表达[17]。人参皂苷Rh3具有良好的抗肿瘤活性。在白血病中,人参皂苷Rh3使HL-60 细胞周期阻滞在G1/S 期,并诱导细胞分化为形态和功能性的粒细胞[18]。人参皂苷Rh3能够抑制人结肠癌细胞和卵巢癌细胞增殖并促进细胞凋亡[5,19]。
本研究结果发现,人参皂苷Rh3能够明显抑制PC3 细胞的增殖、迁移和侵袭。表明人参皂苷Rh3是一种潜在的抗PCa 细胞侵袭的药物。人参皂苷Rh3抑制N-cadherin 表达,促进了E-cadherin 表达,表明其可能抑制了上皮-间质转化(epithelial-mesenchymal transition,EMT)。EMT 在生命正常发育的各个阶段以及在肿瘤细胞发生的一系列表型和分子变化中非常常见[20]。对于许多肿瘤细胞的侵袭和转移而言,EMT 是关键的早期事件,而E-cadherin 的表达下调则是 EMT的标志之一[20-21]。E-cadherin 转录表达抑制受很多因素影响,包括锌指蛋白的Snail/Slug 家族、Twist、ZEB1、SIP1 等因子[22]。因此,人参皂苷Rh3抑制PC3 肿瘤细胞迁移和侵袭的上游调控分子机制是后期研究的方向。
综上,人参皂苷Rh3可能通过调节EMT 过程抑制PCa 细胞的转移和侵袭能力,临床治疗中,人参皂苷Rh3不论是单独使用或联合化疗药物使用均具有应用前景。但是,由于本研究限于PCa 细胞的体外结果,后期还需要进行深入的分子机制研究,为人参皂苷Rh3运用于PCa 临床治疗打下坚实的基础。
