羟基蒽醌衍生物标签的制备与肉类变质监测性能研究
2021-09-04王永乐陈光宇胡婧雯倪忠斌施冬健陈明清
王永乐,陈光宇,胡婧雯,倪忠斌,施冬健,陈明清
(江南大学 化学与材料工程学院,江苏 无锡 214122)
随着国民经济的快速发展,我国已成为肉类生产和消费大国[1]。肉类在储存和运输过程中如处置不当易造成腐败变质,流入市场会给消费者的身体健康带来极大的危险。微生物的活动使肉类发生降解,产生挥发性盐基氮(Total Volatile Base Nitrogen,TVB-N)[2-3],该指标的定量检测需要较为复杂的步骤[4]。为简化检测步骤,研究人员开发了一系列检测方法,如电化学传感[5-6]、荧光传感[7-8]以及比色传感[9-11]等,其中比色传感相较于前几种方法具有简便、直观等优势。
肉类变质过程中产生的TVB-N,会将周围环境转变为碱性环境[12],将pH响应分子掺入包装膜中或制成智能标签,理论上能够监测肉类变质。Aghaei等将茜素添加到醋酸纤维素的丙酮溶液中,通过静电纺丝成膜,在4℃环境下能够有效监测肉类变质[13]。何华鹏等选用溴甲酚紫和溴百里香酚蓝作为指示剂制成智能标签,能够监测青鱼的变质[14]。但目前的研究大多未提及指示剂的迁移量,该性能对于肉类包装材料的安全性至关重要。
羟基蒽醌衍生物在环境由中性到碱性转变时其颜色由黄色变为紫色,为pH比色响应标签监测肉类变质提供了理论基础[15]。作者探究蒽醌衍生物的不同取代基与羟基蒽醌对TVB-N类灵敏度的关系,将羟基蒽醌衍生物均匀涂覆在滤纸上,使其表面覆盖一层醋酸纤维素膜,降低了小分子的迁移,对肉类变质产生的TVB-N有较好响应性。
1 材料与方法
1.1 材料与试剂
无水AlCl3、苯三酸酐、丁二胺:购自阿拉丁试剂有限公司;4-甲基苯酐:购自麦克林试剂有限公司;1,4-二 羟 基 蒽 醌 (1,4-dihydroxy anthraquinone,DQ)、对苯二酚、氯化钠、丙酮等试剂:购自国药集团化学试剂有限公司;猪肉和青虾:市售产品。
1.2 仪器与设备
Nicolet iS50型傅立叶红外变换光谱仪:美国赛默飞世尔科技公司产品;UV1902-Ⅱ型UV-Vis分光光度计:上海奥析科学仪器有限公司产品;AVANCEⅢHD 400型核磁共振谱仪:瑞士布鲁克公司产品;SR-60型色差计:深圳市三恩时科技有限公司产品。
1.3 实验方法
1.3.1 不同取代基羟基蒽醌的合成分别使用苯三酸酐、4-甲基苯酐与对苯二酚通过Friedel-Crafts烷基化反应制备得到1,4-二羟基-6-羧基蒽醌(DCQ)和1,4-二羟基-6-甲基蒽醌(BMQ);反应条件为170℃油浴加热,反应时间6 h,反应结束后,在热盐酸溶液中抽滤除去未反应的苯三酸酐和4-甲基苯酐;再利用羟基蒽醌溶于碱性水溶液的特性进一步过滤提纯。
1.3.2 不同取代基羟基蒽醌的pH响应性分别配制0.1 mol/L磷酸缓冲溶液,其中pH缓冲范围6~9的为Na2HPO4、NaH2PO4二元缓冲体系,pH缓冲范围为10~12的为Na2HPO4、NaOH二元缓冲体系,记录下3种羟基蒽醌衍生物在不同pH缓冲溶液中的颜色,使用UV-Vis分光光度计表征可见光区吸收光谱的变化,并计算3种羟基蒽醌衍生物在pH为6和12时的最大吸收峰位移。
1.3.3 pH响应标签的制备取20 mg的DQ、DCQ和DMQ,溶于20 mL丙酮溶液中,将定性滤纸裁剪成4 cm×2 cm的滤纸片,用镊子将滤纸片放入上述溶液中10 s,充分浸润后取出晾干,再分别配制质量分数为2%、4%、6%的醋酸纤维素(Cellulose acetate,CA)的丙酮溶液,将晾干后的标签用镊子放入CA的丙酮溶液中,5 s后取出晾干,制备得到表面CA包覆的pH比色响应标签。

图1 羟基蒽醌衍生物和pH比色响应标签的制备示意图Fig.1 Schematic diagram of preparation of hydroxyanthraquinone derivatives and pH colorimetric responsive labels
1.3.4 不同响应分子制成的标签对丁二胺响应灵敏度的测试分别准备装有质量浓度为0.1、0.3、0.5、1.0、1.5、2.0、2.5、3.0 mg/L丁二胺的密闭烧杯,使用上述3种带有响应分子的滤纸置于烧杯10 min后,用色差计测定负载有羟基蒽醌滤纸响应前后的颜色数据,并按照公式(1)计算色差值ΔE:
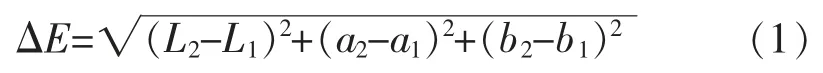
式中:L表示待测物体的明亮度,理论值为0~100,值越大表示物体越白;a表示物体的红绿度,正值为红,负值为绿;b表示物体的黄蓝度,正值为黄,负值为蓝;均由色差计直接读取,色差计使用D65光源。L2,a2,b2是响应后的数据,L1,a1,b1是响应前的数据。
1.3.5 不同质量分数醋酸纤维素包覆下标签的响应分子迁移量取未包覆大分子和质量分数分别为2%,4%,6%的CA/丙酮溶液中包覆的pH响应标签烘干后,置于30 mL去离子水中12 h,之后加入0.12 g的NaOH,测定溶液于563 nm处的吸光度,根据吸光度和1,4-二羟基-6-羧基蒽醌的浓度和吸光度标准曲线计算1,4-二羟基-6-羧基蒽醌的迁移量。
1.3.6 不同肉类在室温下TVB-N质量分数测量从超市购买当天屠宰的猪肉和解冻青虾,其中青虾去壳去头处理;根据GB/T—5009.228—2016《食品安全国家标准食品中挥发性盐基氮的测定》中的微量扩散法测定猪肉和虾肉在室温下放置不同时间后的TVB-N质量分数[16]。
1.3.7 不同肉类腐败的检测将在不同质量分数的CA溶液中浸润过的pH响应标签分别置于装有20 g猪肉表面皿中,使用保鲜膜密封,放置在室温(25℃)下,每隔12 h记录pH响应标签的色差变化和数码照片。
2 结果与分析
2.1 3种羟基蒽醌分子的结构分析
对3种响应分子进行FT-IR分析,结果如图2(a)所 示。DCQ相 较 于DQ,DMQ在1 693 cm-1附近多了一个羰基的特征峰,此为羧基上的羰基,DMQ相较于DQ,DCQ在1 338 cm-1和1 236 cm-1附近多了甲基的特征吸收峰。在1 630 cm-1附近处为羰基的特征吸收峰。如图2(b)所示,3种响应分子的1H-NMR谱图,其酚羟基特征峰均出现在化学位移为12.0~12.5附近,这是由于α位的酚羟基(与羰基相近的酚羟基为α位酚羟基,远离羰基的羟基为β位酚羟基)与羰基形成了分子内氢键,导致化学位移向低场移动;DCQ分子上羧基的强吸电子效应也导致苯环上的氢原子化学位移整体向低场移动。由于DMQ分子的甲基特征峰位置与DMSO的溶剂峰位置重叠,换用氘代氯仿作为溶剂,在化学位移为2.5附近出现了甲基的特征峰。3种物质的1H-NMR谱图结果与预测相符合。综上所述,DCQ和DMQ成功合成。
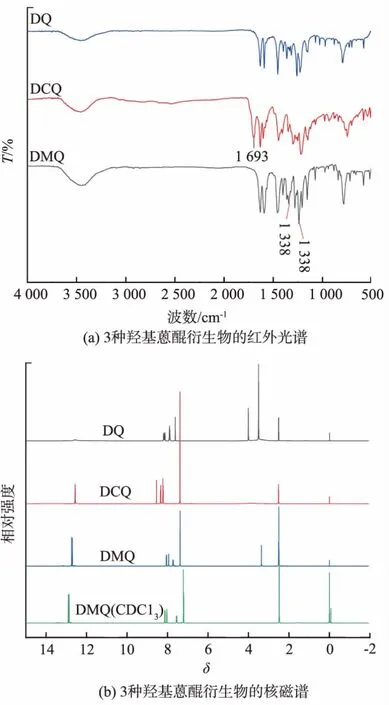
图2 3种羟基蒽醌衍生物的红外光谱、核磁谱Fig.2 FT-IR spectra and NMR spectra of three hydroxyanthraquinone derivatives
2.2 3种羟基蒽醌分子的pH响应性能
羟基蒽醌遇碱变色的机理如图3(a)所示,酚羟基遇氢氧根脱去质子,发生电子转移使羟基蒽醌结构发生变化,颜色加深,其中质子离去难易程度决定了羟基蒽醌的变色域,羧基是吸电子基团,能够降低苯环上电子云密度,使得质子更易离去,甲基是给电子基团,能够提高苯环上电子云密度,使质子更难离去[17]。3种pH响应分子均为羟基蒽醌的衍生物,因此均具有pH响应性,在碱性环境中会变为紫色,但是由于取代基的不同,其变色域会产生细微的差异。为了探究蒽醌骨架6号碳上取代基的诱导效应对pH变色域的影响,将DQ,DCQ,DMQ分别溶于不同pH缓冲溶液之后,记录三者颜色变化差异。如图3(b)所示,DQ的pH变色域为pH 9~11,DCQ的pH变色域为pH 8~10,DMQ的pH变色域为pH 10~12。上述结果表明,蒽醌骨架6号位碳上取代基的诱导会对pH变色域产生影响,吸电子基团导致pH变色域降低,给电子基团导致pH变色域升高。
为进一步探究取代基与羟基蒽醌对pH的颜色响应关系,使用UV-Vis分光光度计对3种响应分子在不同pH缓冲溶液中的吸收光谱进行表征,记录可见光区的吸光度与波长关系,结果如图4所示。3种响应分子的最大吸收峰均随着pH增高而逐渐红移,颜色也逐渐从黄色变为紫色。3种响应分子的Δλ分别记为Δλ1,Δλ2,Δλ3,其中Δλ1=81 nm,Δλ2=97 nm,Δλ3=84 nm,其中DCQ的Δλ是最大的。综上所述,DCQ对于pH响应变化较早,对于碱性环境的变化更为敏感。

图3 羟基蒽醌衍生物的变色机理和pH响应性能Fig.3 Color change mechanism and pH responsive performance of hydroxyanthraquinone derivatives
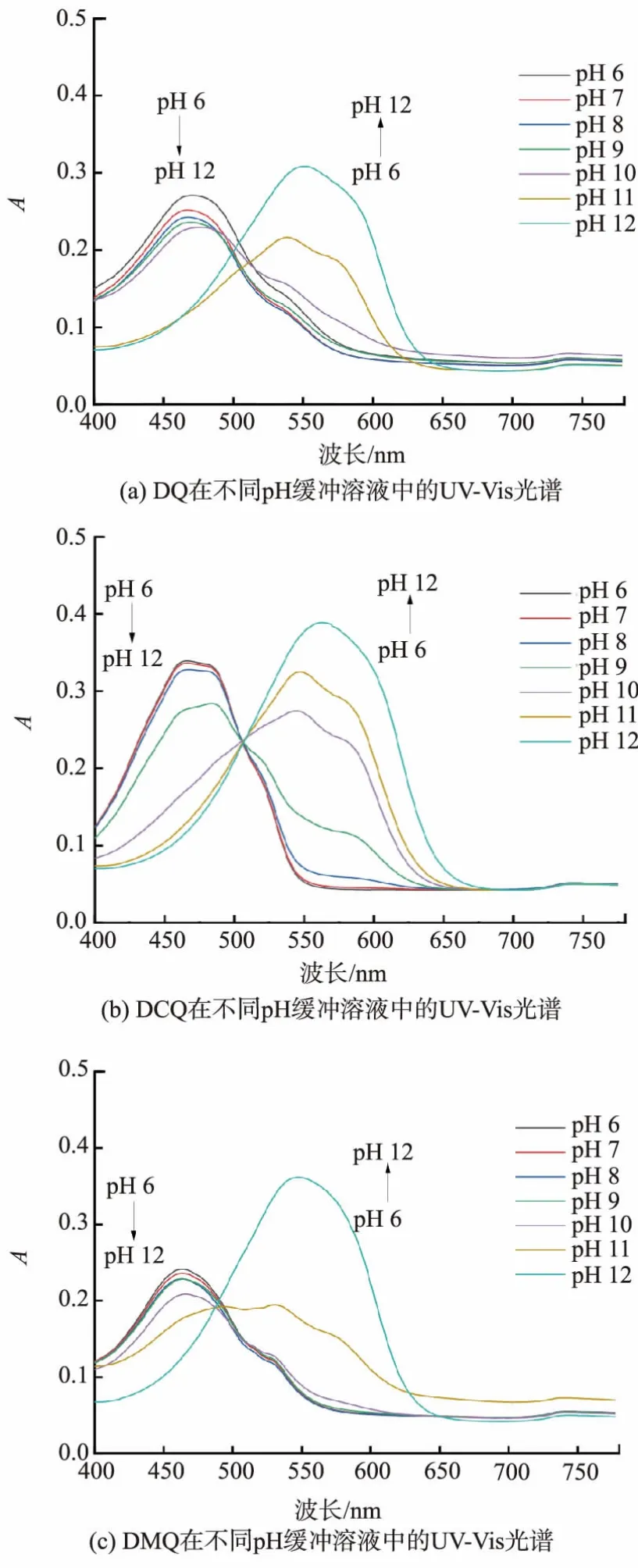
图4 羟基蒽醌衍生物在不同pH的缓冲溶液中的UV-Vis光谱Fig.4 UV-Vis spectra of three hydroxyanthraquinone derivatives in different pH buffer solutions
2.3 pH响应标签性能分析
2.3.1 不同羟基蒽醌衍生物对丁二胺响应灵敏度为进一步探究不同取代基与羟基蒽醌对丁二胺响应的关系,制备未包覆醋酸纤维素的pH响应标签,用色差计记录不同质量浓度的丁二胺响应前后的色差值ΔE。结果如图5所示,可以看到随着丁二胺质量浓度的升高,3种响应分子制备的pH响应标签色差均出现了变化,但是色差变化趋势与pH变化趋势类似,DCQ色差最大,DQ次之,DMQ最低;表明蒽醌骨架上取代基的诱导效应会影响羟基蒽醌对丁二胺响应变色灵敏度,吸电子基团会使灵敏度提高,给电子基团使灵敏度降低。
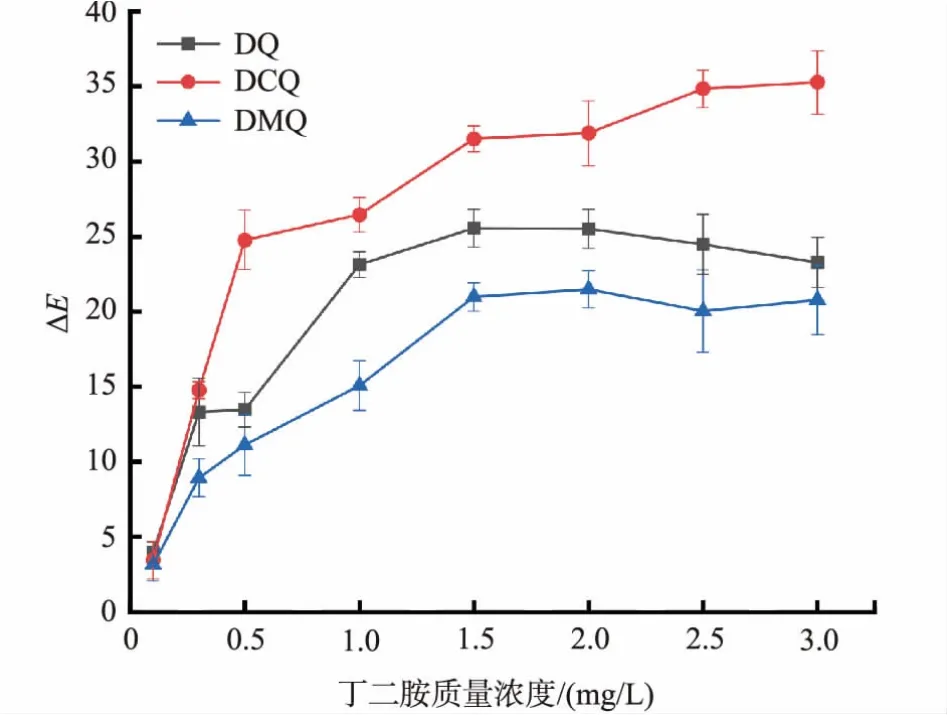
图5 羟基蒽醌衍生物制成的pH响应标签响应前后色差值与丁二胺质量浓度的关系Fig.5 Color difference of pH-responsive labels made by hydroxyanthraquinone derivatives before and after response in different concentration of butanediamine
2.3.2 不同醋酸纤维素包覆量的pH响应标签在水溶液中的响应分子迁移量0.1 mol/L的NaOH溶液中1,4-二羟基-6-羧基蒽醌在563 nm处的吸光度值和浓度的标准曲线计算公式为:
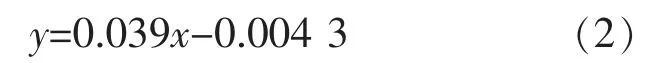
式中y为吸光度值,x为1,4-二羟基-6-羧基蒽醌在NaOH溶液中的质量浓度,单位是mg/L,据此计算单个标签在水溶液中的迁移量。
为了降低响应分子的迁移量,分别采用CA对制备的pH响应标签进行包覆,并测量其在水溶液中的迁移量,结果表1所示,可以看到随着醋酸纤维素的增加,迁移量逐渐下降;对于采用质量分数6% CA包覆的pH响应标签,和未包覆的对照组相比,其迁移量下降了40.6%,故此方法能一定程度上防止1,4-二羟基-6-羧基蒽醌迁移到标签外。

表1 包覆CA后标签中羟基蒽醌衍生物的迁移量Table 1 Mobility of hydroxyanthraquinone derivatives in labels coated with CA
2.3.3 不同醋酸纤维素包覆量的pH响应标签在不同丁二胺浓度下颜色变化使用不同质量分数的醋酸溶液浸润pH比色响应标签,会使包覆在标签上的CA的量产生影响,一般来说,CA质量分数越高,包覆在标签上的CA的量也越多。对包覆了CA的pH比色响应标签进行不同质量浓度的丁二胺响应测试,结果如图6所示。随着CA包覆量的提升,响应灵敏度和最大色差值均出现了一定程度的降低,可能是由于包覆的CA在一定程度上隔绝了气体进入标签内部,从而减少响应分子和丁二胺的接触。

图6 包覆CA的pH响应标签色差与丁二胺质量浓度的关系Fig.6 Relationship between the color difference of pH responsive labels coated with CA and the concentration of butanediamine
2.4 不同肉类在室温下的新鲜度检测
根据GB 2707—2016和GB 2733—2015中对畜禽肉和水产品中TVB-N质量分数要求(猪肉中TVB-N低于15 mg/hg,虾肉中TVB-N低于20 mg/hg为新鲜)[18-19]。使用半微量扩散法对肉类中的TVB-N进行检测,结果如图7所示。在25℃条件下,TVB-N质量分数随时间增加逐渐增加。将浸泡在不同浓度的CA溶液中的pH响应标签晾干后置于盛有不同肉类的表面皿内,每隔12 h记录下pH响应标签的色差和数码照片,数码照片如图8所示。不同质量分数的CA/丙酮溶液会导致滤纸表面覆盖不同量的CA,其中在质量分数为6%的CA/丙酮溶液中,标签产生了发白的现象,这是由于标签表面粗糙和CA含量过多使透明性下降。结果导致其在猪肉发生变质时,标签的颜色变化较未覆盖CA的对照组更明显。在虾肉的监测中,标签直到36 h左右才发生了肉眼可辨的变化,而此时虾肉中TVB-N含量已超过国家标准,因此该标签不适用于虾肉的监测,其原因可能是由于淡水鱼虾肌蛋白含量较猪肉更高,在腐败初期降解产生大量乳酸和磷酸,pH会出现先降低后上升的情况[20],干扰了标签对于碱性的TVB-N的响应,导致不能及时变色。而猪肉中肌蛋白含量少于淡水鱼虾,因此pH呈现稳定上升趋势[21],故该标签适用于猪肉的变质监测。
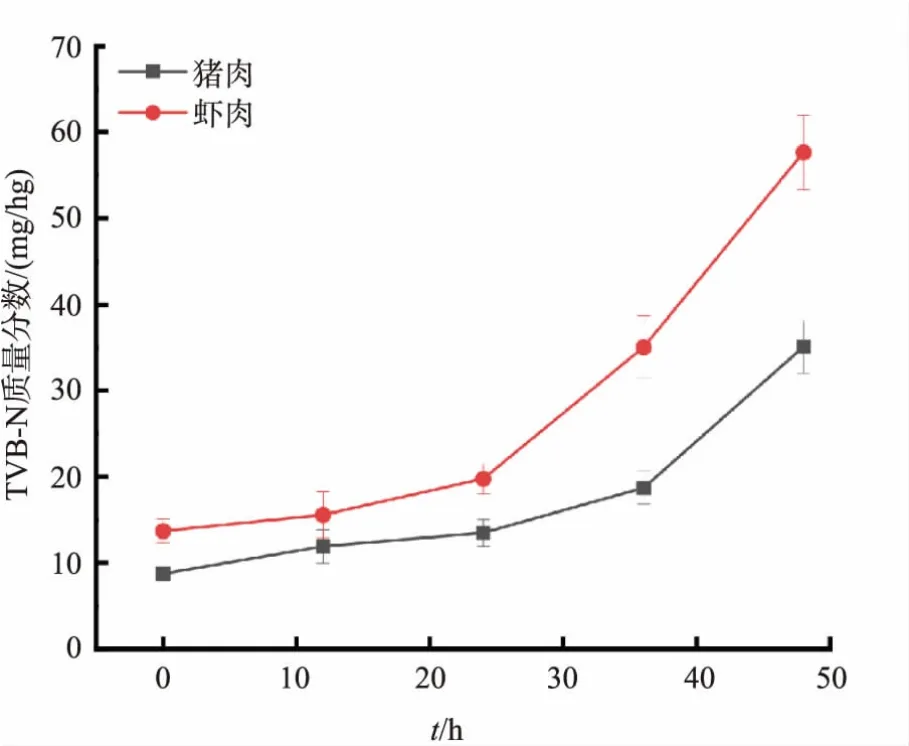
图7 25℃下猪肉和虾肉中TVB-N质量分数随时间变化Fig.7 Variation of TVB-N content in pork and shrimp meat with time at 25℃

图8 25℃下浸润不同质量分数CA溶液的标签在装有猪肉的表面皿中随时间变化的照片Fig.8 Observation of the labels immersed in the CA solution under different concentrations at 25℃ inpetri dish with pork
3 结语
作者基于羟基蒽醌衍生物的pH响应性,合成羟基蒽醌衍生物,并且通过对比数种羟基蒽醌衍生物的pH响应性能,发现羧基的引入能使羟基蒽醌对于碱性环境更敏感,而甲基的引入会降低敏感性,这可能与取代基的诱导效应有关,羟基蒽醌这一特性可为以后该领域的研究提供参考。将1,4-二羟基-6-羧基蒽醌与滤纸相结合,制备得到pH比色响应标签,并进一步使用CA包覆在其表面,以提高pH比色响应标签的安全性。实验结果表明:该标签颜色会随着肉类的腐败变质呈现出不同的变化,标签的颜色可快捷反映肉类的品质,判断肉类是否可食用。
