高产乙酸乙酯酵母菌的筛选及其在清香型小曲白酒生产中的应用
2021-09-03陈佳兴刘源才程学勋陈申习
许 银,杨 强,张 龙,陈佳兴,刘源才,陈 凯,程学勋,陈申习*
(1.劲牌有限公司 劲牌研究院 中药保健食品质量与安全湖北省重点实验室,湖北 黄石 435000;2.宜宾六尺巷酒业有限公司,四川 宜宾 644000)
酯类物质作为一种具有芳香性气味的易挥发性化合物,大多具有水果香味,广泛存在于各类香型白酒中,对于协调白酒的香气和提升口感具有重要的作用[1-3]。在众多酯类物质中,以乙酸乙酯研究较多,特别是在清香型白酒研究领域[4-7]。现有研究表明,乙酸乙酯是清香型白酒的主体呈香物质,对清香型白酒风格的形成具有重要作用,决定着清香型白酒的质量分级[8-9]。
清香型白酒中乙酸乙酯的产生,是生香酵母以及酶催化作用形成的[10-11]。产酯能力较强的酵母包括毕赤酵母属(Pichia)、汉逊酵母属(Hansenula)、假丝酵母属(Candida)等[12-14]。目前,作为清香型白酒的重要分支,清香型小曲白酒中乙酸乙酯含量相对较低。原因在于白酒发酵过程中氧气的快速消耗,与产酯有关的大多数酵母代谢能力大幅减弱。同时,由于环境因子的胁迫,产酯酵母数量急剧下降,从而导致小曲白酒中乙酸乙酯含量不足。近年来,许多白酒企业尝试延长发酵周期或者在蒸馏时添加乙酸乙酯,来提高成品酒中乙酸乙酯含量,这虽取得了一定效果,但在实际运用中受到很多限制。白酒发酵中的微生物可产生乙酸乙酯,所以要从根本上提升乙酸乙酯含量,还需从菌株自身发酵性能方面开展工作[15-18]。
本研究从浓香型大曲中分离纯化酵母菌,结合形态学观察和分子生物学鉴定,经过高粱汁发酵初筛、固态发酵复筛,以获得高产乙酸乙酯的酵母菌,并将其应用于清香型小曲白酒工业生产。这对于提升发酵后原酒中乙酸乙酯含量,提高清香型小曲白酒的口感和品质,满足消费者对高品质白酒的需求具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
浓香型大曲:四川宜宾六尺巷酒业有限公司;东北粳高粱:黑龙江大庆;麸皮:河南飞天农业开发股份有限公司。
1.1.2 化学试剂
β-淀粉酶(酶活50 000 U/g)、糖化酶(酶活100 000 U/g):无锡雪梅酶制剂科技有限公司;真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:上海生工生物技术服务公司;DNA凝胶回收试剂盒:美国AXYGEN公司;乙醛、甲醇、正丙醇、乙酸乙酯等标准品(均为色谱纯):中国医药集团有限公司;硫酸(分析纯):中国医药集团有限公司。Q5高保真DNA聚合酶:美国NEB公司;聚合酶链式反应(polymerasechainreaction,PCR)缓冲液、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)混合液、引物ITS1和ITS4:宝日医生物技术(北京)有限公司。
1.1.3 培养基
华伦斯坦实验室(Wallestein laboratory,WL)营养琼脂培养基[19]:葡萄糖50 g/L,酵母浸粉4 g/L,蛋白胨5 g/L,硫酸镁0.125 g/L,磷酸二氢钾0.55 g/L,氯化钾0.425 g/L,氯化钙0.125g/L,硫酸锰0.002 5 g/L,氯化铁0.002 5 g/L,溴甲酚绿0.022g/L(灭菌后添加),琼脂20 g/L,青霉素0.1 g/L,调节pH为6.5,121 ℃灭菌20 min。酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基[19]:酵母提取物10 g/L,葡萄糖20 g/L,蛋白胨20 g/L,青霉素0.1 g/L。固体培养基添加琼脂粉20 g/L。121 ℃灭菌30 min。
高粱汁培养基[19]:高粱200 g经粉碎后,加蒸馏水800 mL,然后添加β-淀粉酶10 g和糖化酶10 g,置于60 ℃恒温箱中糖化24 h,经过滤得滤液,滤液糖度调整为10°Bx。
高粱固体培养基:取1 kg粳高粱放置不锈钢容器中,添加温度为60 ℃的蒸馏水没过高粱表面,培养箱控制温度为60 ℃,浸泡18 h,然后沥干泡粮水,用抹布包裹高粱进行初蒸(121 ℃、30 min)、焖粮(80 ℃、40 min)、复蒸(115 ℃、15 min),即为高粱固体培养基。
麸皮培养基:取一定质量麸皮,添加蒸馏水,使得含水量在45%~50%之间,于121 ℃灭菌45 min。
1.2 仪器与设备
AL204电子分析天平:梅特勒-托利多仪器(上海)有限公司;JJ1000电子天平:常熟双杰测试仪器厂;SFG-02B电热恒温鼓风干燥箱:上海精宏实验设备仪器厂;QYC-200全温空气摇床:上海福玛实验设备有限公司;YXQ-LS-75S蒸汽灭菌锅、SPX-100B-Z生化培养箱:上海博讯实业有限公司;5424R艾本德小型离心机:艾本德(中国)仪器有限公司;YPZQ-45圆盘制曲机:烟台良荣机械精业有限公司;BCM-1600A洁净工作台:苏州安泰空气技术有限公司;Nikon ECLIPSE E200显微镜:日本Nikon公司;Agilent 7890A型气相色谱(gas chromatography,GC)仪(配有氢火焰检测器和7863型自动进样器):美国安捷伦公司;2720型PCR仪:美国ABI公司;DYY-6C型电泳仪:北京六一仪器厂;BG-gdsAUTO(130)凝胶成像系统:北京百晶生物科技有限公司。
1.3 试验方法
1.3.1 酵母菌的分离纯化[20]
将浓香型大曲样品用粉碎机粉碎后,制成粉状备用。称取曲粉5 g,放入盛有95 mL无菌水并带有玻璃珠的250 mL三角瓶中,30 ℃、200 r/min条件下振荡培养30 min,制成菌悬液。按10倍梯度系列将菌悬液稀释至10-4,取稀释度为10-1、10-2、10-3和10-4的曲粉溶液0.2 mL分别涂布于WL营养琼脂培养基中,于30 ℃条件下培养24~48 h后,挑取单菌落划线于YPD培养基上,30 ℃条件下培养48 h。经过2~3次平板划线后得到初步纯化的菌落,4 ℃保存,备用。
1.3.2 酵母菌的鉴定
(1)形态观察
参考《真菌鉴定手册》对菌落的颜色、透明度、大小等特征及细胞形态进行描述分类[21]。
(2)分子生物学鉴定
采用DNA提取试剂盒提取酵母菌的基因组DNA,以其为模板,采用真菌通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')对其ITS区基因序列进行PCR扩增。PCR扩增体系(25 μL):PCR缓冲液10 μL,dNTP混合液(2.5 mmol/L)2 μL,引物ITS1(10 μmol/L)1 μL,引物ITS4(10 μmol/L)1 μL,真菌DNA模板2 μL,超纯水8.75 μL,Q5 DNA聚合酶0.25 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,52 ℃退火40 s,72 ℃延伸60 s,共35个循环;72 ℃再延伸10 min。PCR扩增产物经2%琼脂糖凝胶电泳检测,纯化后送华大基因(武汉)测序公司测序。将测序结果提交至美国国家标准技术研究所(national institute of standards and technology,NIST)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索,选取同源性较高的模式菌株的ITS基因序列,采用MEGA 6.0中的邻接(neighbor-joing,NJ)法构建系统发育树。
1.3.3 酵母菌的液态发酵实验
把分离纯化后的单菌落接种于含有10 mL YPD液态培养基的无菌试管中,30 ℃、150 r/min条件下振荡培养48 h,吸取0.4 mL菌液接种于含有50 mL高粱汁培养基的250 mL三角瓶发酵栓中,以不接种任何菌液的高粱汁培养基为空白对照,以市售常用产酯酵母Y0为阳性对照。样品于30 ℃生化培养箱恒温培养,每隔24 h小心振荡发酵栓并称质量,当质量损失<0.2 g时,停止培养。将培养后的发酵液离心(20 ℃,8 000 r/min)、过滤后,取发酵液,采用气相色谱检测乙酸乙酯及杂醇(异丁醇、异戊醇)含量[22]。
1.3.4 酵母菌麸皮种的制作
酵母菌麸皮种的制作:将筛选得到的酵母菌接种于含有5 mL YPD培养基的试管中,30 ℃、150 r/min振荡培养24 h,然后接入无菌的200 mL YPD液态培养基中,30 ℃、150 r/min培养24 h后作为种子液。按照每g麸皮培养基接种0.5 mL种子液(酵母数量为1×107CFU/mL)进行接种,30 ℃培养36 h,将麸皮培养物35 ℃条件下干燥6~8 h,即得酵母菌麸皮种。
酵母麸皮种的扩大培养:采用圆盘制曲机生产。按照上述比例将酵母种子液接种于麸皮培养基,启动温控系统自动控制圆盘温度在30~32 ℃之间,培养32 h后,出盘干燥,然后粉碎,检测细胞数>10×108CFU/g为合格。
1.3.5 酵母菌的固态发酵实验
将酵母菌麸皮种,按照质量分数5%添加到劲牌小曲中,以添加市售酵母Y0的劲牌小曲为阳性对照,不添加菌株的劲牌小曲样品为空白对照,在无菌实验室模拟清香型小曲白酒生产工艺条件[23-24],具体操作工艺流程:泡粮(60 ℃,20 h)、初蒸(121 ℃,30 min)、焖粮(60 ℃,1 h)、复蒸(115 ℃,15 min)、撒曲(1%)、糖化(24 h)、发酵(7 d)。蒸粮结束后,熟粮完全透心,一致性好,水分含量在55%左右;称取糖化醅500 g与配糟(配糟采用车间大生产蒸馏后的鲜糟)按质量比1∶1混匀后入瓶,瓶塞上装2.5 mol/L硫酸密封,在培养箱中30 ℃发酵7 d。发酵结束后,采用固态蒸馏,取100 mL蒸馏液,采用气相色谱检测乙酸乙酯含量[22]。
1.3.6 酵母菌强化酒曲在清香型小曲白酒生产中的应用
采用圆盘制曲机生产出酵母菌麸皮种与车间酒曲进行配比优化,酵母麸皮种按质量比为3∶100添加到酒曲中,制备成车间实验用曲,以不加菌酒曲为空白对照,按清香型小曲白酒车间生产工艺进行中试生产。清香型小曲白酒车间生产工艺:泡粮(75 ℃,17 h)、初蒸(0.12 MPa,30 min)、焖粮(60 ℃,1 h)、复蒸(0.04 MPa,15 min)、加曲(1%)、糖化(22 h)、发酵(14 d)。中试生产每次投粮1 000 kg,发酵结束后经固态蒸馏即得小曲原酒,取100 mL原酒,采用气相色谱检测挥发性风味物质[22],并进行感官评价。
1.3.7 出酒率的计算
在20 ℃条件下,求得已折算为乙醇体积占比55%的原酒质量,即为原酒产量,计算出单位投粮量的原酒产量即为出酒率[25-26]。
1.3.8 清香型小曲白酒的感官评价
邀请劲牌公司5位国家级白酒评委,参照国家标准GB/T 33404—2016《白酒感官品评导则》对白酒进行感官评价[27],满分为100分。
1.3.9 数据处理
每个实验重复三次,结果用“平均值±标准差”表示。采用SPSS 19.0分析软件对数据进行标准差及显著性分析,P<0.05说明差异显著[18]。
2 结果与分析
2.1 酵母菌的分离及形态特征
从浓香型大曲中分离纯化得到2株菌落形态不同的菌株,分别编号为Y87和Y88。其菌落及细胞形态见图1。

图1 菌株Y87(a)与菌株Y88(b)的菌落及细胞形态Fig.1 Colony and cell morphology of strains Y87 (a) and Y88 (b)
由图1可知,菌株Y87的菌落较大,呈白色,表面光滑,无光泽;细胞呈圆形。菌株Y88的菌落较大,呈白色,表面光滑凸起,有光泽;细胞呈圆形或椭圆形。根据《真菌鉴定手册》[21],初步鉴定这两株菌为酵母菌。
2.2 酵母菌的分子生物学鉴定
基于ITS rDNA基因序列构建菌株Y87及Y88的系统发育树,结果见图2。
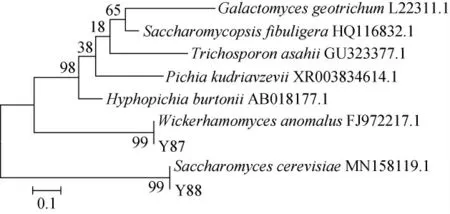
图2 基于ITS rDNA基因序列菌株Y87与Y88的系统发育树Fig.2 Phylogenetic tree of strains Y87 and Y88 based on ITS rDNA gene sequences
由图2可知,菌株Y87与异常威克汉姆酵母(Wickerhamomyces anomalus)聚于同一分支,亲缘关系最近;菌株Y88与酿酒酵母(Saccharomyces cerevisiae)聚于同一分支,亲缘关系最近。结合形态学观察,将菌株Y87鉴定为异常威克汉姆酵母(Wickerhamomyces anomalus),菌株Y88鉴定为酿酒酵母(Saccharomyces cerevisiae)。
2.3 酵母菌的液态发酵实验结果
酵母菌在高粱汁培养基中的发酵性能测定结果见表1。
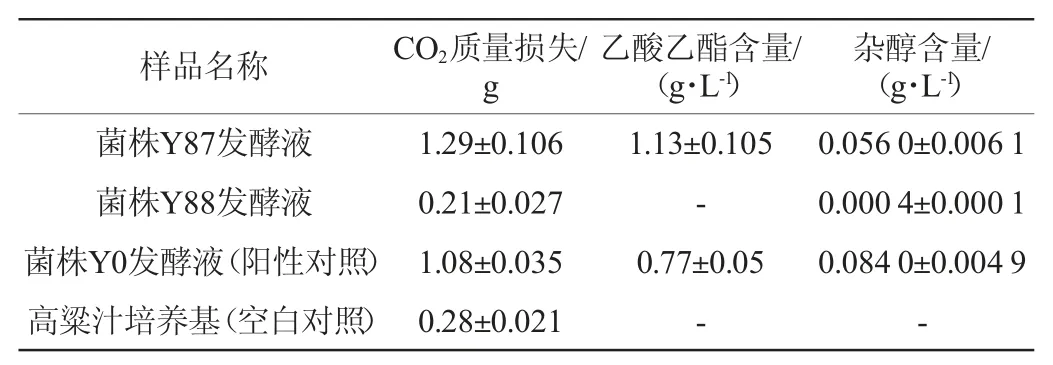
表1 酵母菌在高粱汁培养基中的发酵性能测定结果Table1 Determination results of fermentation performance of yeasts in sorghum juice medium
由表1可知,酵母菌Y87发酵高粱汁后,CO2质量损失最高,为1.29 g,说明该酵母菌具有一定的产酒能力。从主要挥发性物质乙酸乙酯和杂醇产量来看,酵母菌Y87表现出了较好的产酯能力,乙酸乙酯产量(1.13 g/L)显著高于市售酵母Y0(0.77 g/L)(P<0.05)且菌株Y87产杂醇量较低(0.056 0 g/L),这对提升原酒品质,协调原酒口感具有促进作用。而菌株Y88产酒和产酯能力较弱。因此,选择菌株Y87进行固态发酵试验。
2.4 酵母菌Y87固态发酵实验结果
将酵母菌Y87添加到酒曲后固态发酵得到的基酒中乙酸乙酯含量见表2。

表2 酵母菌固态发酵得到的基酒中乙酸乙酯含量测定结果Table2 Determination results of ethyl acetate contents in base liquor by yeast solid-state fermentation
由表2可知,菌株Y87固态麸皮种强化到小曲发酵7 d后,菌株Y87酒曲发酵得到的基酒中乙酸乙酯含量达到1.14 g/L,相比空白对照和阳性对照,含量分别提高79.4%和22.8%,表明应用菌株Y87可以显著提高乙酸乙酯的生成量(P<0.05),可改善原酒的风味。
2.5 菌株Y87强化酒曲在清香型小曲白酒生产中的应用
2.5.1 菌株Y87强化酒曲酿造白酒的挥发性风味物质
菌株Y87强化酒曲酿造白酒中挥发性风味物质测定结果见表3。由表3可知,相比空白对照,菌株Y87强化酒曲酿造白酒出酒率(61.4%)提高了1.2%,乙酸乙酯含量(1.38 g/L)提高36.6%,杂醇含量降低7.1%,正丙醇含量降低16.1%,可显著提升白酒品质(P<0.05)。
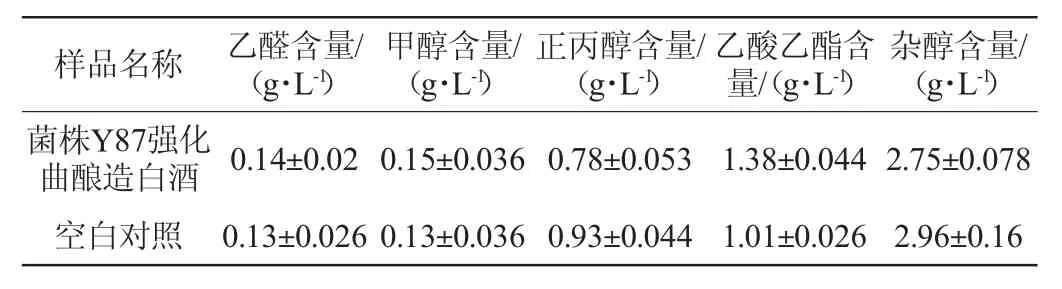
表3 菌株Y87强化酒曲酿造白酒挥发性风味物质测定结果Table3 Determination results of volatile flavor substances in Baijiu brewed by strain Y87 fortified Jiuqu
2.5.2 菌株Y87强化酒曲酿造白酒的感官评价
菌株Y87强化酒曲酿造白酒的感官评分为90.7分,高于空白对照白酒(89.9分),酒品具有清香型小曲白酒的入口醇甜、清香纯正、尾较净等特点,说明通过强化高产乙酸乙酯酵母于酒曲,并应用在清香型小曲白酒生产中,可以提升小曲白酒中风味物质含量。
3 结论
采用WL营养琼脂培养基从浓香型大曲中分离纯化得到2株酵母菌,编号为Y87、Y88,经形态观察及分子生物学技术鉴定其分别为异常威克汉姆酵母(Wickerhamomyces anomalus)和酿酒酵母(Saccharomyces cerevisiae)。经过液态高粱汁培养基、高粱固态发酵培养基发酵筛选得到菌株Y87为高产乙酸乙酯的酵母菌,高粱汁发酵乙酸乙酯产量达到1.13 g/L,高粱固态发酵乙酸乙酯产量达到1.14 g/L。将菌株Y87强化酒曲应用于清香型小曲白酒的酿造,白酒中乙酸乙酯含量提高36.6%,杂醇含量降低7.1%,正丙醇含量降低16.1%,感官评分为90.7分,具有小曲酒的典型特征,入口醇甜,清香纯正。本研究有效地提升了劲牌公司原酒中呈香味物质乙酸乙酯含量,改善了原酒品质,可为发掘纯天然菌株资源提供参考依据。
