Cyclin D1、PSTAT3和OPN蛋白在胰腺导管腺癌中的表达及临床意义
2021-09-03刘燕张曼李成龙
刘燕 张曼 李成龙
胰腺导管腺癌(pancreatic ductal adenocacinoma,PDAC)是一种主要来源于胰腺导管上皮的恶性肿瘤,恶性程度极高[1]。信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)是信号转导和转录激活因子(signal transducer and activator of transcription,STAT)家族的重要成员,其在Tyr705 位点被激活后可形 成PSTAT3(phosphorylated STAT3)[2]。研 究发现,活化的STAT3 能促使细胞发生恶性转化,在裸鼠中形成肿瘤,因而STAT3被认为是一种癌基因[3]。细胞周期蛋白D1(CyclinD1)是STAT3信号转导途径下游的一个靶基因,其异常表达可对细胞周期循环产生影响。骨桥蛋白(osteopontin,OPN)作为一种转移相关蛋白,在肿瘤发生及转移中发挥重要作用。本研究检测Cyclin D1、PSTAT3 和OPN 蛋白在PDAC患者中的表达情况,探讨其在PDAC 中的临床意义,现报道如下。
1 资料与方法
1.1 一般资料
选取2015年3月至2017年3月本院收治的75例PDAC 患者作为研究对象(PDAC 组)。其中男45 例,女30 例,平均年龄(49.19±2.14)岁,临床分期:Ⅰ期23 例,Ⅱ期20 例,Ⅲ期19 例,Ⅳ期13 例。组织病理学分级:高分化腺癌(Gl 级)23 例,中分化腺癌(G2 级)30 例,低分化腺癌(G3 级)22 例。纳入标准:①所有患者有明确的病理学诊断依据,均确诊为PDAC[4];②入组前未接受放疗及化疗;③肿瘤直径≤5 cm;④临床资料完整无缺失;排除标准:①合并血液疾病者;②严重精神疾患或痴呆等无法配合本研究者;③存在除胰腺癌以外其他原发性恶性肿瘤者;④合并风湿免疫及结缔组织病变者。另外取30 例来自切取供肝时附带的正常胰腺组织及相应临床资料作为对照组,男19 例,女11 例;平均年龄(48.26±2.01)岁;两组性别、年龄等一般资料比较差异无统计学意义(P>0.05)。本研究经医院医学伦理委员会批准通过,受试者或家属均签署知情同意书。
1.2 研究方法
收集所有患者临床资料,比较Cyclin D1、PSTAT3 和OPN 蛋白在PDAC 组织及正常胰腺组织中的表达;分析Cyclin D1、PSTAT3 和OPN 蛋白在PDAC 患者各病理参数的相关性,记录所有患者在随访时间内存活及死亡情况。
1.3 检测方法
1.3.1 主要试剂
兔抗人多克隆抗体phospho-STAT3(Tyr705)为美国Upstate 公司产品,鼠抗人单抗Cyclin D1(DCS-6)购自丹麦的DAKO 公司,鼠抗人单抗OPN 为美国Santa Cruz 公司产品。操作严格按照试剂盒说明书进行。
1.3.2 结果判定[5]
判断Cyclin D1、PSTAT3 和OPN 蛋白阳性范围的标准:每张切片在镜下分别以低倍镜及高倍镜进行观察,对每张切片上中下及里外中9 个位置观察,根据Wachters 等的标准分析免疫组化。PSTAT3 阳性染色定位于细胞核上,Cyclin D1、OPN 阳性染色定位于胞浆和胞膜上。采用Volm双评分法进行判定,在染色均匀的肿瘤区,选取5个高倍镜视野(×400):按阳性细胞百分率(A 值)评分:<25%为1 分,25%~50%为2 分,>50%为3分;按染色强度(B 值)评分:不着色为0 分,浅棕黄色为1 分,棕黄色为2 分,棕褐色为3 分。综合染色阳性细胞数与染色强度判断结果:阴性(-):0 分,弱阳性(+):1~2 分,中度阳性(++):3~4 分,强阳性(+++):5~6 分;两种计分的乘积为每例的加权分数,加权分数为0 为阴性,其余均为阳性。
1.4 随访方法
随访从患者术后开始,直至患者死亡或本研究的随访结束,为期3年,截止于2020年3月31日。患者的随访时间分布在10 至36 个月,平均随访时间为(29.67±3.11)个月。对患者随访的方式主要采用患者来院复查为主。总生存时间(Overall Survival,OS)表示患者从手术至死亡的时长。
1.5 统计学方法
采用SPSS 18.0 软件进行统计分析,计数资料以n(%)表示,采用χ2检验;计量资料采用()表示;采用多元Logistic 回归分析影响PDAC 患者预后生存的危险因素,绘制Kaplan-Meier 生存曲线研究Cyclin D1、PSTAT3 和OPN 蛋白对患者预后生存的影响;以P<0.05 为差异有统计学意义。
2 结果
2.1 Cyclin D1、PSTAT3 和OPN 蛋白在PDAC 组织及正常胰腺组织中的表达
PDAC 组Cyclin D1、PSTAT3 和OPN蛋白阳性率高于对照组,差异均有统计学意义(P<0.05)。见表1、图1。
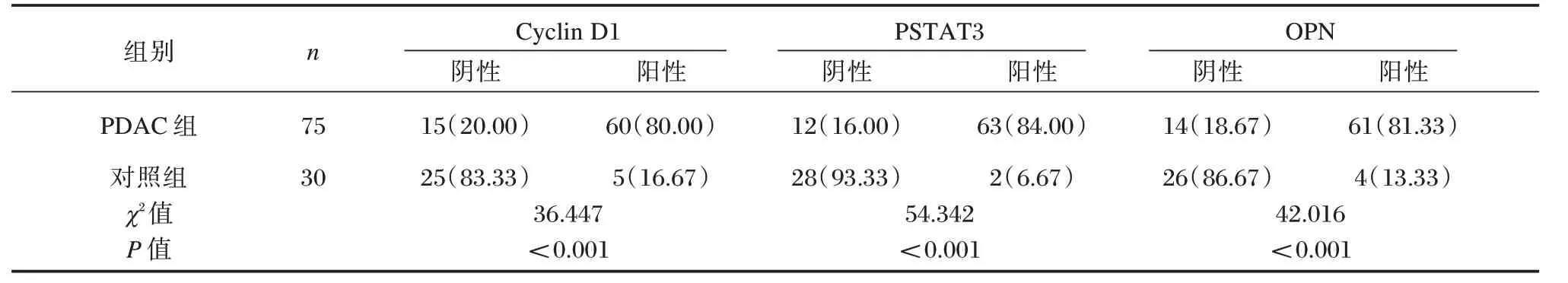
表1 Cyclin D1、PSTAT3 和OPN 蛋白在PDAC 组织及正常胰腺组织中的表达比较[n(%)]Table 1 Expression comparison of cyclin D1,PSTAT3 and OPN proteins in PDAC tissues and normal pancreatic tissues[n(%)]

图1 Cyclin D1、PSTAT3 及OPN 蛋白免疫组化染色图(SP,×500)Figure 1 Immunohistochemical staining of Cyclin D1,PSTAT3 and OPN protein(SP,×500)
2.2 不同临床病理特征患者Cyclin D1、PSTAT3和OPN 蛋白的表达比较
临床分期Ⅲ+Ⅳ、有淋巴转移及神经浸润的患者Cyclin D1、PSTAT3 和OPN 蛋白阳性率表达显著更高(P<0.05)。见表2。
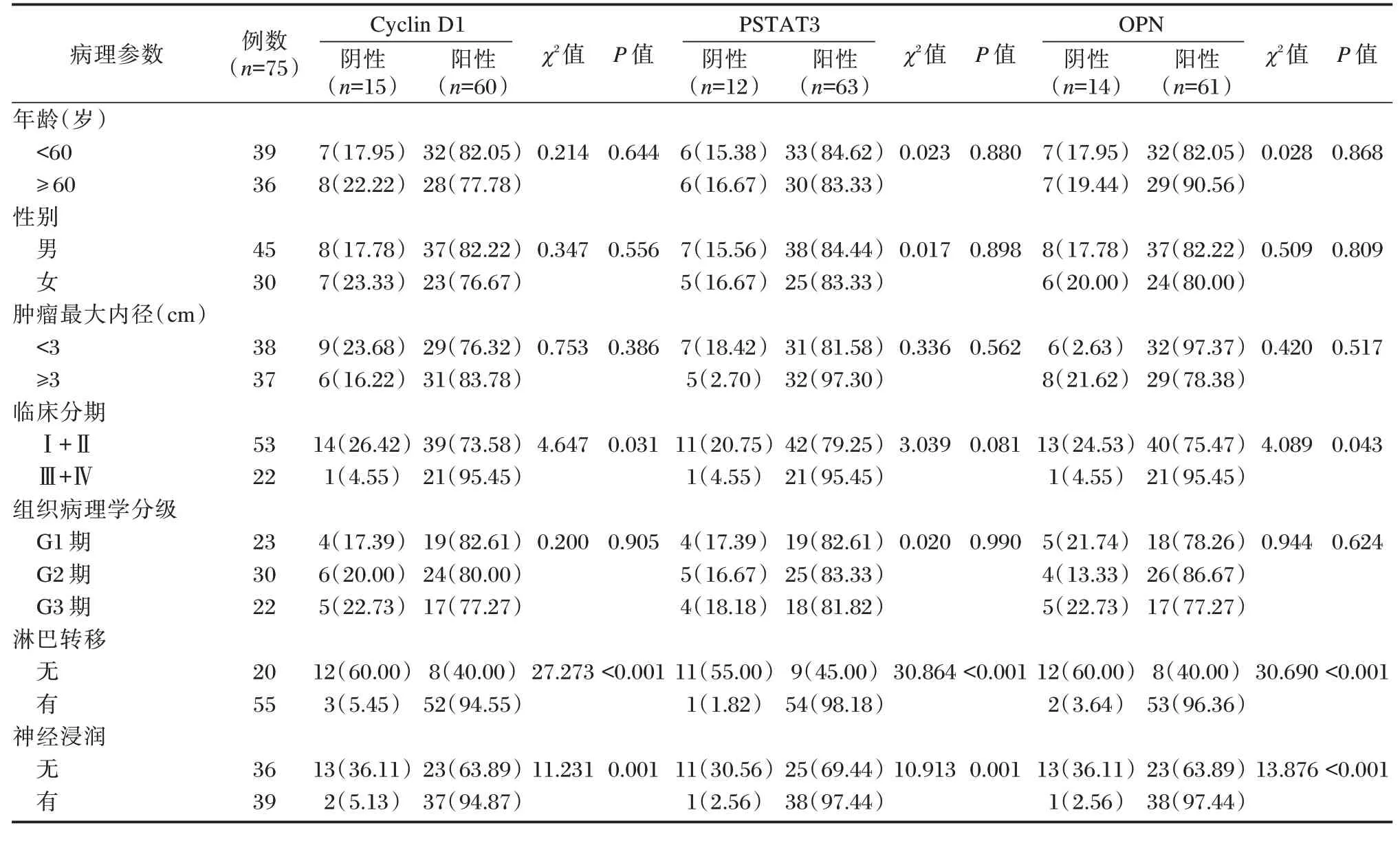
表2 不同临床病理特征患者Cyclin D1、PSTAT3 和OPN 蛋白的表达比较[n(%)]Table 2 Expression of cyclin D1,PSTAT3 and OPN in patients with different clinicopathological features[n(%)]
2.3 影响PDAC 患者预后生存的危险因素
随访结果显示,75 例患者3年生存率为13.33%(10/75)。神经浸润、淋巴转移、Cyclin D1、PSTAT3 和OPN 蛋白阳性是影响PDAC 患者预后生存的独立危险因素(P<0.05)。见表3。
2.4 Cyclin D1、PSTAT3 和OPN 蛋白对PDAC 患者预后生存的影响
Cyclin D1、PSTAT3 及OPN 蛋白阴性组平均生存时间均长于Cyclin D1、PSTAT3 及OPN 蛋白阳性组,差异有统计学意义(P<0.05)。见图2。

图2 不同Cyclin D1、PSTAT3 和OPN 蛋白表达患者预后生存情况Figure 2 Prognosis and survival of patients with different expression of cyclin D1,PSTAT3 and OPN
3 讨论
既往研究显示,STAT3 在多种人类恶性肿瘤组织及细胞系中存在高表达,而在正常组织中表达比较微弱,提示STAT3 信号传导途径的激活在肿瘤的发生过程中起到重要的作用[6]。本研究结果显示,PDAC 患者中PSTAT3 蛋白呈显著阳性表达,且在临床分期越高、出现淋巴结转移及神经浸润患者中阳性表达率更高,表明PSTAT3 蛋白可参与PDAC 的发生发展,这与黄陈等[7]研究中免疫组化发现PSTAT3 在胰腺癌组织中存在高表达,与临床分期及淋巴结转移有关相符合。
目前,CydinD1已被证实是STAT3 信号转导途径下游的一个靶基因[8]。诸多研究证实,CyclinD1 参与多种实体瘤形成的分子病理过程[9-10]。Kanayama 等[11]应用免疫组织化学的方法检测显示CycliID1 蛋白在胰腺癌细胞核中呈阳性表达,而其在正常组织中均为阴性表达,并且其表达情况与患者生存率有关。何劲松[12]等研究证实CydinD1在胰腺癌组织标本中呈过度表达。孟沙等[13]研究提出:当cyclin D1 过表达时,会使细胞失去对生长因子的依赖,产生大量的激酶复合体,诱导Rb 磷酸化,最终释放转录因子E2F,导致细胞增殖加速,在此过程中则易引发细胞癌变。本研究中,CyclinD1 阳性染色定位于细胞的细胞核内,在癌组织中的阳性表达率显著升高,与何劲松等研究数据趋势一致,且本结果中CydinD1在病情严重患者中阳性表达率更高,其发展趋势符合孟沙的研究理论。
OPN 广泛分布于人体内多种组织和细胞中,是一种具有组织细胞特异性的的分泌型磷酸化糖蛋白。国外学者认为,OPN 在多种恶性肿瘤组织中高表达,其参与多种恶性肿瘤的发生发展、侵袭和转移过程,并在一定程度上反映肿瘤细胞的恶性程度[14-15]。关于OPN 参与PDAC 侵袭转移的具体机制目前尚未明确。本组关于OPN 蛋白在PDCA 及不同病理特征患者间中的表达符合国外学者提出的研究理论,且与唐雨等[16]研究中OPN 在胰腺癌组织中过表达的结果一致。本文经进一步Logistic 回归分析及Keplan-meier 生存曲线分析,结果显示:CydinD1、pTAT3 及OPN 蛋白阳性表达是影响患者预后生存的独立危险因素,阳性表达患者生存时间均显著缩短,提示三者可作为评估患者预后的指标。
综上所述,Cyclin D1、PSTAT3 和OPN 蛋白的高表达与PDAC 病情进展及预后有着密切关系,可作为预测患者预后生存的分子标志物和肿瘤治疗的潜在的靶点。
