布鲁氏菌可视化环介导等温扩增方法的建立及应用
2021-09-02张萌阳爱国安翠红侯巍郭莉袁东波尹杰莫茜郭杨吴宣高露王新
张萌,阳爱国,安翠红,侯巍,郭莉,袁东波,尹杰,莫茜,郭杨,吴宣,高露,王新
(1.西北农林科技大学食品科学与工程学院,陕西杨凌 712100)(2.四川省动物疫病预防控制中心,四川成都611130)(3.陕西省疾病预防控制中心,陕西西安 710054)(4.四川省疾病预防控制中心,四川成都 610041)
近年来,羊奶因其与人类乳汁的相似性比牛奶更高、营养丰富、易于消化吸收等特点备受人们喜爱,甚至被称为“奶中之王”[1]。陕西省因其特殊的地理位置和历史原因,奶山羊产业链发展迅速,富平县甚至被授予“中国羊乳之都”称号。2018年,陕西省启动了“千亿级奶山羊全产业链”工程。奶山羊产业备受关注,人们对羊奶及其制品的需求越来越大。而羊是导致布鲁氏菌病流行与爆发的主要食源性动物。据统计,2018年陕西省共突发 4起布鲁氏菌病疫情、报告发病 15例[2]。因此,对布鲁氏菌病的防治与快速诊断刻不容缓。
布鲁氏菌(Brucellaspp.)是一种无运动性、无荚膜、兼性厌氧的革兰氏阴性杆菌,且具有较强的致病性和宿主特异性[3]。1985年,布鲁氏菌被系统地分为了6个种19个型,包括牛种布鲁氏菌(B.abortus)8个型、猪种布鲁氏菌(B.suis)5个型、羊种布鲁氏菌(B.melitensis)3个型、犬种布鲁氏菌(B.canis)、绵羊附睾种布鲁氏菌(B.ovis)和沙林鼠布鲁氏菌(B.neotome)各1个型[4]。由感染布鲁氏菌而引起的人畜共患疾病称为布鲁氏菌病(Brucellosis,以下简称布病)。最易感染布病的动物包括牛、羊和猪[5]。动物通过食用被污染的饲料和接触被感染的动物而患病。患病后的动物表现为流产、不孕、产奶量下降等症状[6]。人类通过接触被感染的动物、食用被污染的肉类或者奶制品而患病[2]。众所周知,布病已经对畜牧业造成严重的经济损失并且严重影响其发展,甚至威胁到人类的健康安全。因此,建立一种快速、简单、灵敏的方法检验布鲁氏菌显得尤为重要。
目前,用于检测布鲁氏菌的方法主要包括病原学检测、血清学检测及分子生物学方法[7]。其中最常用的检测方法是病原学检测,即分离培养出目标菌株,被称作是检测布病的“黄金标准”。但该方法对实验室的要求较高、检测周期较长、灵敏度较低且常用于发病期检测[8,9]。血清学检测包括试管凝集试验、补体结合试验、虎红平板凝集试验等方法,则具有单克隆抗体制备周期长且复杂、实际操作中限制条件较多、检测成本较高等缺点[10,11]。分子生物学检测包括聚合酶链式反应(PCR)、实时定量PCR(RT-PCR)等方法,具有灵敏度高、特异性强等优点,但这些大多需要昂贵的专业仪器设备,不适合现场检验[11-14]。2000年,Notomi研发出了一种新的分子检测技术,称为环介导等温扩增技术(Loop-Mediated Isothermal Amplification,LAMP)。这一技术采用 DNA 聚合酶和一组四个引物对DNA靶序列进行扩增,反应可在60~65 ℃等温条件下进行扩增,一般60 min即可反应完全[15]。与传统的检测方法比较,LAMP具有高特异性、高灵敏度、快速高效等优点,适合基层与现场检验[15-19]。
基于以上优点,LAMP已经被广泛应用于病原微生物的快速检测方面,如金黄色葡萄球菌、单增李斯特菌、肠球菌耶尔森氏菌、志贺氏菌等[20-23]。本研究主要针对布鲁氏菌的保守基因Omp2a设计3对LAMP引物,对布鲁氏菌进行检测,优化LAMP反应条件与反应体系,建立了一种特异、灵敏和可视化的LAMP检测布鲁氏菌的方法。同时,本研究还检测了该方法的特异性和灵敏度。
1 材料与方法
1.1 材料
1.1.1 菌株和样本来源
布氏菌病活疫苗(猪种S2株、牛种A19株、羊种M5株)为天康生物股份有限公司产品;大肠杆菌ATCC25922、沙门氏菌 H9812、金黄色葡萄球菌ATCC29213、单核细胞增生李斯特菌CMCC 54004、蜡样芽孢杆菌ATCC14579、小肠结肠炎耶尔森氏菌和福氏志贺氏菌对照菌株均来西北农林科技大学食品科学与工程学院食源性病原微生物实验室保存。实际羊种菌布鲁氏菌核酸样本及该方法的验证由某疾病预防控制中心实验室提供。
1.1.2 主要试剂
基因组抽提试剂盒购自杭州博日科技有限公司;10×ThermoPol Buffer、MgSO4、Bst DNA Polymerase Large Fragment聚合酶购自南京诺唯赞生物科技有限公司;dNTP Mix(10 mM)购自上海笛医生物科技有限公司;甜菜碱购自大连美仑生物技术有限公司;羟基萘酚蓝(HNB)购自上海源叶生物科技有限公司;SYBR Green Ⅰ(10000×)购自北京索莱宝科技有限公司。
1.1.3 主要仪器与设备
高压灭菌锅(MDF-U5411)购自上海申安高压仪器设备有限公司;超净工作台(NU-425-400E)购自苏州净化设备有限公司;超纯水机(Milli-Q Synthesis)购自法国Millpro公司;PCR仪(Mycircle)购自美国Bio-Rad公司;电泳仪(DYY-6C)购自北京六一生物科技有限公司;凝胶成像系统(GEL DOC XR)购自美国Bio-Rad公司。
1.2 方法
1.2.1 LAMP引物的设计与合成
在GenBank数据库中检索布鲁氏菌Omp2a基因序列,选取不同种属的Omp2a基因序列(AY008719.1、MF966952.1、MF966953.1、AY008721.1、AY008720.1),通过Clustal软件比对分析,选取特异性好的保守片段。通过在线软件 PrimerExplorer V5(http://primerexplorer.jp/e/)设计一套 LAMP引物,包括两条外引物(F3、B3)、两条内引物(FIP、BIP)和两条环引物(LF、LB),如表1所示。引物由北京奥科鼎盛生物科技有限公司合成,用ddH2O溶解后分装,-20 ℃冰箱保存备用。
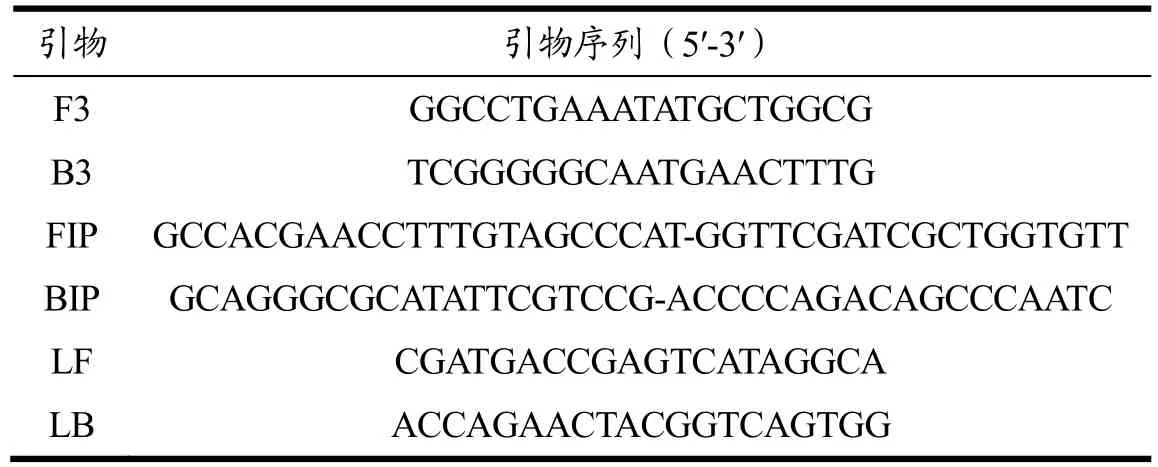
表1 LAMP引物序列Table 1 Primer sequence of LAMP assays
1.2.2 细菌基因组DNA的提取
取购买布鲁氏菌活疫苗株S2、A19和M5加入无菌水后,放置于80 ℃水浴锅内灭活30 min,按照细菌基因组提取试剂盒使用说明进行布鲁氏菌基因组的提取,测定DNA模板浓度及纯度,存放于-20 ℃冰箱备用。其它菌株的DNA由西北农林科技大学食品科学与工程学院食源性病原微生物实验室保存。
1.2.3 LAMP检测方法的优化
根据Bst DNA Polymerase Large Fragment聚合酶的说明书推荐,将双蒸水、10×ThermoPol Buffer、MgSO4、dNTP Mix、甜菜碱、FIP和BIP、F3和B3、LF和LB、HNB、Bst DNA Polymerase Large Fragment和模板DNA(含量为10 ng、1 ng、0.1 ng等)在冰浴条件下依次加入到EP管中,混合均匀,于加热器或PCR仪恒温孵育1 h。反应结束后,将EP管于85 ℃下灭活5 min,扩增产物于4 ℃冰箱中保存。
1.2.3.1 LAMP反应温度优化
设置反应温度为 60 ℃、61 ℃、62 ℃、63 ℃、64 ℃、65 ℃和66 ℃,以S2标准菌株的DNA(25.6 ng/μL)为反应模板,检测LAMP最适的反应温度。根据琼脂糖凝胶结果选择最适反应温度。
1.2.3.2 LAMP反应时间优化
设置反应时间为15、30、45、60、75和90 min,以S2标准菌株的DNA(25.6 ng/μL)为反应模板,检测LAMP最适的反应时间。根据琼脂糖凝胶结果选择最适反应时间。
1.2.3.3 Mg2+浓度优化
设置Mg2+的浓度分别为0 mM、2 mM、4 mM、6 mM、8 mM、10 mM、12 mM和14 mM,以S2标准菌株的DNA(25.6 ng/μL)为反应模板,检测LAMP最适的Mg2+浓度。根据琼脂糖凝胶结果选择最适Mg2+浓度。
1.2.3.4 Bst聚合酶浓度优化
设置Bst聚合酶的浓度分别为0.192 U/µL、0.256 U/µL、0.320 U/µL、0.384 U/µL 和 0.448 U/µL,以 S2标准菌株的 DNA(25.6 ng/μL)为反应模板,检测LAMP最适的Bst聚合酶浓度。根据琼脂糖凝胶结果选择最适Bst聚合酶浓度。
1.2.3.5 甜菜碱浓度优化
设置甜菜碱的浓度分别为0 M、0.2 M、0.4 M、0.6 M、0.8 M和1.0 M,以S2标准菌株的DNA(25.6 ng/μL)为反应模板,检测LAMP最适的甜菜碱浓度。根据琼脂糖凝胶结果选择最适甜菜碱浓度。
1.2.3.6 dNTPs浓度优化
设置dNTPs的浓度分别为0 mM、0.6 mM、1.0 mM、1.4 mM、1.8 mM和2.2 mM,以S2标准菌株的DNA(25.6 ng/μL)为反应模板,检测LAMP最适的dNTPs浓度。根据琼脂糖凝胶结果选择最适 dNTPs浓度。
1.2.3.7 内外引物浓度比优化
设置内外引物的浓度比分别为2:1、4:1、6:1、8:1、10:1和12:1,以S2标准菌株的DNA(25.6 ng/μL)为反应模板,检测LAMP最适的内外引物浓度比。根据琼脂糖凝胶结果选择最适内外引物浓度比。
1.2.3.8 可视化染料HNB浓度优化
设置HNB的浓度分别为0 μM、60 μM、120 μM、180 μM 和 240 μM,以 S2标准菌株的 DNA(25.6 ng/μL)为反应模板,检测LAMP最适的HNB浓度。根据琼脂糖凝胶结果选择最适HNB浓度。重复3次。
1.2.4 LAMP扩增结果检测
1.2.4.1 琼脂糖凝胶电泳检测
LAMP反应扩增后的产物是若干个不同长度的茎环DNA混合物,其在琼脂糖凝胶电泳的中的条带呈现特殊的梯状结构。使用浓度为 2%的琼脂糖凝胶进行电泳。电泳时,DNA Marker(DL2000)与LAMP扩增产物的点样量分别是5 µL和2 µL,电压为120 V,电泳时间为35 min。电泳后的凝胶置于凝胶成像系统中紫外成像。成像后的电泳条带为特殊的梯状结构,则扩增结果为阳性;若无条带,则扩增结果为阴性。
1.2.4.2 可视化HNB染料检测
LAMP反应过程中会消耗混合溶液中的Mg2+。而羟基萘酚蓝(HNB)是一种常见的金属指示剂,含有不同浓度Mg2+的混合液体颜色不同。在白色背景下观察扩增产物的颜色:若扩增产物保持紫罗兰色不变,则表明DNA未扩增,结果为阴性;若扩增产物颜色变为蓝色,则表明DNA扩增,结果为阳性。
1.2.5 LAMP特异性检测
为确保建立方法的特异性,用优化好的反应体系及反应条件检测3种布鲁氏菌及7种非布鲁氏菌,每种细菌的DNA模板添加量为1 µL。
1.2.6 LAMP灵敏度检测
采用10倍梯度稀释法检测建立方法的检测限。每个梯度的DNA模板取1 µL加于优化好的反应体系中,在最适反应条件下扩增并判断结果。
1.2.7 聚合酶链式反应(PCR)比较验证
常规PCR的引物及反应条件来自文献[24],其具体序列如表2所示。
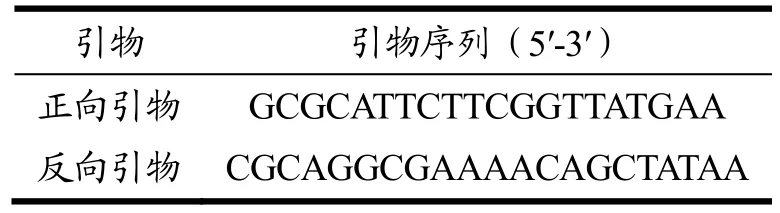
表2 PCR引物序列Table 2 Primer sequence of PCR assays
PCR 反应体系(25 µL):2.5 µL 的 10×Buffer、5 µL dNTP Mix(2.5 mM)、3 µL MgSO4(25 mM)、0.5 µL F3(12.5 µM)、0.5 µL B3(12.5 µM)、0.125 µL Taq酶(5 U/µL)、1 µL DNA 模板(含量分别为 10 ng、1 ng、0.1 ng等),用双蒸水补足体系。
PCR反应条件为:94 ℃预变性3 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃继续延伸5 min后在4 ℃下保存。
1.2.8 LAMP重复性检测
本研究所有实验均重复3次及以上,以确保实验具有良好的重复性与稳定性。
1.2.9 LAMP进行阳性布鲁氏菌DNA和阴性对照菌DNA的验证检测
将本研究建立好的LAMP最佳试剂及其扩增条件提供给某疾病预防控制中心实验室进行9份阳性布鲁氏菌DNA和4份阴性对照菌DNA(包括大肠埃希菌、金黄色葡萄球菌、伤寒沙门菌和蜡样芽胞杆菌)的验证检测。
1.2.10 统计学分析
计算LAMP检测方法相对常规分离方法检测布鲁氏菌的敏感性和特异性。敏感性和特异性的计算公式如下:

LAMP和PCR的检测结果,采用SPSS 18.0统计软件对敏感性和特异性进行卡方检验,p<0.05认为差异有统计学意义。
2 结果与分析
2.1 LAMP检测方法优化结果
优化后的LAMP检测方法体系如表3所示。
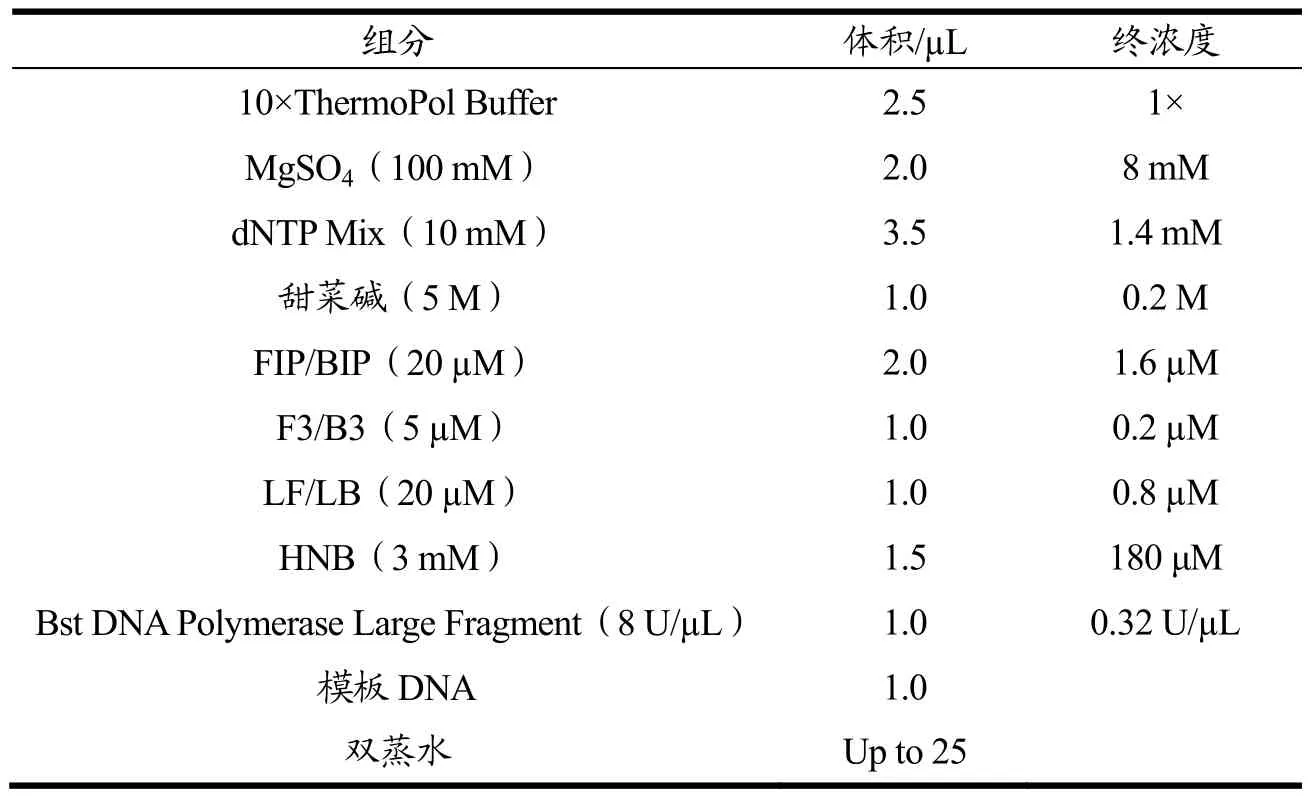
表3 优化后的LAMP体系Table 3 Optimization of LAMP assays
优化后LAMP检测方法的反应条件是:62 ℃反应45 min。
2.1.1 LAMP反应温度的优化结果
在设置好的温度梯度下进行LAMP反应,结果如图1所示。由图可见,在设置的反应梯度温度范围内,LMAP扩增都有较清晰的梯状条带。其中反应温度为62 ℃时,LAMP的梯状条带最为清晰明亮。因此,选择62 ℃为LAMP反应最适温度。
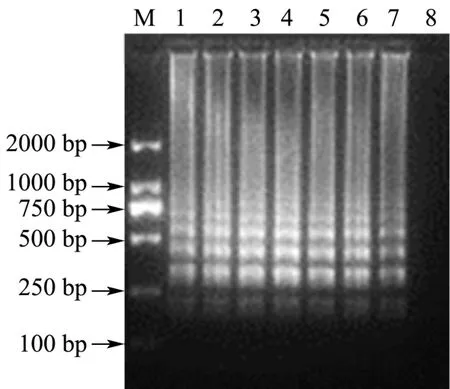
图1 反应温度的优化结果Fig.1 Optimization of reaction temperature
2.1.2 LAMP反应时间的优化结果
在设置好的时间梯度下进行LAMP反应,结果如图2所示。由图可见,反应时间为30 min时,LAMP扩增即出现清晰明亮的梯状条带且呈现稳定趋势。为保证建立LAMP方法的灵敏度及稳定性,选择45 min为最优反应时间。
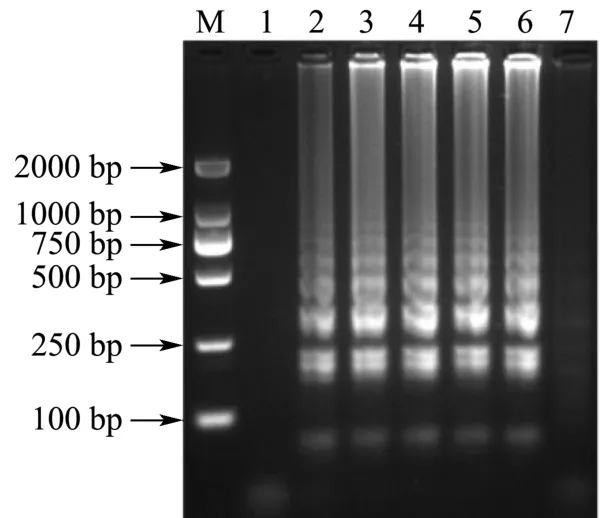
图2 反应时间的优化结果Fig.2 Optimization of reaction time
2.1.3 Mg2+浓度的优化结果
在设置好的Mg2+浓度下进行LAMP反应,结果如图3所示。由图可见,Mg2+浓度为4 mM~14 mM时,LAMP扩增即出现清晰明亮的梯状条带且呈现稳定趋势。其中Mg2+浓度为8 mM时,扩增产物最多,电泳条带最为清晰明亮。当Mg2+浓度过高时,电泳条带变得模糊,LAMP反应被抑制。因此,选取8 mM为最适Mg2+浓度。
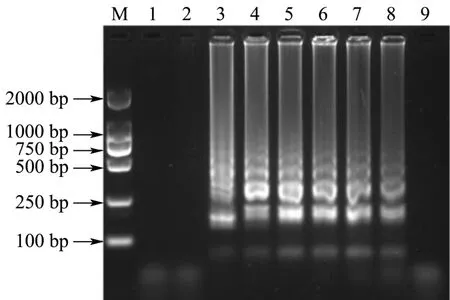
图3 Mg2+浓度的优化结果Fig.3 Optimization of the concentration of Mg2+
2.1.4 Bst聚合酶浓度的优化结果
在设置好的Bst聚合酶浓度下进行LAMP反应,结果如图4所示。由图可见,Bst聚合酶浓度在0.192 U/µL~0.448 U/µL范围内,LAMP扩增均出现清晰明亮的梯状条带。在设置范围内,Bst聚合酶浓度对LAMP扩增的影响无明显差异。根据前期实验经验,选取0.320 U/µL为最适Bst聚合酶浓度。
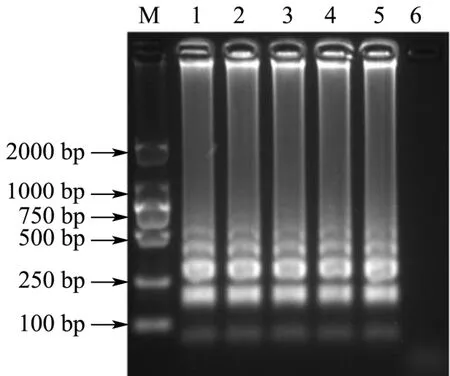
图4 Bst聚合酶浓度的优化结果Fig.4 Optimization of the concentration of Bst DNA polymerase
2.1.5 甜菜碱浓度的优化结果
甜菜碱浓度对LAMP反应的影响结果如图5所示。由图可见,在设置的甜菜碱浓度范围内,不同浓度的甜菜碱对LAMP反应的影响无显著差异。
2.1.6 dNTPs浓度的优化结果
dNTPs浓度对LAMP反应的影响结果如图6所示。由图可见,dNTPs浓度在1.0~2.0 mM范围内,LAMP反应均扩增出清晰的电泳条带。因此,选择条带最为清晰明亮的1.4 mM为最适dNTPs浓度。
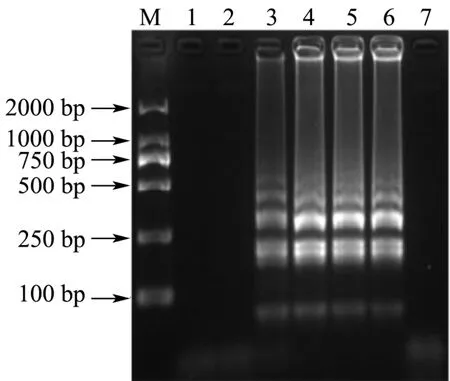
图6 dNTPs浓度的优化结果Fig.6 Optimization of the concentration of dNTPs
2.1.7 内外引物浓度比的优化结果
内外引物浓度比对LAMP反应的影响结果如图7所示。由图可见,在设置的内外引物浓度比范围内,LAMP反应均扩增出梯状条带。其中内外引物浓度比为 8:1时,电泳条带最为清晰明亮。因此,选择 8:1为最佳内外引物浓度比。
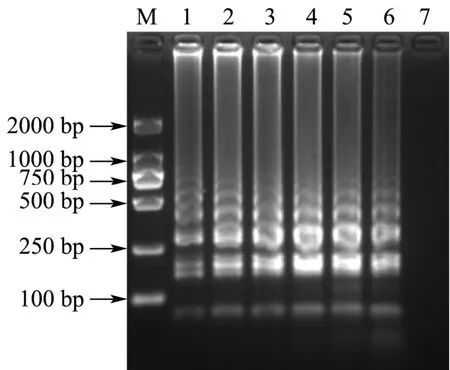
图7 内外引物浓度比的优化结果Fig.7 Optimization of the concentration ratio of internal and external primers
2.1.8 可视化染料HNB浓度的优化结果
HNB浓度比对LAMP反应的影响结果如图所示。由图8a可见,在设置的HNB浓度范围内,LAMP反应均扩增出明亮的梯状条带,说明HNB对LAMP反应无抑制作用。由图8b可见,HNB浓度为180 μM时,阳性对照与空白对照之间的颜色差异最为明显。因此,选择180 μM为最佳HNB浓度。
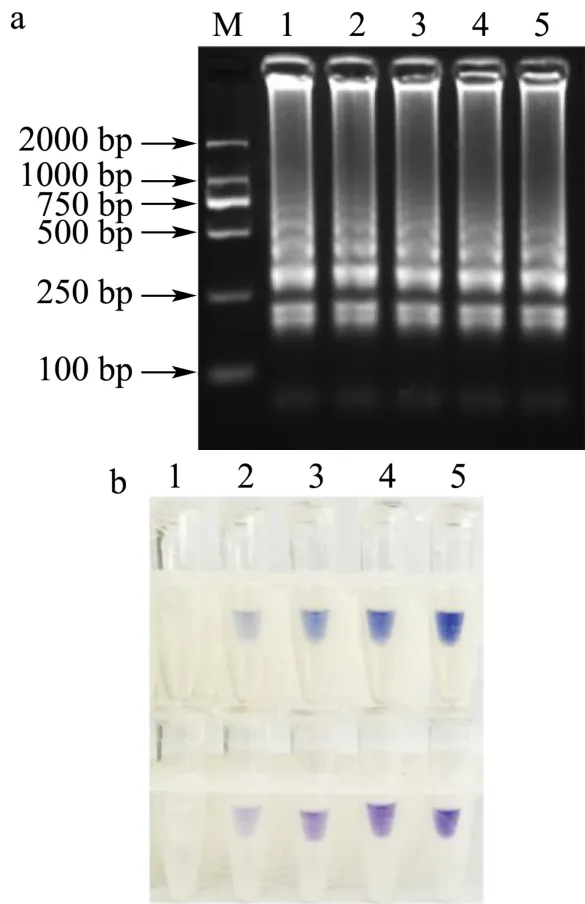
图8 LAMP反应HNB浓度的优化结果Fig.8 Optimization of the concentration of HNB
2.2 LAMP特异性检测结果
用7种非布鲁氏菌的DNA以及3种布鲁氏菌的DNA为模板,采用前面优化过的 LAMP体系,在62 ℃恒温反应45 min,在自然光下观察反应管颜色。同时,取2 μL反应产物在2%琼脂糖凝胶上进行电泳分析。如图9所示,加入3种布鲁氏菌模板的反应管颜色均由紫罗兰色变为蓝色,与电泳结果一致。表明设计引物的特异性良好,能准确区分布鲁氏菌与非布鲁氏菌。
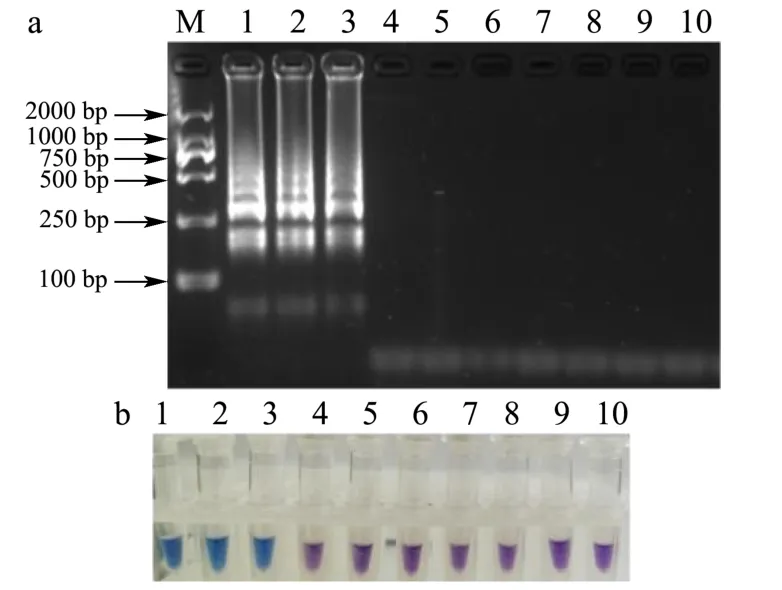
图9 LAMP特异性检测结果Fig.9 Specificity of LAMP assays
2.3 LAMP灵敏度检测结果
将浓度为256 ng/µL的DNA模板10倍梯度稀释,并取1 µL加到LAMP反应体系中。62 ℃反应45 min后,灵敏度检测结果如图10。结果表明,建立的LAMP方法检测限为2.56×10-4ng/µL,且可视化结果与凝胶电泳结果一致。
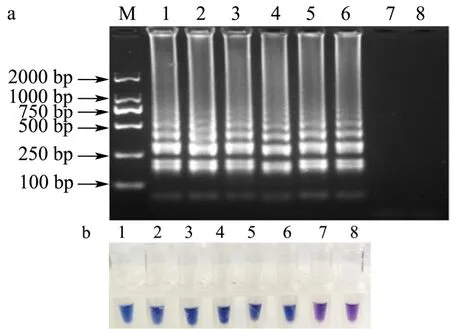
图10 LAMP灵敏度检测结果Fig.10 Sensitivity of LAMP assays
2.4 PCR结果分析
如图11所示,PCR反应的检测限为 2.56×10-3ng/µL,灵敏度低于建立好的LAMP检测方法。
2.5 LAMP进行阳性布鲁氏菌DNA和阴性对照菌DNA的验证检测结果
将构建成功的 LAMP方法用于检测某疾病预防控制中心实验室提供9份阳性布鲁氏菌DNA和4份阴性对照菌 DNA进行验证检测,结果发现,LAMP法相对 9份阳性布鲁氏菌 DNA和 4份阴性对照菌DNA(包括大肠埃希菌、金黄色葡萄球菌、伤寒沙门菌和蜡样芽胞杆菌)的敏感性和特异性均为 100%,无统计学差异(见图12,p>0.05)。

图12 LAMP检测9份阳性布鲁氏菌DNA和4份阴性对照菌DNA的验证检测结果Fig.12 Detection results of 9 DNA samples of Brucella spp. and 4 DNA samples of control bacteria by LAMP
2.6 讨论
布鲁氏菌的寄主具有多样性,动物与人类普遍易感[25]。近年来,消费者们越来越关注食品安全问题,同时食品行业和政府部门也表达了快速简便检验布鲁氏菌的迫切需求。目前,常用于检测布鲁氏菌的病原学检测方法、免疫学检测方法、PCR和RT-PCR检测方法都具有一定的局限性,并不适用于资源匮乏的基层检验与野外现场检验[26,27]。作为一种新型的分子检验技术,LAMP是一种特异性强、灵敏度高、操作简单、反应快速的检测方法,且它不需要昂贵的仪器只要一台稳定的水浴锅即可满足试验条件[28]。
自LAMP方法建立以来,经过数年的发展,该方法已经较为成熟。其结果的判定方法从一开始的浊度检测和凝胶电泳检测发展为现在的添加染料检测方法。浊度仪机器昂贵且使用范围小,凝胶检测耗时长且容易造成污染,而添加染料检测结果方便观察且不易污染[29]。与其他研究采用SYBR Green、钙黄绿素、SYTO-82等染料相比,本研究采用HNB染料作为指示剂,经过浓度优化后具有不影响LAMP扩增、能准确灵敏的反应结果、颜色对比明显、价格低廉且无需荧光即肉眼可见等优点。这种不需要开盖检测结果的方法大大减少了气溶胶的形成与扩散,降低了LAMP发生假阳性的概率。
3 结论
为了建立一种快速、高效、特异性好的基于LAMP检测布鲁氏菌的方法,本研究针对布鲁氏菌的保守基因Omp2a设计了一套六个引物,包括两条外引物(F3、B3)、两条内引物(FIP、BIP)和两条环引物(LF、LB)。为了检验 LAMP方法的特异性,本研究对 10种菌株纯培养物(包括3种布鲁氏菌和7种非布鲁氏菌)和9个实际样本进行了检测,并与常规病原学检测方法进行了比较。结果表明,本研究优化好的LAMP方法可以准确区分布鲁氏菌与非布鲁氏菌,在所用实际样本检测中的敏感性与特异性均为 100%。同时,灵敏度检验结果表明优化好的 LAMP检测方法的灵敏度(检测限为2.56×10-4ng/µL)是传统PCR的10倍。并且在环引物的作用下,本研究的LAMP扩增仅需45 min即可完成,较通常所需的60 min节省了时间。总而言之,本研究建立的LAMP方法可以准确、快速的检验布鲁氏菌且适用于基层检验和现场检验。
