鸡胸软骨糖/肽水解物的结构表征及其抗炎活性
2021-09-02王瑞琦郭玉杰沈青山刘云鹤刘济千张志强张春晖
王瑞琦,郭玉杰,沈青山,刘云鹤,刘济千,张志强,张春晖
(1.宁夏大学食品与葡萄酒学院,宁夏银川 750021)(2.中国农业科学院农产品加工研究所,农业部农产品加工综合性重点实验室,北京 100193)(3.新疆泰昆集团股份有限公司,新疆昌吉 831100)(4.山东海钰生物技术股份有限公司,山东济宁 272000)
骨关节炎(Osteoarthritis,OA)又称退行性骨关节病,是一种以关节软骨变性、破坏及骨质增生为特征的慢性关节疾病[1]。目前临床上对骨关节炎的治疗还未找到较好的方法,大多通过非甾体药物来减轻疼痛,延缓病情发展,改善患者生活质量。硫酸软骨素(Chondroitin sulfate,CS)作为改变骨关节炎症状的慢作用药物,对慢性骨关节炎具有良好的治疗效果[2]。在欧洲、美国等发达国家,已作为药品和膳食补充剂的重要原料用于减少骨关节患者疼痛、改善关节功能[3]。除硫酸软骨素外,骨胶原蛋白肽也能起到缓解骨关节炎的作用。Fanny[4]等研究发现骨胶原蛋白肽不仅能增加机体骨骼的稳定性和坚固性,还能刺激机体软骨细胞合成II型胶原蛋白,缓解骨关节炎症。一些以II型胶原蛋白为主的软骨组织经酶解制备的软骨胶原蛋白肽能使机体产生免疫耐受,能有效地抑制关节组织内部的自身免疫反应,对骨关节炎有明显的防治功效[5]。动物的软骨组织中富含胶原蛋白、硫酸软骨素和矿物质元素等生物活性物质[6]。这些活性成分对关节炎、骨质疏松等退行性骨关节疾病具有潜在改善和治疗作用,是制备骨健康类功能食品的重要原料。
我国肉鸡产业发达,2019年鸡肉产量高达 1380万t,位居世界第二[7]。肉鸡在加工过程中产生大量的骨副产物,这些副产物并没有被合理利用,大多被当作废弃物直接丢弃或用于饲料生产,造成了严重的环境污染和资源浪费。因此,鸡骨副产物的高值化加工利用意义重大。鸡胸软骨作为肉鸡加工的主要副产品之一,其水解物对大鼠骨关节炎具有显著免疫调节作用[8],但是软骨水解物中包含了骨多肽、骨多糖和硫酸软骨素等组分,具体哪些功能物质发挥了主要抗炎活性尚无明确定论。
本研究以鸡胸软骨为原料,通过制备鸡胸软骨水解物、鸡胸软骨胶原蛋白肽和硫酸软骨素对其进行结构表征。并以碘乙酸钠诱导关节炎大鼠为动物模型,通过斜板实验探究了鸡胸软骨水解物对大鼠关节炎的缓解作用。并通过对关节炎大鼠中三种主要炎症因子TNF-α、IL-1β、PGE-2的分泌影响,进一步分析鸡胸软骨水解物中II型胶原蛋白肽和硫酸软骨素在抗炎活性中发挥的作用,明确鸡胸软骨水解物中抗炎活性成分,为抗骨关节炎活性功能性食品开发提供依据。
1 材料与方法
1.1 材料与试剂
鸡胸软骨,来自 42日龄成年白羽鸡,由河南PROTIL生物技术有限公司提供,将剔除肉和筋膜的鸡胸软骨保存于-20 ℃冰箱备用。硫酸软骨素A标准品和硫酸软骨素ABC酶(50~250 U/mg),美国Sigma公司。硫酸皮肤素和肝素,美国 Medchem公司。木瓜蛋白酶(800 U/mg)和胰蛋白酶(1:250),北京Solarbio科技有限公司。软骨类不饱和二糖标准品ΔDi0 S ( ΔUA-[1→3]-GalNAc), ΔDi4 S( ΔUA-[1→3]-GalNAc-4 S ) , ΔDi6 S(ΔUA-[1→3]-GalNAc-6 S),ΔDi2,4 diS(ΔDi-dis B,ΔUA-2 S-[1→3]-GalNAc-4 S),ΔDi2,6 diS(ΔDi-dis D,ΔUA-2 S-[1→3]-GalNAc-6 S),ΔDi4,6 diS(ΔDidis,ΔUA-4 S-[1→3]-GalNAc-6 S),ΔDi2,4,6 triS(ΔDi tris,ΔUA-2 S-[1→3]-GalNAc-4 S,6 S),英国Iduron公司。IL-1βElisa试剂盒、TNF-αElisa试剂盒、PGE-2 Elisa试剂盒,南京建成生物有限公司。
实验动物:47只SD健康雄性大鼠(许可证号:SYXK(京)2018-0033),由北京福纳康生物技术有限公司提供,5~6周龄,体重125 g~150 g,按照标准饲养条件饲养,室内温度22 ℃~25 ℃,湿度为50%~60%,光照为每12 h昼夜交替,饮用纯净水,使用标准饲料适应性饲养2周后,再进行实验。本文研究所做动物实验均获得伦理委员会批准。
1.2 仪器与设备
Agilent1100氨基酸分析仪,美国安捷伦公司。TENSOR27傅立叶红外光谱仪,瑞士 Bruker公司。ICS-300高效液相色谱仪,美国戴安公司。FD-1A-50真空冷冻干燥机,北京博医康实验仪器有限公司。MOS-450圆二色光谱仪,法国Biologic公司。
1.3 试验方法
1.3.1 鸡胸软骨水解物活性成分的制备
软骨解冻后放入烧杯中,烧杯中加入蒸馏水,软骨与蒸馏水的固液比为1:2.5(W/V)。在120 ℃(0.1MPa)条件下热压处理90 min。将热压后的软骨液化液在1200 r/min条件下匀质20 s,并用六层纱布进行过滤除去残渣。向滤液中加入蒸馏水,调节可溶性固形物含量至2.0,加入胰蛋白酶(0.13%),60 ℃条件下酶解2 h。加入木瓜蛋白酶(0.1%),60 ℃条件下继续酶解2 h。反应结束后,沸水加热5 min,进行灭酶处理。将酶解后的软骨液化液用离心机离心,取上层清夜。将离心后的上层清液放入冷冻干燥机中,冻干后的样品即为软骨水解物样品。
参照沈青山[9]等的方法,将酶解后的上层清液用0.45 μm的微滤膜进行过滤,得到第一截留物和第一滤液,将第一滤液加入等量蒸馏水,在10 ku的超滤膜条件下,进行六次循环过滤,蠕动泵转速设置为100 r/min,得到第二截留物和第二滤液。将第一截留物与第二滤液进行合并后用冷冻干燥机进行冻干,即为胶原蛋白肽样品。将第二截留物用冷冻干燥机进行干燥即为硫酸软骨素样品。
1.3.2 提取率计算
胶原蛋白肽提取率=冻干所得的胶原蛋白肽质量/鸡胸软骨质量(干重)×100%
硫酸软骨素提取率=冻干所得的硫酸软骨素质量/鸡胸软骨质量(干重)×100%
1.3.3 扫描电镜
将软骨水解物,胶原蛋白肽和硫酸软骨素样品在2.5%戊二醛中室温下固定4 h,再用1%锇酸固定2 h,蒸馏水除去锇酸。用乙醇进行分级脱水(30%~100%),样品用临界点进行干燥。将所有样品固定在铝制短管上,涂上金。在10 kV加速电压下观察样品微观结构,放大倍数为 150×和 2000×[10]。
1.3.4 傅里叶红外光谱
将软骨水解物、胶原蛋白肽、硫酸软骨素样品与硫酸软骨素A标准品分别与KBr固体(1:200)充分混匀研磨后,进行压片,使用傅里叶变换红外光谱仪,在4000~400 cm-1范围内,分辨率为4 cm-1,频率为16次条件下进行扫描[11]。
1.3.5 氨基酸分析
分别称取100 mg软骨水解物和胶原蛋白肽样品,溶于10 mL的6 mol/L HCl中,充氮气3 min,微沸状态时密封,110 ℃水解24 h,加入5 mL 10 mol/L NaOH进行中和,定容后用双层滤纸过滤,15000 r/min条件下离心 10 min后取上清液于氨基酸自动分析仪分析[12]。
1.3.6 肽分子量分布
参考叶燕军[13]等的方法,用安捷伦液相色谱仪(安捷伦 HPLC1260-II)测定软骨水解物和胶原蛋白肽样品的肽分子量分布,色谱柱 TSK gel G2000 SWXL(7.8×300 mm,TOSOH,Tokyo,Japan),在214 nm处检测。流动相为乙腈/水/三氟乙酸(45/55/0.1,V/V/V),流速为0.5 mL/min。柱温为40 ℃,进样体积为10 μL。以细胞色素C(12384 u)、抑肽酶(6495 u)、杆菌肽(1421 u)、四肽(451 u)和二肽(146 u)为标准品,分子量校准曲线(y=-3.904x+27.693,R2=0.9832)。
1.3.7 胶原蛋白肽样品紫外光谱与圆二色性分析
将胶原蛋白肽样品溶于0.05 mol/L醋酸(HAc)溶液中,配制成浓度为 0.3 mg/mL的溶液。以 0.05 mol/L的HAc溶液作为空白,在190~500 nm波长下进行紫外光谱检测[14]。
将胶原蛋白肽样品溶于0.05 mol/L醋酸(HAc)溶液,配成浓度为0.3 mg/mL的溶液,在190~250 nm波长下平均扫描3次[15]。
1.3.8 硫酸软骨素样品琼脂糖凝胶电泳
参考Volpi N[16]等的方法,对所提硫酸软骨素样品进行琼脂糖凝胶电泳分析。首先配制硫酸软骨素ABC酶缓冲液(33 mM Tris-HCl、pH=6.2、33 mM醋酸钠和1 mU软骨素ABC酶),保存备用。将硫酸软骨素样品,硫酸软骨素A标准品,硫酸皮肤素和肝素溶于硫酸软骨素ABC酶缓冲液中,配置为5 mg/mL的样品,在37 ℃下酶解12 h。将20 μL硫酸软骨素ABC酶处理前后的硫酸软骨素样品,硫酸软骨素A标准品,硫酸皮肤素和肝素进行琼脂糖凝胶电泳。电泳结束后在0.1%十六烷基三甲基溴化铵溶液中浸泡6 h后用甲苯胺蓝染色6 h。背景用蒸馏水淡去后进行观察分析。
1.3.9 二糖组成分析及蛋白含量测定
参考Maccri F[17]等的方法,将提取的硫酸软骨素样品加入硫酸软骨素 ABC酶缓冲液中,配置为 5 mg/mL的样品,37 ℃条件下酶解 12 h,酶解后在100 ℃条件下5 min使酶失活,冷却至室温后13000 r/min离心20 min,取上清液,冷冻备用。酶解后样品采用HPLC法进行二糖组成分析,色谱柱为Ultimate SAX型色谱柱;检测波长为232 nm;柱温为40 ℃;流速为0.75 mL/min;流动相A为1 M的氯化钠(pH 4),流动相B为50 mM(pH 4),洗脱程序在0~5 min,A保持0%;在5~35 min,进行梯度洗脱。进样量为10 μL,用标准双糖进行定性定量分析。
采用Lowry法对硫酸软骨素样品中蛋白含量进行测定[18]。
1.3.10 鸡胸软骨活性成分的抗炎活性试验
将SD大鼠随机分为正常组(7只)和关节炎组(40只)。动物造模采用碘乙酸钠诱导,以观察到大鼠关节肿胀为建模成功标准,最终判定建模成功 35只,将35只建模成功的骨关节炎大鼠随机分为5个实验组,每组7只,具体分组及饲料配置如下:模型组,以灌胃方式给予生理盐水。阳性对照组,灌胃双醋瑞因胶囊8.0 mg/(kg·d)。软骨水解物处理组,灌胃软骨水解物剂量为500 mg/(kg·d)。胶原蛋白肽处理组,灌胃胶原蛋白肽剂量为365 mg/(kg·d)。硫酸软骨素处理组,灌胃硫酸软骨素剂量为100 mg/(kg·d)。从建模成功后第1 d开始连续给药28 d,每日1次,上述药品溶于生理盐水中进行灌胃。模型组和空白对照组通过灌胃给予相同体积的生理盐水,同样连续28 d,每日1次。
(1)斜板实验:在建模后灌胃第0 d(灌胃前1 d)、7 d、14 d、21 d、28 d,每组取5只大鼠置于25 °斜面上适应 1 min,之后逐渐增加斜板的角度。当大鼠可在一定角度坚持5 s且不滑落,则继续增加角度,直至无法在该斜板上坚持5 s。记录大鼠所能坚持的最大角度。每只测量3次,取平均值。
(2)在第28 d,将各组大鼠麻醉后摘眼球取血,静置1 h后在4 ℃,3500 r/min条件下离心15 min。取上清液按照ELISA试剂盒说明书进行血清中IL-1β、TNF-α、PGE-2的含量测定。
1.3.11 数据处理及分析
数据以平均值±标准差表示,试验设 3个平行,用Origin 8.0软件对分析数据作图,采用SPSS 19.0软件,对数据进行单因素方差分析。
2 结果与分析
2.1 胶原蛋白肽和硫酸软骨素的得率
干燥软骨的主要成分是蛋白质(71.74%)和碳水化合物(21.70%),其次为脂肪(0.24%)和灰分(6.32%),表明鸡胸软骨可用于分离胶原蛋白肽和硫酸软骨素。取50 g鸡胸软骨(以干重计),提取可得胶原蛋白肽34.28 g(以干重计),硫酸软骨素9.41 g(以干重计)。经计算,鸡胸软骨胶原蛋白肽的提取率为68.32%(以干重计)。硫酸软骨素的得率为18.82%(以干重计)。
2.2 鸡胸软骨水解物的表征分析
2.2.1 微观结构观察
通过扫描电镜对软骨水解物、胶原蛋白肽和硫酸软骨素样品微观结构进行观察,结果如图1所示,冻干后的软骨水解物样品为小片鳞片状,大小不均匀,表面光滑。胶原蛋白肽样品呈棒状分布,大小均匀,表面有凸起。硫酸软骨素样品呈薄片树叶状分布,大小均匀,表面不光滑。该结果与Zhou[19]等、Barkat[20]等研究结果一致。

图1 扫描电镜图Fig.1 Scanning electron microscope diagram
2.2.2 傅里叶红外光谱
由图2可知,软骨水解物样品中特征吸收带酰胺A带、酰胺B带、酰胺I带、酰胺II带和酰胺III带都能被检测到。根据 Muyonga[21]报道,酰胺 A带与N-H伸缩振动和氢键有关,软骨水解物样品的酰胺A带位于3363 cm-1波长处,表明N-H基团参与了氢键形成。酰胺B带位于2980 cm-1波长处,这是由于-CH2伸缩振动产生的。酰胺I带位于1658波长处,这是由于C=O键的伸缩振动引起的。酰胺II带位于1554cm-1波长处,这是由于N-H键的弯曲振动和C-H键的伸缩振动引起的。酰胺III带位于1253 cm-1波长处,通常由N-H弯曲振动和C=N伸缩振动有关[22]。与硫酸软骨素样品的红外图谱相比,软骨水解物图谱在1658 cm-1和1554 cm-1处出现了新的吸收峰[23],它们分别归属于酰胺I带和酰胺II带。
由图2可以看出,试验中所制得的硫酸软骨素样品与硫酸软骨素A标准品的红外光谱图基本一致。硫酸软骨素样品和硫酸软骨素 A标准品分别在 3350 cm-1和3371 cm-1处出现了一个较宽的吸收峰,表明组分中含有硫酸软骨素的羟基结构[24]。在2930 cm-1附近出现较弱的吸收峰,这与CH2或CH3的C-H伸缩振动有关。在1550 cm-1处的特征吸收峰表明样品中有羰基(-C=O-)和N-H键的存在,表明各组分中存在乙酰氨基结构。在1251 cm-1和1045 cm-1处的产生的吸收峰是由于S-O和-C-O-S的伸缩振动产生的。以上光谱特征与文献报道一致,周斯仪[25]等报道指出,A型CS(CSA)的硫酸基在C4位,产生的轴向伸缩振动峰在850 cm-1附近。王俊[24]等报道指出,850 cm-1的峰可以被认为软骨素-4-硫酸盐,820 cm-1的峰值表示软骨素-6-硫酸盐。本试验中硫酸软骨素样品的峰值在852 cm-1和827 cm-1处,表明样品主要由硫酸软骨素A组成。

图2 傅里叶红外光谱图Fig.2 Fourier infrared spectrum
2.2.3 氨基酸分析
通过氨基酸分析仪对软骨水解物和胶原蛋白肽样品进行分析,结果如表1所示,软骨水解物样品氨基酸含量与胶原蛋白肽样品差异性显著(p<0.05),且明显低于胶原蛋白肽样品。软骨水解物和胶原蛋白肽样品中氨基酸含量较高的为甘氨酸(Gly)、谷氨酸(Glu)、脯氨酸(Pro)、精氨酸(Arg)、丙氨酸(Ala)和天冬氨酸(Asp),其中胶原蛋白肽样品中甘氨酸含量最高,可达14.05 mg/g,其次为谷氨酸9.09 mg/g和脯氨酸7.44 mg/g。
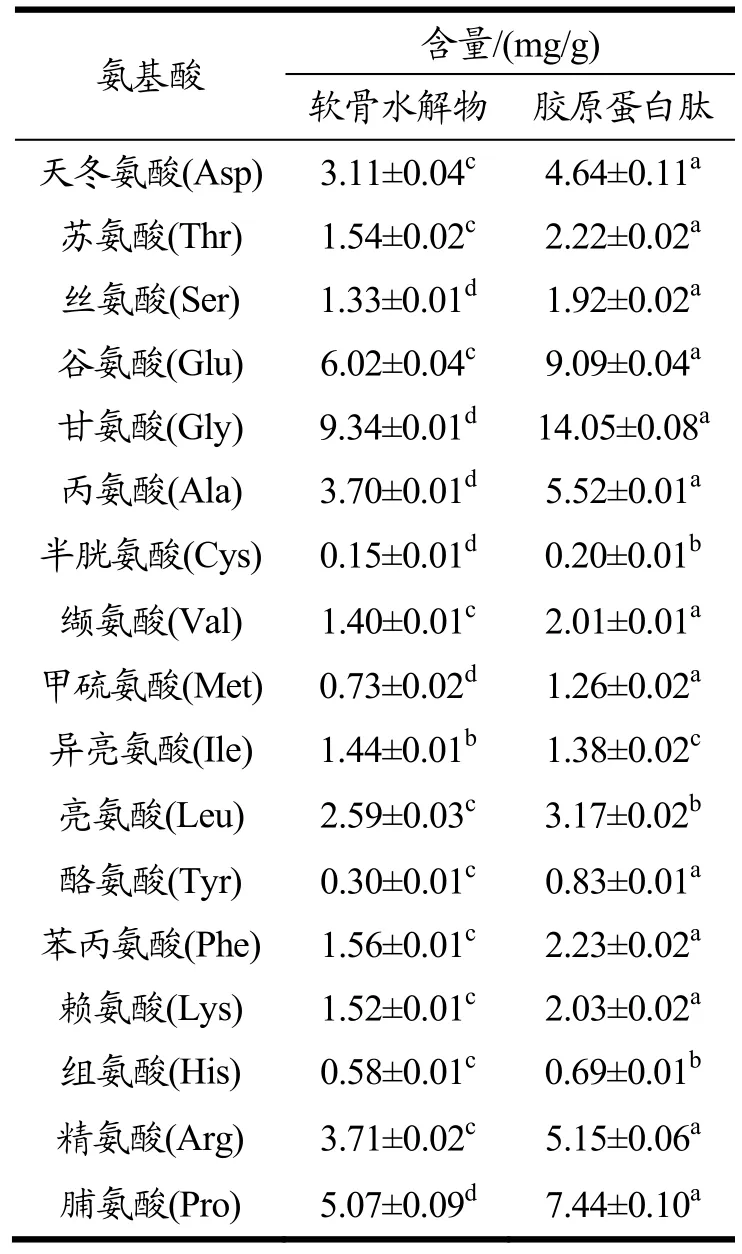
表1 软骨水解物和胶原蛋白肽样品的氨基酸组成Table 1 Amino acid composition of cartilage hydrolysates and collagen peptide samples
2.2.4 肽分子量分布
利用高效液相色谱测得软骨水解物和胶原蛋白肽样品的肽分子量分布。由表2可知,软骨水解物与胶原蛋白肽样品中肽分子量分布差异性显著,两种样品中肽分子量分布大多集中于1000 u以下,其中胶原蛋白肽样品中肽分子量在1000 u以下的占了92.38%,500 u以下的占73.85%,表明胶原蛋白肽样品中主要为小分子肽。张江涛[26]等研究发现相对分子质量的大小,直接决定肽的吸收速率,分子量1000 u以下的肽转运吸收存在独立的系统以及相应的载体,各种肽之间转运无竞争性与抑制性等特点。因此,这种寡肽具有很大的潜力作为生物活性肽使用。

表2 软骨水解物和胶原蛋白肽样品的肽分子量含量Table 2 Peptide content of cartilage hydrolysates and collagen peptide samples
2.2.5 胶原蛋白肽样品紫外光谱和圆二色光谱
胶原蛋白肽样品的紫外吸收光谱图显示其在 230 nm处有一个较高的吸收峰,这与肽链中含有羰基C=O、羧基COOH、酰胺基CONH2等发色基团有关[27]。有研究表明,波长在 185~245 nm称为远紫外区,245~320 nm称为近紫外区。远紫外区为蛋白质肽链的吸收峰,反映了主链的构象[28]。胶原蛋白肽样品的圆二色谱图显示其在197 nm处存在一个负峰,在223 nm处存在一个正峰,表明所提取的样品符合胶原蛋白肽的典型特征。

图3 胶原蛋白肽样品紫外光谱和圆二色光谱Fig.3 UV spectra and CD spectraof collagen peptide samples
2.2.6 硫酸软骨素样品琼脂糖凝胶电泳、二糖组成分析及蛋白含量测定
对提取的硫酸软骨素样品进行琼脂糖凝胶电泳分析,图4为硫酸皮肤素、肝素、硫酸软骨素A标准品和硫酸软骨素样品及其相对应的硫酸软骨素 ABC酶酶解产物的电泳图。由图可知硫酸软骨素 ABC酶可以水解硫酸软骨素样品,硫酸软骨素A标准品和硫酸皮肤素,但不能水解肝素。硫酸软骨素样品与硫酸软骨素A标准品迁移速率大致相同,且迁移速率大于硫酸皮肤素和肝素,初步说明试验所得样品为硫酸软骨素。

图4 琼脂糖凝胶电泳Fig.4 Agarose-gel electrophoresis

表4 各组大鼠斜板支持角度Table 4 Support angle of oblique plates in each group
通过高效液相色谱法对硫酸软骨素样品中二糖组成进行测定,图5为二糖标准品和硫酸软骨素样品的高效液相色谱图。由表3可知,硫酸软骨素样品主要由单硫酸基二糖 ΔDi4s和 ΔDi6s构成,非磺化二糖ΔDi0s含量为5.80%,二硫酸基二糖ΔDi4,6dis的含量为0.69%,其他二硫酸基二糖ΔDi2,6dis和ΔDi2,4dis和三硫酸基二糖ΔDi2,4,6tris含量极微,低于0.01%。样品中4s/6s值为4.03,这与傅里叶红外光谱结果一致,表明样品主要由硫酸软骨素A组成。这与文献研究结果一致,周斯仪[24]等研究表明,F4组分中不含ΔUA2s,且主要的二糖单位为ΔDi4s,表明组分F4主要为硫酸软骨素A。通过Lowery法获得蛋白质标准曲线方程为y=0.0004x+0.0624,R2=0.9915。经计算得到硫酸软骨素样品中蛋白含量为8.13%,表明硫酸软骨素样品的相对纯度为91.87%。
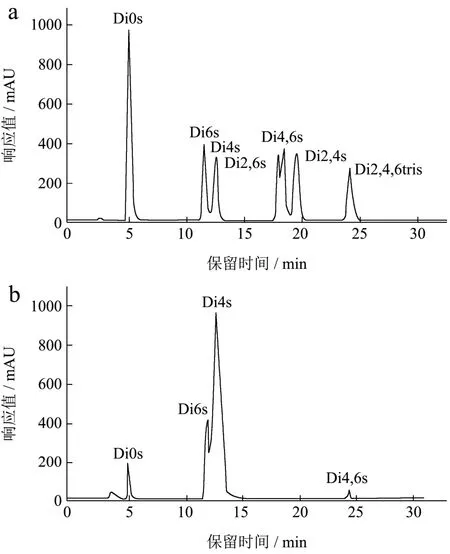
图5 二糖标准品和硫酸软骨素样品的高效液相色谱图Fig.5 HPLC chromatogram of disaccharide standard and chondroitin sulfate sample

表3 硫酸软骨素样品的二糖组成及蛋白含量Table 3 Composition and protein content of disaccharide in chondroitin sulfate sample
2.3 鸡胸软骨水解物的抗炎活性研究
2.3.1 斜板实验
与正常组大鼠斜板支持角度53.8 °相比,造模后各组大鼠的斜板支持角度显著降低,差异具有统计学意义(p<0.05)。使用鸡胸软骨水解物、胶原蛋白肽和硫酸软骨素进行干预后,大鼠斜板支持角度逐渐增大。表明使用鸡胸软骨水解物、胶原蛋白肽和硫酸软骨素可增加大鼠斜板支撑角度,减轻大鼠的关节炎症反应。Sun Y[33]等研究发现使用鲟鱼骨硫酸软骨素对骨性关节炎大鼠的下肢力量恢复有一定的治疗效果。在第28 d,鸡胸软骨水解物组大鼠斜板支持角度为49.0 °,明显大于胶原蛋白肽组45.8 °和硫酸软骨素组47.3 °,差异具有统计学意义(p<0.05)。硫酸软骨素组大鼠支持角度为47.3 °显著大于胶原蛋白肽组45.8 °,差异具有统计学意义(p<0.05)。这一结果表明,鸡胸软骨水解物中胶原蛋白肽与硫酸软骨素联用可能具有更好的抗炎效果,且鸡胸软骨水解物中硫酸软骨素对碘乙酸钠诱导的关节炎症具有较好的缓解作用。
2.3.2 大鼠TNF-α、IL-1β、PGE-2水平的比较
类风湿性关节炎症状的发生发展与机体炎症反应密切相关。TNF-α和IL-1β在关节炎的发生和发展中起重要作用,TNF-α和IL-1β和其他炎症因子有协同作用,可以抑制软骨细胞II型胶原的形成[29]。TNF-α是一种具有多种生物学效应的细胞因子,能够促使T细胞产生各种炎症因子,与关节炎和滑膜细胞的增殖密切相关[30]。IL-1β是一种重要的细胞因子,与滑膜炎和介导关节软骨破坏有关。PGE-2是细胞生长的重要调节因子,也是滑膜和关节疼痛的直接原因之一[31]。如表5所示,模型组大鼠TNF-α、IL-1β、PGE-2水平分别为39.90 pg/mL、22.38 pg/mL、89.41 pg/mL,均高于正常组,差异具有统计学意义(p<0.05);软骨水解物组、胶原蛋白肽组和硫酸软骨素组的关节炎模型大鼠中TNF-α、IL-1β、PGE-2水平出现明显的下调,均低于模型组,差异具有统计学意义(p<0.05)。说明使用软骨水解物、胶原蛋白肽和硫酸软骨素对关节炎模型大鼠进行干预,能够下调炎症因子TNF-α、IL-1β、PGE-2的水平,减轻关节炎大鼠炎症反应,从而起到抗炎作用。曹慧[32]等研究发现使用鸡胸软骨酶解产物能够降低炎症因子TNF-α水平,提示其治疗作用机理可能与抑制炎症因子的分泌有关。Sun Y[33]等研究发现使用鲟鱼骨硫酸软骨素能够抑制碘乙酸钠所致的大鼠关节炎中TNF-α、IL-1β、PGE-2的水平,减轻关节炎大鼠的疼痛反应。本文还发现软骨水解物组大鼠TNF-α、PGE-2水平分别为11.71 pg/mL、54.19 pg/mL,均低于胶原蛋白肽和硫酸软骨素组,差异具有统计学意义(p<0.05),说明鸡胸软骨水解物中胶原蛋白肽和硫酸软骨素可能起到协同抗炎作用。使用软骨水解物、胶原蛋白肽和硫酸软骨素对大鼠IL-1β水平影响差异不显著,考虑可能是由于胶原蛋白肽和硫酸软骨素的比例问题,具体原因需要进一步的探究。
表5 大鼠TNF-α、IL-1β、PGE-2水平的比较Table 5 Comparison of TNF-α, IL-1β and PGE-2 levels in rats of each group (±s)

表5 大鼠TNF-α、IL-1β、PGE-2水平的比较Table 5 Comparison of TNF-α, IL-1β and PGE-2 levels in rats of each group (±s)
组别 只数(n) TNF-α/(pg/mL) IL-1β/(pg/mL) PG-E2/(pg/mL)正常组 7 9.68±3.62c 11.16±4.42c 40.09±6.11d模型组 7 39.90±9.64a 22.38± 4.12a 89.41±8.86a鸡胸软骨水解物组 7 11.71±2.97c 17.75±2.07b 54.19±9.86c胶原蛋白肽组 7 21.42±4.47b 19.31±2.28ab 73.41±9.88b硫酸软骨素组 7 19.02±3.04b 16.97±1.51b 67.11±7.37b阳性组 7 10.14±2.44c 16.32±2.98b 48.96±7.15cd
3 结论
3.1 鸡胸软骨胶原蛋白肽和硫酸软骨素的得率分别为68.32%(以干重计)和18.82%(以干重计)。软骨水解物、胶原蛋白肽和硫酸软骨素扫描电镜结果显示三者的微观结构存在明显差异。傅里叶红外光谱结果表明,软骨水解物中特征吸收带酰胺A带、酰胺B带、酰胺I带、酰胺II带和酰胺III带都能被检测到,硫酸软骨素样品中含有软骨素-4-硫酸盐和软骨素-6-硫酸盐的典型特征,表明硫酸软骨素样品主要由硫酸软骨素A组成。氨基酸分析结果表明胶原蛋白肽中甘氨酸含量最高,可达14.05 mg/g,其次为谷氨酸(9.09 mg/g)和脯氨酸(7.44 mg/g)。紫外光谱图与圆二色性结果共同验证了所提取的样品具有胶原蛋白肽的典型特征,通过高效液相色谱测得胶原蛋白肽中肽分子量在1000 u以下的占92.38%,表明胶原蛋白肽样品中主要为小分子肽。琼脂糖凝胶电泳、二糖组成分析结果再次表明硫酸软骨素样品主要由硫酸软骨素A组成。通过 Lowery法计算得到所提取的硫酸软骨素样品相对纯度为91.87%。
3.2 鸡胸软骨水解物对大鼠骨关节炎具有调节作用,迄今还未有文献报道其抗炎活性。本研究以碘乙酸钠诱导的关节炎大鼠为模型,通过斜板实验结果显示,使用鸡胸软骨水解物、胶原蛋白肽和硫酸软骨素可增加大鼠斜板支撑角度,减轻大鼠的关节炎症反应。胶原蛋白肽和硫酸软骨素可能起到协同抗炎效果,且鸡胸软骨水解物中硫酸软骨素对碘乙酸钠诱导的关节炎症有较好的缓解作用。通过探讨对大鼠血清中TNF-α、IL-1β、PGE-2水平的比较,表明使用软骨水解物、胶原蛋白肽和硫酸软骨素对关节炎模型大鼠进行干预后,TNF-α、IL-1β、PGE-2水平出现明显的下调,说明使用软骨水解物、胶原蛋白肽和硫酸软骨素能够下调炎症因子TNF-α、IL-1β、PGE-2的水平,减轻关节炎大鼠炎症反应,从而起到抗炎作用,为进一步探究胶原蛋白肽和硫酸软骨素的协同抗炎效果提供理论依据。
