贝伐珠单抗对吉非替尼耐药非小细胞肺癌H1975的治疗作用
2021-09-02许明明王光锁李国锋
彭 彬,许明明,王光锁,李国锋
非小细胞肺癌(non-small cell lung cancer, NSCLC)是发病率和病死率最高的恶性肿瘤,男性高于女性,占男性恶性肿瘤首位,女性恶性肿瘤第2位[1]。NSCLC最有效治疗方法为手术切除,但超过50%患者在确诊时已处于癌症晚期,甚至已发生远处转移,不具备手术切除的临床条件,临床多以化疗、靶向治疗或免疫治疗为主。NSCLC传统化疗特异性差,且具有严重的毒副作用,临床应用局限。吉非替尼作为第一代EGFR酪氨酸激酶抑制剂(EGFR TKI),是最常见的治疗携带第19外显子缺失和(或)第21外显子错义突变(L858R)的分子靶向药物之一[2-3]。EGFR TKI结合EGFR受体激酶区阻断EGFR自磷酸化,抑制下游RAS/ERK和(或)PI3K/AKT等信号转导通路,逆转NSCLC进程;但绝大多数患者在接受EGFR TKIs治疗6~12个月后就会出现不同程度的耐药反应[4-5],因此,迫切需要开发新治疗方案克服EGFR TKIs耐药性。血管内皮生长因子/血管内皮生长因子受体(VEGF/VEGFR)信号通路异常激活被认为是肿瘤新生血管形成的重要因素[6-7]。贝伐珠单抗是人源化抗VEGF单克隆抗体,可通过阻断VEGF/VEGFR信号通路抑制肿瘤新生血管形成发挥抗肿瘤作用[8]。研究表明,EGFR与VEGF信号通路有密切关系[9-10]。当对EGFR-TKI出现耐药性时,VEGF依赖的信号可能是一种替代的生存途径[11]。EGFR TKI与贝伐珠单抗联合疗法可显著延长无进展生存期(PFS),降低脑转移发生率[12]。一线吉非替尼治疗失败后,二线铂类联合培美曲塞或贝伐珠单抗可能会改善患者PFS[13]。体外模型中的研究表明贝伐珠单抗还具有免疫调节作用[12],但其作用机制尚不清楚。本研究以吉非替尼耐药细胞系(NCI-H1975)为研究对象,评估吉非替尼+贝伐珠单抗联合治疗是否能够逆转NSCLC对吉非替尼耐药,旨在为吉非替尼联合贝伐珠单抗的临床应用提供参考。
1 材料与方法
1.1实验细胞及实验动物 实验细胞系NCI-H1975细胞系购买自中国医学院基础医学科学研究所细胞培养中心。SPF级5~6周龄雌性裸鼠24只,购自西普尔-必凯公司,实验动物许可证号:SCXK(京)2016-0006。自由进食水,12 h/12 h明暗周期,实验经深圳市人民医院伦理委员会审核。
1.2实验试剂及仪器 吉非替尼(上海蓓琅生物科技有限公司);贝伐珠单抗(Genentech);细胞培养试剂RPMI 1640、胎牛血清、胰酶和噻唑蓝(MTT)均购自Gibco;多聚甲醛(Sigma);兔源抗CD3和CD31抗体、HRP标记羊抗兔IgG二抗均购自Abcam公司;抗p-ERK抗体、抗p-AKT抗体和抗mTOR抗体均购自CST公司。仪器酶标仪(上海赫冠仪器有限公司)、游标卡尺(日本三丰)、正置显微镜和倒置显微镜(奥林巴斯);电泳系统和凝胶成像系统(Bio-Rad);细胞培养箱(上海向帆仪器有限公司)。
1.3方法
1.3.1吉非替尼耐药NCI-H1975细胞系构建:将NSCLC H1975细胞系在含有12 μmol/L吉非替尼的培养液中培养24 h,经RPMI 1640清洗去除死亡细胞,收集活性细胞在不含吉非替尼的培养基中继续培养,待细胞融合至80%,按比例加入吉非替尼至浓度12 μmol/L,继续培养24 h。重复上述操作,以5 μmol/L梯度增加吉非替尼浓度直到吉非替尼浓度达80 μmol/L。存活细胞即为NCI-H1975细胞系,继续在不含吉非替尼培养基中培养2周用作后续研究。方法参照Zhao等[1]报道。
1.3.2MTT检测:将NCI-H1975细胞系接种于96孔板中,每孔5×103个细胞,分别加入含有0、2.5、5、10、15、20和25 μmol/L吉非替尼的培养基,于5% CO2,37℃培养箱中培养72 h。沿孔壁缓慢加入MTT溶液,每孔20 μl,继续孵育3~4 h。2500×g离心10 min,吸弃上清,沿孔壁缓慢加入DMSO重悬细胞,每孔150 μl。最后于450 nm处测量吸光度值。亲代H1975细胞系同步处理用作对照,经拟合后计算药物对细胞的半数抑制浓度(IC50),耐药指数=耐药细胞IC50/亲本细胞IC50。
1.3.3NCI-H1975细胞荷瘤小鼠模型制作:将NCI-H1975细胞以每亳升2×107个的密度接种于裸鼠背部皮下,待肿瘤体积至约50 mm3时,以随机数字表法将荷瘤小鼠分为对照组、吉非替尼组、贝伐珠单抗组、联合组,每组6只。吉非替尼组给予吉非替尼50 mg/kg灌胃[14],1/d;贝伐珠单抗组给予贝伐珠单抗5 mg/kg,腹腔注射,2/d[15-16];联合组给予吉非替尼和贝伐珠单抗,剂量同前;对照组给予等量生理盐水。肿瘤生长情况于分组后第16天取材检测。肿瘤体积计算公式为:肿瘤体积=0.5×长径×短径2。
1.3.4小鼠肿瘤CD3和CD31检测:免疫组织化学染色实验结束时,钝性分离小鼠肿瘤,取其中一部分放入4%多聚甲醛中浸泡48 h后,经乙醇梯度脱水、二甲苯透明和石蜡包埋后,肿瘤组织经切片机(Leica)制作5 μm厚切片。CD3和CD31一抗的孵育浓度分别为1∶500和1∶1000,4℃孵育过夜,经磷酸盐缓冲液(PBS)清洗后,按比例加入HRP标记二抗(1∶2500)孵育1 h,最后经DAB显色。封片后随机选取3个视野量化CD3和CD31染色结果。CD3经手动计数阳性细胞数量;CD31经IPP(6.0版本)计算平均光密度值(IOD)。
1.3.5蛋白免疫印迹:分离肿瘤组织,迅速放入液氮中研磨,加入RIPA裂解后,采用BCA蛋白定量检测试剂盒检测蛋白含量,取50 μg蛋白上样检测p-ERK、p-AKT和mTOR含量。p-ERK抗体(1∶2000)、p-AKT抗体(1∶2500)、mTOR抗体(1∶2000)、β-actin抗体(1∶2000),4℃摇床上孵育过夜;次日经PBS清洗后按比例加入羊抗兔IgG二抗(1∶3000),室温孵育45 min;显色,凝胶成像系统成像。相对蛋白含量=目标蛋白WB带灰度值/β-actin WB带灰度值。

2 结果
2.1吉非替尼对H1975和NCI-H1975细胞形态和细胞活力的影响 H1975细胞呈长梭状,NCI-H1975细胞胞体变小,呈椭圆形或圆形。细胞倍增时间分别为H1975细胞(29.5±2.0)h、NCI-H1975细胞(48.6±2.7)h,NCI-H1975细胞倍增时间长于H1975细胞,差异有统计学意义(P<0.01)。H1975细胞IC50为6.93 μmol/L,NCI-H1975细胞IC50为13.34 μmol/L,耐药指数为1.92。见图1、2。

图1 H1975和NCI-H1975细胞形态特征
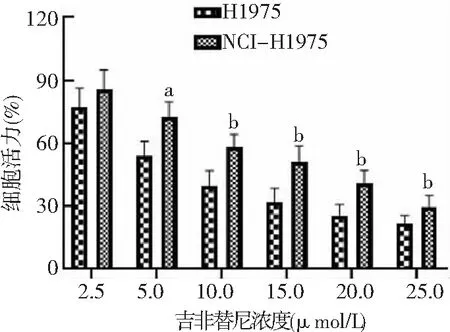
图2 不同浓度吉非替尼处理后H1975和NCI-H1975细胞活力比较
2.2贝伐珠单抗抑制NCI-H1975荷瘤小鼠肿瘤情况 治疗16 d后,各组小鼠肿瘤体积分别为对照组(1575.9±341.2)mm3,吉非替尼组(1328.7±518.6)mm3、贝伐珠单抗组(918.7±421.0)mm3、联合组(498.8±186.0)mm3。对照组与吉非替尼组小鼠肿瘤体积比较差异无统计学意义(P>0.05)。与对照组和吉非替尼组比较,贝伐珠单抗和联合组组荷瘤小鼠肿瘤体积增长速度显著减慢,且联合组生长速度较贝伐珠单抗组更缓慢,差异有统计学意义(P<0.01,P<0.05)。见图3。

图3 贝伐珠单抗抑制NCI-H1975荷瘤小鼠肿瘤生长情况
2.3贝伐珠单抗治疗促进小鼠肿瘤组织内CD3+细胞浸润 4组小鼠肿瘤组织内CD3+细胞数量分别为对照组(9.6±2.9)个、吉非替尼组(16.2±3.7)个、贝伐珠单抗组(28.6±4.2)个、联合组(66.0±5.8)个。与对照组比较,吉非替尼组、贝伐珠单抗组、联合组小鼠肿瘤组织内CD3+细胞浸润数均增多,且联合组高于贝伐珠单抗组和吉非替尼组,贝伐珠单抗组高于吉非替尼组,差异均有统计学意义(P<0.05,P<0.01)。见图4、5。

图4 贝伐珠单抗促进荷瘤小鼠肿瘤瘤体内CD3+细胞浸润情况(SP×400)

图5 4组荷瘤小鼠肿瘤瘤体内CD3+细胞数量比较
2.4贝伐珠单抗治疗减少肿瘤组织CD31+内皮细胞数量 4组小鼠肿瘤组织CD31+内皮细胞平均光密度值分别为对照组0.96±0.26、吉非替尼组0.76±0.11、贝伐珠单抗组0.46±0.11、联合组0.25±0.08。与对照组比较,吉非替尼组、贝伐珠单抗组、联合组小鼠肿瘤组织内CD31+内皮细胞平均光密度值均显著降低;且贝伐珠单抗组和联合组CD31+内皮细胞平均光密度值均低于吉非替尼组,联合组低于贝伐珠单抗组,差异有统计学意义(P<0.01,P<0.05)。见图6、7。

图6 贝伐珠单抗抑制肿瘤组织内CD31+细胞增殖情况(SP×400)

图7 4组荷瘤小鼠肿瘤瘤体内CD31+细胞平均光密度值比较
2.5贝伐珠单抗对肿瘤组织AKT和ERK信号通路相关蛋白表达的影响 对照组与吉非替尼组p-ERK和p-AKT表达水平比较差异无统计学意义(P>0.05),吉非替尼组mTOR表达水平显著低于对照组(P<0.05)。与对照组和吉非替尼组比较,贝伐珠单抗组和联合组p-ERK、p-AKT和mTOR表达水平均显著降低,且联合组显著低于贝伐珠单抗组,差异有统计学意义(P<0.01)。见图8。
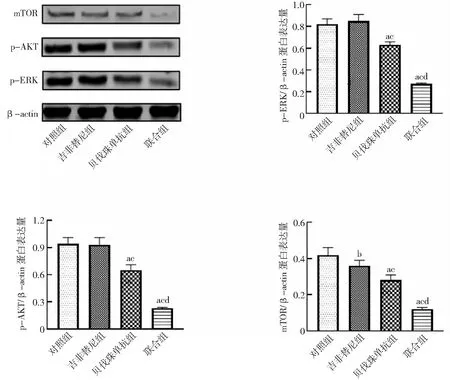
图8 贝伐珠单抗治疗抑制AKT和ERK信号通路
3 讨论
吉非替尼是NSCLC一线治疗药物之一,PFS约11个月[17],但在连续治疗6~9个月后,因继发性EGFR-T790突变或MET扩增,多数NSCLC会出现获得性耐药[18]。针对临床“吉非替尼耐药”难题,已有多项研究尝试吉非替尼+贝伐珠单抗联合治疗,该方案具有增强药效克服吉非替尼耐药的潜力,但具体作用机制尚不清楚[12-13]。
在NSCLC中,EGFR和VEGF信号通路存在交叉[19],EGFR可通过ERK/PI3K调控VEGF表达水平,携带EGFR突变的肿瘤中VEGF表达水平通常会高于野生型[20-21]。本研究采用靶向VEGF的单克隆抗体药物,特异性阻断VEGF/VEGFR通路,以提高耐药NSCLC对吉非替尼的响应;体外诱导NCI-H1975细胞系并构建荷瘤小鼠;结果显示,吉非替尼对荷瘤小鼠基本无治疗效果;可部分恢复NCI-H1975细胞系对吉非替尼的敏感性,表现为荷瘤小鼠肿瘤体积减小、血管内CD31+密度值降低、瘤体内CD3+细胞数量增加和磷酸化AKT/mTOR/ERK蛋白水平降低。AKT/mTOR和ERK信号参与Warburg效应,其通过提高糖酵解率,产生乳酸为肿瘤细胞提供能量[22]。因此,联合治疗阻断了NCI-H1975细胞的能量供应,从而抑制了肿瘤生长。另外,AKT/mTOR和ERK通路也是EGFR和VEGFR信号通路“共通”的下游信号通路,因此,联合治疗也实现了“双重”阻断[14]。在携带EGFR突变的NSCLC患者中,吉非替尼+贝伐珠单抗联合治疗客观缓解率13%,疾病控制率88%,显著延长患者PFS[23],但作用机制鲜有报告。本研究为吉非替尼+贝伐珠单抗联合治疗吉非替尼耐药的NSCLC提供了理论依据。不足在于H1975为NSCLC细胞系,是经体外筛选而来,若可通过从EGFR-TKI耐药患者中提取原代细胞开展此类实验将使结果更具有说服力。
吉非替尼+贝伐珠单抗联合治疗可抑制NCI-H1975细胞荷瘤小鼠的肿瘤生长,减少肿瘤内部新生血管生成,增加瘤内淋巴细胞浸润,在一定程度上克服NSCLC的吉非替尼耐药。贝伐珠单抗可能是EGFR-TKI耐药后NSCLC患者的一种治疗手段,其作用机制有待临床试验的进一步证明。
