益生菌对断奶鼠消化酶活力、肠道运动性及粘膜形态的影响
2021-09-02郝婧宇段素芳司徒文佑洪维鍊刘伟贤赵子夫霍贵成
刘 飞,郝婧宇,段素芳,3,司徒文佑,3,洪维鍊,刘伟贤,赵子夫, ,霍贵成
(1.东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江哈尔滨 150030;2.内蒙古乳业技术研究院有限责任公司,内蒙古呼和浩特 010110;3.内蒙古伊利实业集团股份有限公司,伊利母婴营养研究院,北京 100022)
人体内定殖的微生物,其多样性和数量会随着机体年龄的增长而逐渐增加,在机体2~3岁时几乎成型。成人肠道中(主要是结肠)定殖着数量级约为1014的细菌,人消化道内容物中的菌群密度在空肠和回肠近端约为103~104CFU/g,回肠远端约为107~108CFU/g,升结肠约为1011~1012CFU/g[1],编码的基因数量是人体的100~150倍[2]。一旦肠道菌群失调,肠道内环境紊乱,益生菌减少,人体便开始出现各种不适症状甚至引发疾病[3]。定殖于消化道的细菌与寄主及其它肠道微生物一起在免疫调节[4]和通过肠-肝-脑轴对整个机体健康产生作用[5]。与成人相比,儿童属于特殊群体,由于其肠道发育不完善,肠道蠕动也比成人弱,腹肌的推动力更是不足,这些原因造成食物通过比较慢,很容易引起消化不良。而且,儿童肠道菌群易受多种外部因素的影响而导致紊乱,从而阻碍其肠道功能的正常发挥,导致营养不良甚至引发其他疾病[6]。
益生菌、维生素和植物提取物成为保健食品工业的三大新宠。以乳杆菌和双歧杆菌为代表的益生菌用于维护肠道健康,已有较长的安全使用历史,益生菌已形成成熟的市场,全球大约有5亿消费者,欧洲的年增长率达到15%。中国益生菌市场的增长更为迅猛,2016年市值为500亿元,据估计到2022年将达到1450亿元。益生菌又称微生态调节剂、生态制品、活菌制剂,是指一类通过添加到食品或药品中,能够起到调节肠道微生态平衡,从而对人或动物产生有利影响的微生物[7]。益生菌已成为最受消费者欢迎的膳食补充剂[8],以健康改善和疾病预防的形式被健康人日常消费。健康者使用益生菌的益处有缓解肠胃综合征[9],强化免疫[10],预防感染性疾病[11],预防心脏及代谢性疾病[12],通过肠-肝-脑轴改善精神及行为健康以及促进健康[13−14],促进消化道蠕动[15]。益生菌在人肠粘膜的定殖,有明显的个体、部位和菌株特异性,可将个体分为“易定殖”和“抗定殖”两类,并可对粘膜菌群组成/功能和人肠道基因表达产生短暂而不同的影响[7]。
因此,理想的肠道菌群被认为是健康的前提,应用益生菌和益生素维护肠道健康已成为消费者的首选,但是,益生菌作为保健品,短期或持续使用对健康儿童肠道健康及消化功能的影响有待进一步探讨。乳双歧杆菌BL-99和副干酪乳杆菌ET-22是分别从健康婴儿和成人肠道中分离得到的具有自主知识产权的益生菌株,课题组前期研究表明它们能够调节宿主肠道菌群,具有通便和促进消化的功效。而分离自酸面团的植物乳杆菌299v是世界上有大量文献报道的益生菌之一,临床实验证明其可促进胃肠道健康,特别是有研究表明母鼠食用植物乳杆菌299v能够改善哺乳期大鼠幼鼠肠道屏障功能,促进肠道生长和功能[16]。因此,本研究分别以断奶大鼠和小鼠为模型动物,以植物乳杆菌299v作为对照菌株,评估乳双歧杆菌BL-99和副干酪乳杆菌ET-22对成长期动物小肠运动性、消化酶活力和肠道组织形态的影响,为其将来在儿童食品中的应用奠定理论基础。
1 材料与方法
1.1 材料与仪器
SPF级雄性ICR小鼠 体重10~12 g,共24只,实验动物质量合格证编号为11400700362050,北京维通利华实验动物技术有限公司;SPF级雄性SD大鼠 体重40~60 g,共35只,实验动物质量合格证编号为11400700362051,北京维通利华实验动物技术有限公司;大、小鼠维持饲料,实验动物质量合格证编号为11002900042472北京科奥协力饲料有限公司;植物乳杆菌299v分离自酸面团(DSM 9843)德国微生物和细胞培养物保藏中心;乳双歧杆菌BL-99分离自健康婴儿肠道(CGMCC No.15650)、副干酪乳杆菌ET-22分离自健康成人肠道(CGMCC No.15077) 中国普通微生物菌种保藏中心;胃蛋白酶、胰蛋白酶、淀粉酶检测试剂盒 南京建成生物工程研究所;复方地芬诺酯 河南鼎昌药业有限公司;活性炭粉 天津市方正试剂厂;阿拉伯树胶 天津市致远化学试剂有限公司;其他试剂 均为分析纯。
GL3202i-1SCN型电子天平 德国赛多利斯集团;7080全自动生化分析仪 日本日立公司;MiniH100金属浴 美国赛洛捷克公司;UV-1500C紫外可见光分光光度计 上海美析仪器有限公司;1-14K小型台式高速冷冻离心机 德国Sigma公司;E600光学倒置显微镜 日本尼康公司。
1.2 实验方法
1.2.1 动物饲养分组 参考保健食品功能评价方法(2020年版)(征求意见稿)中的“十六、有助于消化功能检验方法”中的方法[17],采用小鼠进行小肠运动试验,其余指标的检测均采用大鼠进行试验。24只断奶雄性SD大鼠和35只断奶雄性ICR小鼠饲养于屏障系统动物房中,温度22℃,湿度10%~60%,12 h明暗交替照明,由大小鼠维持饲料喂养,适应性喂养1周,自由饮水。适应性喂养1周后,将大鼠随机分成4组,每组6只,包括空白对照组、乳双歧杆菌处理组、副干酪乳杆菌组和植物乳杆菌处理组;将小鼠随机分成5组,每组7只,包括空白对照组、模型组、乳双歧杆菌处理组、副干酪乳杆菌组和植物乳杆菌处理组。大鼠和小鼠的3个益生菌处理组分别一次性灌胃1×109CFU/d的乳双歧杆菌、副干酪乳杆菌副干酪亚种和植物乳杆菌。在每天灌胃之前分别将事先按照各益生菌处理组的种类和含量分装好的菌粉溶解在8 mL生理盐水中备用。每只实验动物每天灌胃0.5 mL,分别连续给予35 d(大鼠)和28 d(小鼠),空白对照组和模型组在整个实验周期内则灌胃0.5 mL生理盐水,其中模型组仅在小肠运动试验当天灌胃复方地芬诺酯来抑制小鼠小肠运动性。称量大鼠初始体重和实验结束时体重,并计算整个实验结束时大鼠的体重增重。
1.2.2 小肠运动试验 小鼠灌胃28 d后进行小肠运动实验,实验前禁食16 h,自由饮水。于测定当天按照1.2.1动物饲养分组中的灌胃量各处理组小鼠最后一次给予受试样品,30 min后模型组和各样品组均灌胃复方地芬诺酯(0.025%),空白对照组灌胃同体积蒸馏水。给复方地芬诺酯30 min后,各组灌胃墨汁(5%活性炭粉、10%阿拉伯树胶的水溶液)。给墨汁25 min后颈椎脱臼处死小鼠,打开腹腔,剪取上端至幽门,下端至回盲部的肠管。将小肠拉成直线,测量肠管长度作为“小肠总长度”,从幽门至炭末前沿的距离作为“炭末在肠内推进距离”,按下式计算炭末推进百分率[17]。

1.2.3 大鼠剖检取样 大鼠灌胃35 d后进行剖检取样,禁食24 h,自由饮水,采用乙醚麻醉后剖检全部大鼠取样。包括血样、胃液、十二指肠液、空肠、回肠、肝脏、肾脏、脾脏、胰腺。
1.2.4 消化酶类的检测 参照戴颖[18]的检测方法,采用南京建成生物工程研究所生产的试剂盒分别检测大鼠胃液中胃蛋白酶的活性、十二指肠液中胰蛋白酶和淀粉酶的活性,按照试剂盒的说明书进行操作。
1.2.5 血液指标的检测 将血液样品在4℃下静置1 h,随后3000×g离心15 min,上清液即为血清[18]。随后采用全自动生化分析仪分别检测大鼠血清中总蛋白、白蛋白、球蛋白、总胆固醇、甘油三脂、高密度脂蛋白和低密度脂蛋白的含量。
1.2.6 脏器称重和脏器系数的计算 分别称量大鼠肝脏、肾脏、脾脏、胰腺的质量,随后分别计算每只大鼠的脏器系数[19]。

式中,脏器重量分别为大鼠完整肝脏、肾脏、脾脏、胰腺的质量,体重为对应大鼠处死前的空腹体质量,单位均为g。
1.2.7 组织形态学指标的检测 取大鼠空肠和回肠进行石蜡切片及HE染色后采用软件Image-Pro Plus 6.0进行形态观察,包括肠绒毛高度(VH)、隐窝深度(CD)、绒毛高度/隐窝深度(V/C)值、肠壁厚度[20]。
1.3 数据处理
2 结果与分析
2.1 益生菌对小鼠肠道运动性的影响
益生菌对小鼠肠道运动性的影响见图1。模型组应用复方地芬诺酯人为减慢肠运动,由图1可知,同模型组相比灌胃3种益生菌均能显著提高小鼠肠道的墨汁推进率,同模型组相比乳双歧杆菌、副干酪乳杆菌和植物乳杆菌分别将墨汁推进率提高了11.48%、12.12%和21.47%。
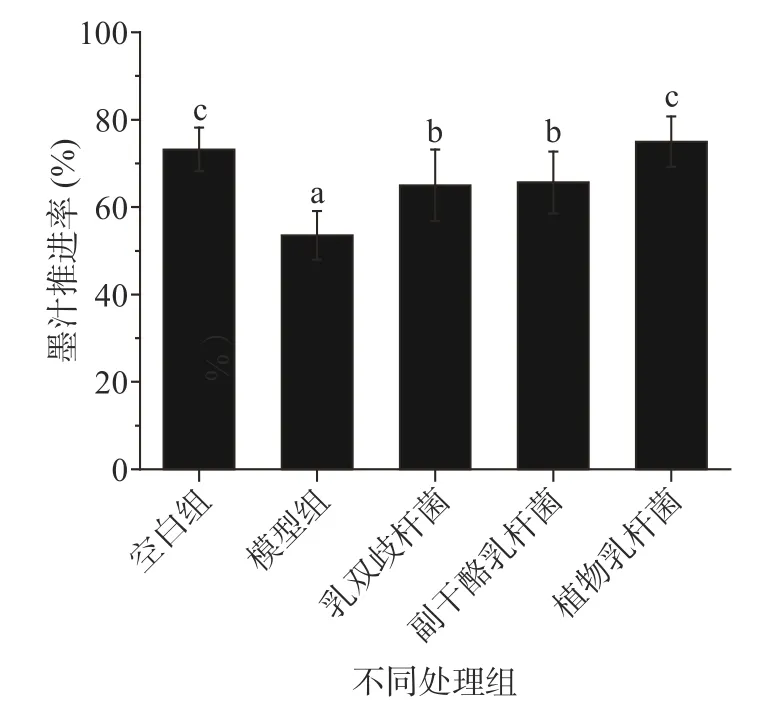
图1 益生菌对小鼠肠道运动性的影响Fig.1 Effects of probiotics on intestinal motility of mice
复方地芬诺酯能够直接作用于肠平滑肌,通过抑制肠黏膜感受器,消除局部黏膜的蠕动反射而减弱蠕动,从而延长肠内容物与肠黏膜的接触,使得肠内水分吸收,大便变干,常被用于便秘小鼠模型的造模[21−22]。本研究结果表明乳双歧杆菌、副干酪乳杆菌和植物乳杆菌都能不同程度地加快药物性肠蠕动减慢的运动性,显著提高小鼠的肠道运动性。
2.2 益生菌对大鼠体重的影响
益生菌对大鼠体重的影响见图2,在初始体重没有显著差异的前提下,经5周益生菌灌胃处理,试验结束时的大鼠的最终体重和体重增重有不同程度的变化,其中灌胃乳双歧杆菌和植物乳杆菌大鼠的体重和体重增重均显著高于对照组(P<0.05),同对照组相比体重分别增加了10.61%和6.00%,体重增重分别增加了13.33%和8.52%。小鼠实验结果表明乳双歧杆菌BL-99和植物乳杆菌299v均能促进宿主肠道运动性,此外,后续实验结果表明它们还可以提高肠液中胰蛋白酶的活力,增加宿主动物空肠和回肠绒毛高度和隐窝深度的比值来改善宿主动物的消化吸收功能。因此,灌胃双歧杆菌BL-99和植物乳杆菌299v大鼠的体重增重均明显高于对照组可能是由于以上这些因素引起的。

图2 益生菌对大鼠体重的影响Fig.2 Effects of probiotics on intestinal body weight of rats
2.3 益生菌对大鼠消化酶类活性的影响
胃肠道中消化酶活性的高低可直接反映动物对食物的消化能力,本研究中益生菌对大鼠胃蛋白酶、胰蛋白酶和淀粉酶活力的影响见图3。
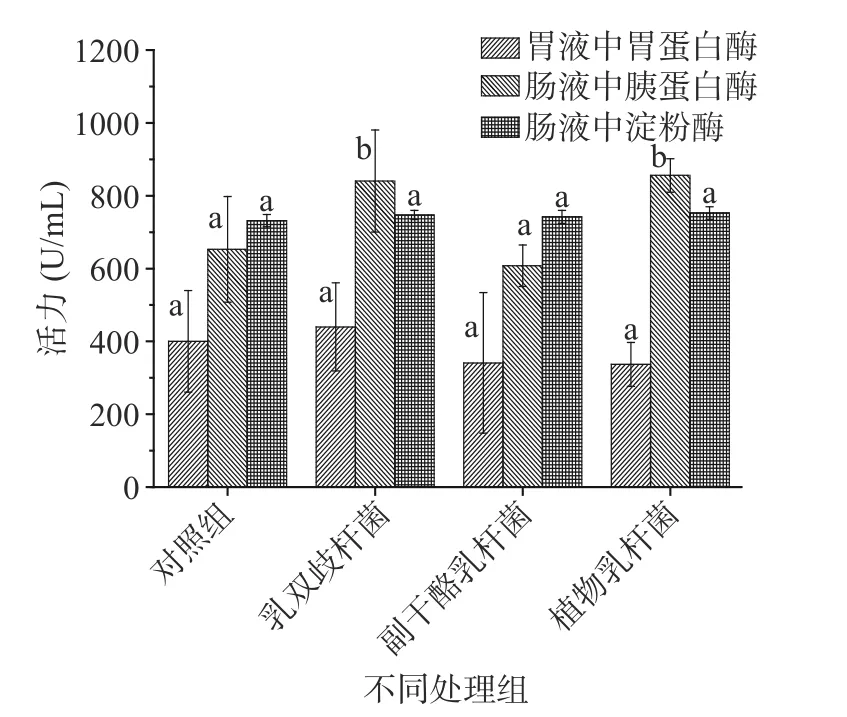
图3 益生菌对大鼠胃蛋白酶、胰蛋白酶和淀粉酶活力的影响Fig.3 Effectsof probioticson pepsin activity,intestinal trypsin activity and amylase activity of rats
由图3可知,与对照组比,益生菌对大鼠胃蛋白酶活性和肠液中淀粉酶活力没有显著影响,但是益生菌对大鼠肠液胰蛋白酶的活性具有显著影响。灌胃乳双歧杆菌和植物乳杆菌都能够显著增加大鼠肠液中胰蛋白酶活力(P<0.05),同对照组相比分别提高了28.76%和31.13%。然而副干酪乳杆菌干预却对大鼠肠道胰蛋白酶活性没有影响,这表明益生菌对宿主肠道胰蛋白酶活性的影响具有菌株特异性,但是其中具体的作用机制和影响因素仍需进一步研究。
2.4 益生菌对大鼠血液生化指标的影响
2.4.1 益生菌对大鼠血清蛋白含量的影响 血清总蛋白可分为白蛋白和球蛋白两类,血清蛋白具有维持血液正常胶体渗透压和p H、运输多种代谢物、调节被运输物质的生理作用和解除其毒性、免疫作用以及营养作用等多种功能。在非病理状态下,血清总蛋白高表明营养状态较好,对于白蛋白典型反映了机体代谢功能和营养状态,球蛋白一般处于正常状态,极度感染可能出现偏高。益生菌对大鼠血清中蛋白含量的影响见图4。
图4表明除单独灌胃乳双歧杆菌之外,灌胃其它益生菌都能够明显提高大鼠血清中总蛋白和球蛋白的含量,同对照组相比,灌胃副干酪乳杆菌分别将总蛋白和球蛋白的含量提高了6.84%和8.80%,灌胃植物乳杆菌分别将总蛋白和球蛋白的含量提高了6.82%和9.12%。此外,灌胃副干酪乳杆菌还能够提高大鼠血清中白蛋白的含量,同对照组相比提高了5.42%。

图4 益生菌对大鼠血清总蛋白、白蛋白及球蛋白含量的影响Fig.4 Effectsof probioticson serum total protein,albumin and globulin of rats
2.4.2 益生菌对大鼠血脂指标的影响 血脂四项包括:总胆固醇、甘油三脂、高密度脂蛋白和低密度脂蛋白,反映了体内的脂类代谢。益生菌对大鼠血脂指标的影响见图5。
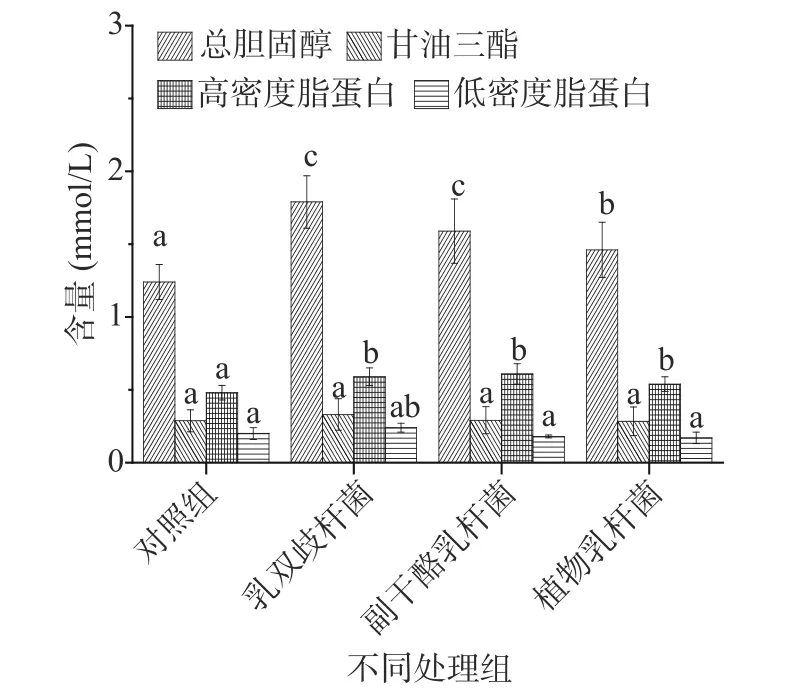
图5 益生菌对大鼠血清脂类代谢物含量的影响Fig.5 Effects of probiotics on serum lipid metabolites of rats
由图5可知,与对照组比,灌胃益生菌均会显著(P<0.05)升高大鼠血清中总胆固醇和高密度脂蛋白的含量,其中灌胃乳双歧杆菌分别将总胆固醇和高密度脂蛋白的含量提高了44.35%和22.92%,灌胃副干酪乳杆菌分别将总胆固醇和高密度脂蛋白的含量提高了28.23%和27.08%,灌胃植物乳杆菌分别将总胆固醇和高密度脂蛋白的含量提高了17.74%和12.50%;对甘油三酯和低密度脂蛋白含量的影响均不显著。目前关于益生性乳酸菌对宿主血脂指标影响的研究基本上都是利用高脂动物模型以及超重和肥胖人群,结果一般也是益生菌干预能够降低宿主血清中血脂指数中总胆固醇、甘油三酯和低密度脂蛋白此三项指标中部分指标或全部指标的含量[23−24]。但是罕见利用正常动物模型,尤其是生长期大鼠模型的相关研究。而本研究表明益生菌干预能够显著(P<0.05)提高生长期正常大鼠血清中的总胆固醇和高密度脂蛋白的含量,对低密度脂蛋白和甘油三酯含量并没有显著影响。胆固醇是动物体内最丰富的固醇类化合物,它参与细胞膜的形成,还是合成胆汁酸、维生素D以及甾体激素的原料,激素可参与机体内各种物质的代谢,包括糖、蛋白质、脂肪和矿物质等代谢,对维持机体正常生理功能十分重要。而高密度脂蛋白对血管有保护作用,通常被人们称为“优质胆固醇”[25−26]。因此对于正常动物机体大多数组织来说,保证胆固醇的供给,维持其代谢平衡是十分重要的。结合本研究之前的体重增重结果分析,益生菌可能在维持成长期大鼠的胆固醇代谢平衡的前提下,通过提高宿主血清中胆固醇的含量来调节激素的合成,从而提高机体内的物质代谢水平,促进体重增重。
2.5 益生菌对大鼠脏器重量和脏器系数的影响
脏器系数又称脏体比,是实验动物某脏器的重量与其体重的比值。正常情况下,实验动物各脏器与体重的比值比较恒定。动物染毒后,受损脏器重量可发生变化,导致脏器系数也发生相应变化。益生菌对大鼠肝脏、脾脏、肾脏和胰腺重量和脏器系数的影响见表1。
由表1可知,同对照组相比,灌胃益生菌对大鼠肝脏、脾脏、肾脏和胰腺重量和脏器系数没有显著影响(P>0.05)。一般来说,脏器系数增大,表示脏器充血、水肿或增生肥大等;脏器系数减小,表示脏器萎缩及其他退行性改变。本研究中并没有观察到相关现象,这说明植物乳杆菌299v、乳双歧杆菌BL-99和副干酪乳杆菌ET-22对宿主脏器没有不良影响。

表1 益生菌对大鼠肝脏、脾脏、肾脏和胰腺重量和脏器系数的影响Table 1 Effects of probiotics on weight and organ coefficient of liver,spleen, kidney and pancreas of rats
2.6 益生菌对大鼠肠道组织形态的影响
2.6.1 益生菌对大鼠肠道形态指标的影响 小肠绒毛高度和隐窝深度是反应吸收功能的重要指标,一般来说,绒毛高度越大,隐窝深度越浅,吸收能力越强。研究表明益生菌能够促进宿主的吸收功能,本研究中益生菌灌服四周后大鼠空肠和回肠组织形态学指标检测结果如图6所示。由图6可知,益生菌处理不同程度地对空肠和回肠的组织形态学都有积极的作用。同对照组相比,灌胃益生菌对空肠绒毛高度没有显著影响,灌胃乳双歧杆菌能够显著降低空肠隐窝深度同时增加空肠肠壁厚度,其中空肠隐窝深度降低了17.14%,空肠肠壁厚度增加了21.49%;灌胃乳双歧杆菌、副干酪乳杆菌和植物乳杆菌都能够显著增加肠绒毛高度/隐窝深度(Villus height to Crypt depth,V/C)值,其中V/C值分别增加了30.65%、19.35%和21.94%。益生菌处理对回肠组织形态学的影响较突出,同对照组相比,灌胃乳双歧杆菌和植物乳杆菌明显增加了回肠绒毛高度,回肠绒毛高度分别增加了13.40%和12.41%;所有益生菌处理组均能够显著(P<0.05)降低回肠隐窝深度同时显著增加V/C值和回肠肠壁厚度,其中乳双歧杆菌、副干酪乳杆菌和植物乳杆菌组的回肠隐窝深度分别降低了13.28%、18.29%和18.20%,回肠V/C值分别增加了30.21%、31.25%和35.94%,回肠肠壁厚度分别增加了21.14%、22.35%和27.51%。

图6 益生菌对大鼠空肠和回肠肠道形态指标的影响Fig.6 Effectsof different probiotics on intestinal morphology index of jejunum and ileum
2.6.2 益生菌对大鼠肠道组织学切片的影响 小肠绒毛需要拥有正常的结构才能使营养物质被充分消化吸收,因此本研究采用日本尼康倒置显微镜(10×10倍)对5周龄大鼠空肠和回肠肠道组织切片进行观察,其组织结构变化情况分别见图7和图8。
由图7可知,对照组空肠绒毛较细且长度比益生菌组略短一些,隐窝深度也比益生菌组更大一些,肠壁厚度差异并不明显。在所有益生菌组中,乳双歧杆菌组的空肠绒毛较长且排列整齐,隐窝也较浅且肠壁较厚一些。

图7 益生菌对大鼠空肠绒毛、隐窝和肠壁的影响(100×)Fig.7 Effects of different probiotics on villus,crypt and intestinal wall of jejunum(100×)
由图8可知,对照组回肠绒毛的长度明显比乳酸双歧杆菌组和植物乳杆菌组短一些,而且对照组隐窝深度明显大于所有益生菌处理组,同时肠壁的厚度也较所有益生菌处理组薄。在所有益生菌组中植物乳杆菌组回肠绒毛较长且排列整齐、隐窝较浅、肠壁较厚一些。
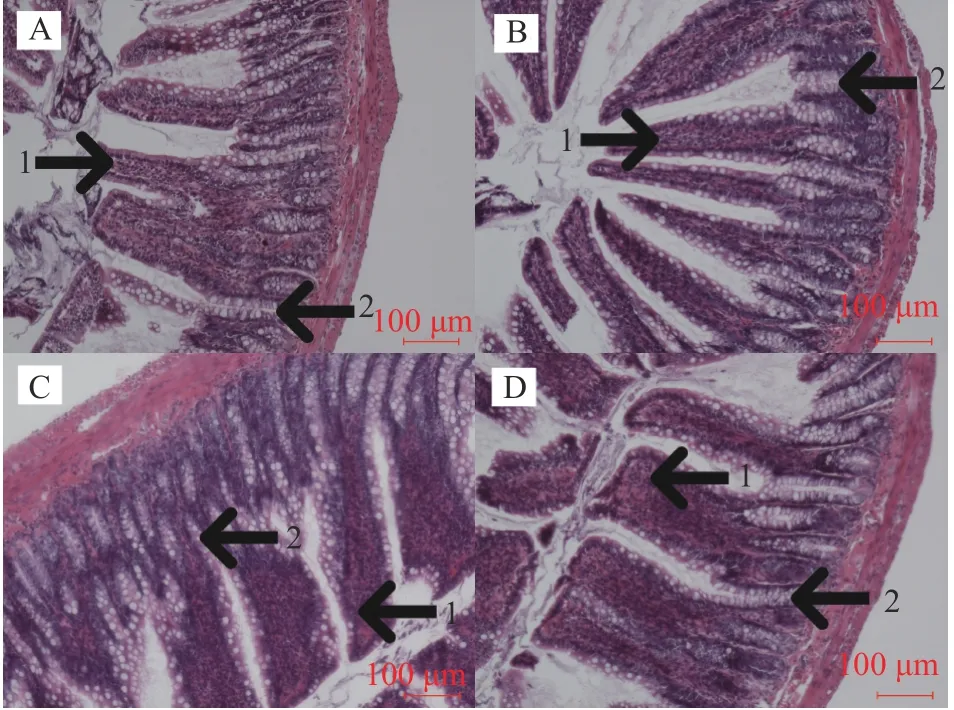
图8 益生菌对大鼠回肠绒毛、隐窝和肠壁厚度的影响(100×)Fig.8 Effectsof different probioticson villus,crypt and intestinal wall of ileum(100×)
3 讨论与结论
胃肠运动性减弱与许多人类疾病有关,包括糖尿病、帕金森病、自闭症和便秘型肠易激综合征,它们的一个典型特征就是肠道菌群失调和有益微生物丧失[27]。肠道共生菌群对肠道感觉神经元和肌间神经元的正常兴奋性至关重要。研究表明无菌小鼠空肠和回肠肌间神经丛密度显著降低,胃肠道肌肉收缩幅度明显降低[28]。在无菌动物模型中,各种益生菌已被证明能调节肠道运动[29],而且同一益生菌种的不同菌株在肠道动力方面表现出明显的特异性差异[30−31]。Chandrasekharan等[15]研究表明,每天给小鼠灌胃1次鼠李糖乳杆菌GG(LGG),1周后可显著增加排便频率、减少肠道转运时间,而且离体实验表明LGG还能够显著增强回肠肌肉收缩,其进一步研究发现LGG可刺激肠肌间神经丛产生活性氧,从而诱导肠肌间神经元中MAPK 1磷酸化水平升高,促进神经分化、增加肠神经肽生成,增加神经元中乙酰胆碱转移酶的表达来提高小鼠肠道的运动性,LGG可能通过这些途径来增加患者的胃肠动力。本研究也发现乳双歧杆菌BL-99、副干酪乳杆菌ET-22和植物乳杆菌299v都能够显著提高小鼠的肠道运动性。
目前对于乳酸菌的益生功能的研究已相当成熟,但对其促进宿主消化吸收功效的研究仍相对较少。乳酸菌具有维持宿主机体肠道菌群平衡、分解食物中碳水化合物和蛋白质、合成维生素、增强机体免疫力等作用[18]。也有一些关于乳酸菌改善宿主生长性能的研究报道。张琳[32]发现微胶囊化的粪肠球菌能够显著提高肉鸡的生长性能,郭元晟[33]也发现发酵乳酸杆菌F-6和干酪乳酸杆菌Zhang能够改善肉鸡的生产性能,而曹玮娜等[34]则发现在饮水中添加107CFU/mL植物乳杆菌能够能提高獭兔的生长性能。此外,黄玉军[35]等发现灌胃鼠李糖乳杆菌grx10和发酵乳杆菌f5能够显著提高高脂大鼠的肠道淀粉酶活力,但是对肠道胰蛋白活力无显著影响。本研究却发现灌胃乳双歧杆菌、植物乳杆菌都能够显著提高大鼠的体重增重,同时提高大鼠肠液中胰蛋白酶活力而对肠液淀粉酶和胃液中胃蛋白酶活力无显著影响。这可能是益生菌能够增加大鼠肠道菌群中产蛋白酶相关菌属的丰度,从而提高胰蛋白酶的活力,进而改善宿主的生长性能,后续仍然需要进一步采用高通量测序技术对宿主肠道菌群进行分析来确认。
绒毛和隐窝作为小肠绒毛的基本结构,是衡量小肠消化吸收的重要指标。绒毛高度影响小肠吸收面积,绒毛高度越高,越有利于机体对肠内营养物质的吸收。隐窝深度反映细胞的生成率,隐窝基部可以不断的分化细胞,以此弥补绒毛上皮的正常脱落。隐窝细胞生长速率同时影响着肠绒毛的生长与萎缩,隐窝越浅说明细胞成熟率越高,吸收能力越强[20]。V/C值则综合反映小肠的功能状态,比值下降,表示消化吸收功能下降;比值上升,则表示消化吸收能力增强[36]。本研究发现灌胃益生菌会显著提高大鼠空肠和回肠绒毛高度和隐窝深度的比值,从而提高大鼠的消化吸收功能,其中特别是乳双歧杆菌组和植物乳杆菌组分别具有最大的空肠和回肠V/C值及肠壁厚度。
综上所述,本研究发现乳双歧杆菌BL-99和植物乳杆菌299v能够通过促进宿主肠道运动性,提高肠液中胰蛋白酶的活力,增加宿主动物空肠和回肠绒毛高度和隐窝深度的比值来改善宿主动物的消化吸收功能,在提高宿主动物的体重增重的同时并不会带来不良影响。因此,基于乳双歧杆菌BL-99和植物乳杆菌299v良好的益生特性,将来可将它们应用于制作发酵乳制品、益生菌制剂甚至医药等领域,从而促进人类健康。
