新型纳米金负载还原氧化石墨烯的简易合成及其抗肿瘤效应
2021-09-02王萌刘智影张碧玉江宁黄河周如悦周涛黄庆利
王萌,刘智影,张碧玉,江宁,黄河,周如悦,周涛,黄庆利*
(1.徐州医科大学 公共实验研究中心,江苏徐州 221004;2.徐州医科大学 医学技术学院,江苏徐州 221004;3.徐州医科大学 临床学院,江苏徐州 221004)
手术切除、化学药物治疗及放射治疗是目前临床治疗癌症的经典方法[1],其中化学药物治疗在术前和术后都广泛应用。化疗是经口服、静脉或者体腔给药,通过血液循环起到抗肿瘤作用,但化疗药物不具有特定的抗肿瘤作用,对正常细胞也具有伤害性,因此化疗后的病人常伴有各种副作用病症[2]。减轻化疗药物的毒副作用,已成为科研人员的研究热点。纳米粒疗法是一种新兴的抗癌手段,由治疗药物(如小分子化合物、多肽、蛋白质以及核酸等)和与之能组装成纳米粒子的类脂或高分子聚合物组成[3]。
碳纳米材料因其相对低的生物毒性被广泛应用于药物传递系统和肿瘤治疗系统[4],其中石墨烯材料由于其独特的结构特点和丰富的理化性质备受研究者关注[5-6]。已有文献报道,未经任何修饰的石墨烯对巨噬细胞有明显的毒性,但是当其使用双端羧基聚乙二醇(-HOOC-PEG-COOH-)修饰后,石墨烯的毒性有了大幅度的降低[7]。所以对于石墨烯进行表面修饰增加其生物相容性是非常必要的。偶联剂3-氨丙基三乙氧基硅烷(APTES/APS)[8]解决了石墨烯与其他物质相连的问题,APS 易水解,放出乙醇,生成相应的硅醇缩合物,由于具有碱性,通用性极强,分子中的C-NH2键内氨基可与酸、羧酸酯、醛、酮、卤代烃、酰胺和腈等多种物质进行反应。
同时,对于大多数肿瘤的药物传递系统和治疗系统,药物不能很好地传输到特定的肿瘤位置,一直是制约其疗效的一个重要原因。经纳米粒包裹后,药物的生物相容性和对肿瘤细胞的靶向性均可得到改善,药代动力学以及药效学特性得到改善和增强[9]。近年来,靶向治疗越来越受到人们关注,合适的分子修饰以便能够很好地识别肿瘤细胞是解决药物靶向的关键,例如叶酸介导的抗肿瘤药物可以靶向性地作用于叶酸受体过表达的肿瘤细胞,从而减少传统化疗药物的副作用,提高药效[10]。
本研究旨在以氧化石墨烯为载体,通过分子修饰改善其生物相容性和靶向性,以获得性能优良的新型肿瘤药物传递系统和治疗系统。
1 材料与方法
1.1 试剂与仪器
1-乙基-3-(3-二甲基氨丙基)-碳化二亚胺(EDC)、 N-羟基琥珀酰亚胺(NHS)、叶酸(FA)、过硫酸铵(APS)、聚乙二醇( PEG)和氯金酸,国药集团化学试剂有限公司;石墨烯分散液(2 mg/mL),南京先丰纳米科技有限公司;1640 培养基,江苏凯基生物技术股份公司;胎牛血清,CLARK Bioscience公司;CCK-8 试剂盒,微科曼得生物工程有限公司。
Synergy2 型多功能微孔板检测仪,美国BioTek公司;RCT 20L 基本型磁力恒温搅拌器,德国IKA公司;UV1902 紫外可见分光光度计,翱艺仪器(上海)有限公司;HFsafe-1500 型生物安全柜,香港力康生物医疗科技控股有限公司;HF100 型二氧化碳培养箱,香港力康生物医疗科技控股有限公司;FEI Tecnai 12 型透射电子显微镜,美国FEI 公司。
1.2 实验方法
1.2.1 GO@Au@PEG@FA@DOX 制备
将10 mg HAuCl4、10 mL GO(1 mg/mL)分散液和3 mL 酒精放入30 mL 水热釜中混合均匀,100 ℃反应6 h;反应结束后取出,高速离心弃上清,加水洗涤3 次;将GO@Au 冻干,称取重量,配制成1 mg/mL的溶液;取10 mL GO@Au、0.3 mL APS 和20 mg PEG,避光搅拌12 h;取出GO@Au@PEG 溶液,高速离心弃上清,加水洗涤3 次,烘干,称取重量,配制成1 mg/mL的溶液;取8 mL GO@Au@PEG 溶液,加入4 mL 利用EDC 和NHS 活化后的叶酸,避光搅拌12 h;将GO@Au@PEG@FA 放入透析袋,用PBS 溶液透析6 h,透析3 次。
1.2.2 透射电子显微镜(TEM)测试
分别将样本配制成低浓度溶液,滴在铜网上,自然晾干后,透射电子显微镜镜下观察并采集图像。
1.2.3 细胞培养与处理
分别复苏卵巢癌细胞SKOV3 和人乳腺癌细胞MD231,待细胞长到80%左右时用胰酶消化,制成单细胞悬液,入96 孔板,每孔100 μL,放入5%CO2、37 ℃培养箱过夜,次日加药处理或激光照射。
1.2.4 细胞光照
按照上述方法培养细胞铺板并加药处理,在细胞和药物共培养3 h 后,从培养箱中取出96 孔板,每个孔用808 nm 的近红外光照3 min。
1.2.5 细胞凋亡检测
CCK8培养基配制:取100 μL CCK8加入900 μL无血清培养基中。
药物和光照处理后的细胞,PBS 洗涤3 次,每孔中加入100 μL 稀释好的CCK8 溶液,入培养箱中孵育30 min,后用酶标仪检测溶液吸光值,并进行数据分析。
1.2.6 统计学分析
实验数据以均数±标准差表示,采用SPSS16.0软件进行统计学分析。细胞生存曲线数据采用Student'sT检验进行评估,P<0.05 差异有统计学意义。
2 结果与分析
2.1 Au 均匀分布在GO 表面
为了表征所得材料的形貌,利用透射电子显微镜对材料进行观察。透射电镜结果表明,通过水热反应Au 纳米粒子均匀负载到了GO 的片层结构上,放大后可以看到Au 的直径15 ~20 nm(图1);当APS的量分别为0.1 mL、0.3 mL 和0.5 mL 时,Au 纳米粒子负载到GO 片层的量并未发生较大改变(图2);为了进一步验证Au 是否负载到GO 表面,利用紫外-可见光谱(UV-vis)对材料进行检测,发现GO-APSAu 在波长530 nm 处出现波峰(图3),说明Au 成功负载到GO 表面;且当APS 的量分别为0.1 mL、0.3 mL 和0.5 mL 时,GO@APS@Au 在波长530 nm 处均出现波峰(图4a),说明Au 是否负载到GO 表面与APS 相关性较小;然而Au 是否负载到GO 表面与Au的量有关,UV-vis 图谱显示仅在HAuCl4为10 mg 时,GO-APS-Au 在波长530 nm 处出现波峰(图4b),说明HAuCl4为10 mg 时Au 能够负载到GO 表面。

图1 0.3 mLAPS 和10 mgAu 电镜图像
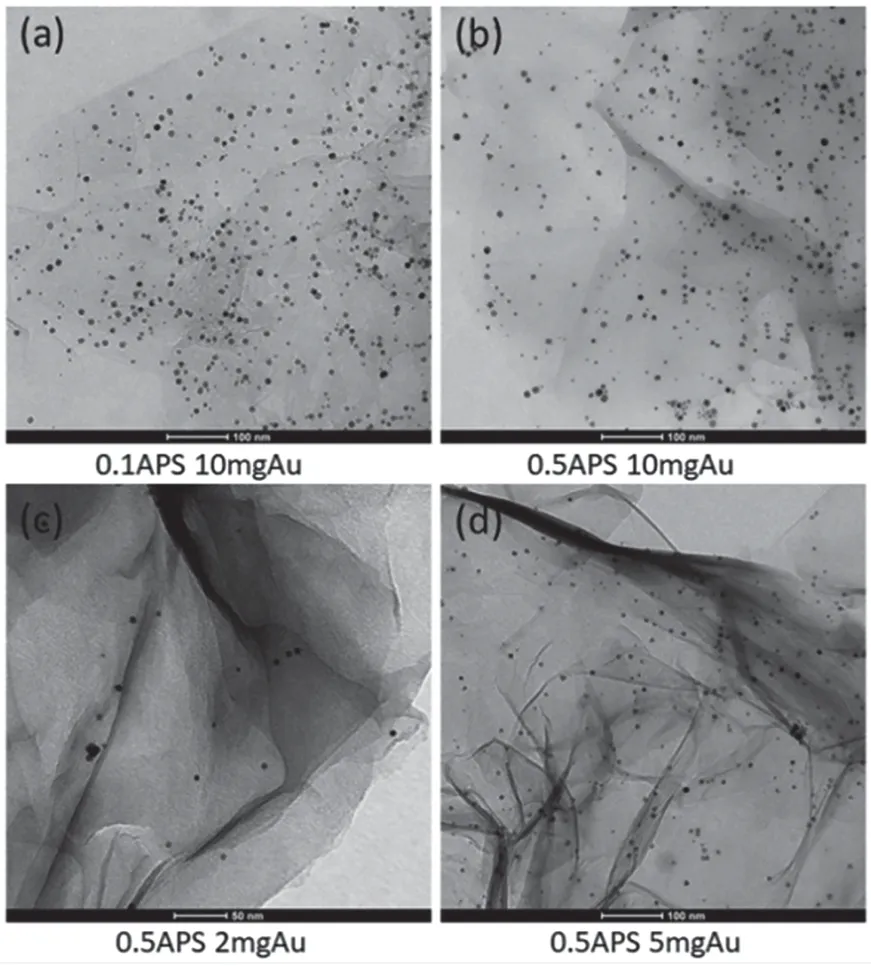
图2 不同APS 和Au 添加量的材料电镜图像
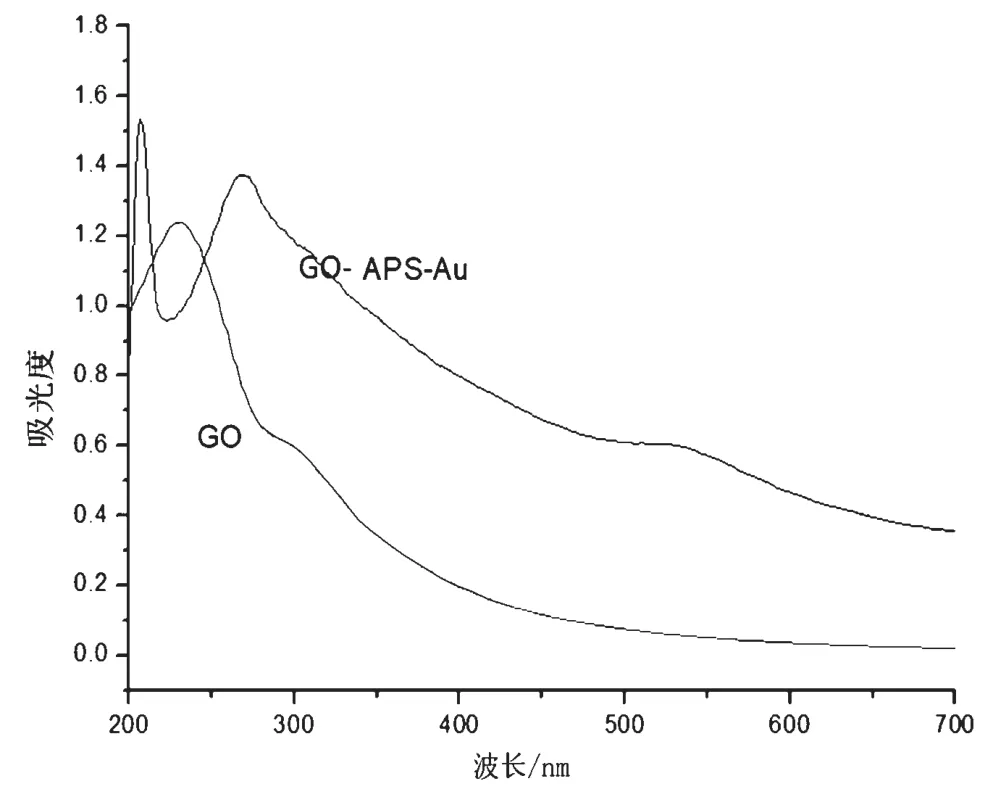
图3 GO 和rGO@APS@Au 的紫外光谱
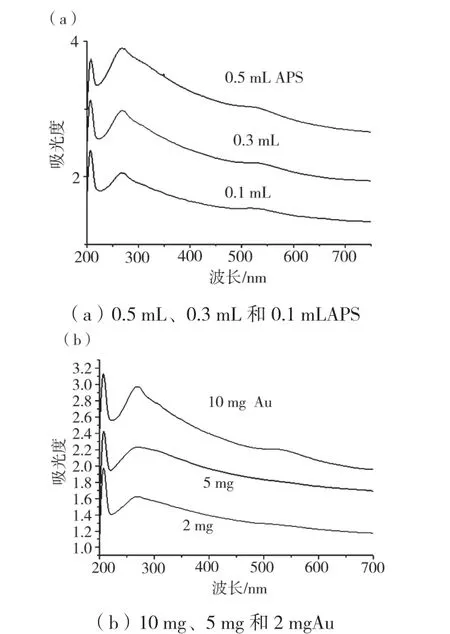
图4 不同APS 和Au 添加量的材料紫外-可见光谱图
2.2 GO@Au@PEG@FA 具有良好的光热效应
为了研究GO@Au 的光热性能,分别测定了H2O、GO、GO@Au、GO@Au@PEG 和GO@Au@PEG@FA在功率为2 W/cm2、波长为808 nm 的近红外光下的升温曲线,如图5 所示。从图中看出GO@Au、GO@Au@PEG 和GO@Au@PEG@FA 在5 min 内升高的温度明显高于H2O 和GO,并且加入PEG 和FA 后,对材料光热效应的影响并不大,说明所合成材料可以应用于光热治疗。
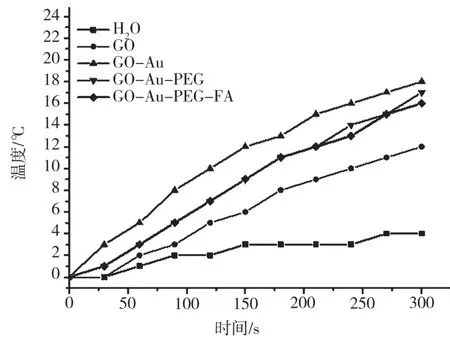
图5 不同材料的光热转换曲线图
2.3 PEG 和FA 提高了材料与细胞的生物相容性
CCK8 结 果 示,PEG 与FA 修 饰 到APS 后,APS@PEG@FA 组对SKOV3 细胞存活率较APS 组有所恢复(图6),说明PEG 和FA 提高了材料与细胞的生物相容性;利用不同浓度的APS@PEG@FA 分别处理卵巢癌细胞SKOV3(图7a)和人乳腺癌细胞MD231(图7b),发现APS@PEG@FA 具有一定的细胞毒性,但在10 μg/mL 浓度的时候,细胞生存率达到80%(图7)。
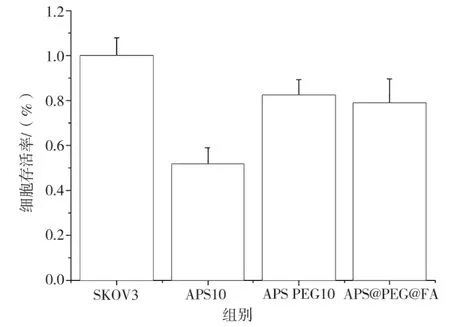
图6 CCK8 检测不同纳米材料对SKOV3 细胞生存率的影响图
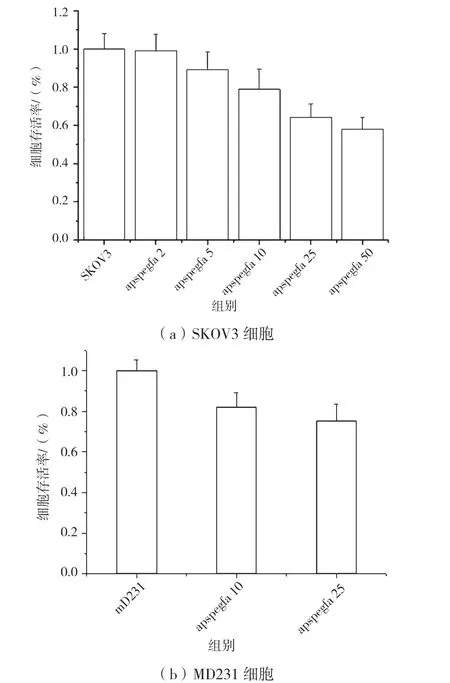
图7 CCK8 检测不同浓度的纳米材料对SKOV3 细胞(a)和MD231细胞(b)生存率的影响图
2.4 GO@Au@PEG@FA 具有较好的化疗及光热疗效
利用所得纳米材料GO@Au@PEG@FA 分别对SKOV3 细胞和MD231 细胞进行化疗和光热疗联合治疗,CCK8 结果显示:GO@Au@PEG@FA 与近红外光光照的联合治疗组较对照组和单一化疗组或光热组,细胞存活率显著降低(图8),说明联合治疗效果要优于单一化疗效果。
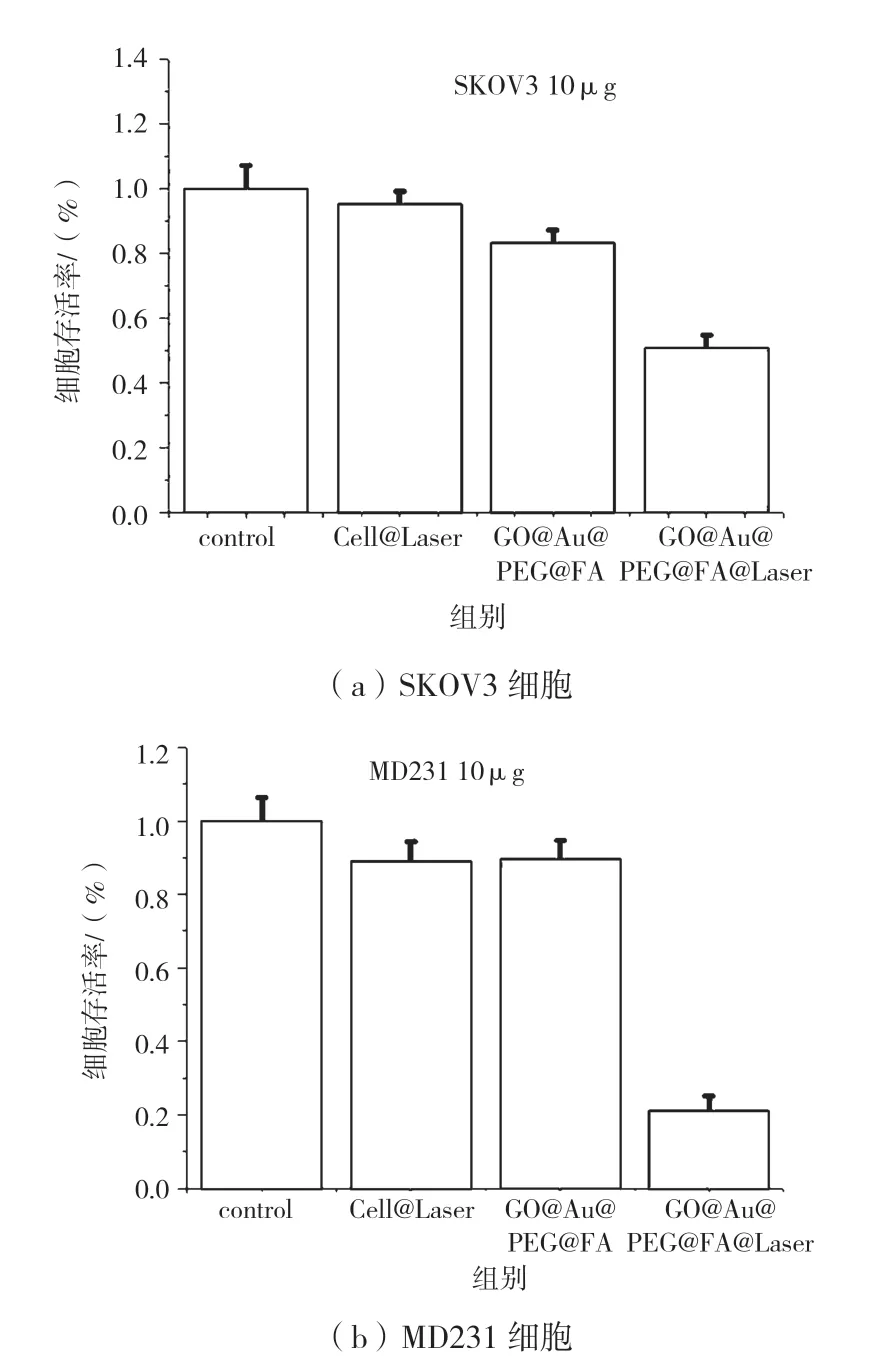
图8 用10 μg/mLGO@Au@PEG@FA 孵育后,在激光照射和无激光照射下CCK8 检测对于(a)SKOV3 细胞和(b)MD231 细胞生存率图
3 结论与讨论
纳米技术在生物医药领域的发展催生了一系列纳米光热材料[11],这些材料不仅具有良好的生物相容性,也具有一定的光热效应。光热治疗是指一些对光有强吸收的物质在激光照射下,将光能转化为热能从而杀死癌细胞的治疗方法[12]。光热疗的材料包括无机和有机两类,其中有机材料合成步骤烦琐,因此近年来以金基纳米材料为代表的无机光热疗材料受到越来越多人的关注[13]。
本实验成功制备了金颗粒复合石墨烯纳米材料GO@Au@PEG@FA,经PEG 和FA 修饰后,增加了生物相容性及靶向性,同时又兼备光热转化性能,是一种很有前途的靶向抗癌药物载体。本实验只研究了该载药体系对肿瘤细胞的治疗作用,后续需对其载药之后的治疗效果进行评价。
