超薄g-C3N4吸附性能的研究
2021-09-02何小苗江吉周李紫嫣
何小苗,吴 晶,江吉周,*,李紫嫣,邹 菁*
(1.武汉工程大学环境生态与生物工程学院/化学与环境工程学院,武汉 430205;2.湖北省地质实验测试中心自然资源部稀土稀有稀散矿产重点实验室,武汉 430034)
21世纪以来,在染料工业快速发展的同时,每年都会有大量的的染料会随着废水排到大自然中,如何处理染料废水是全人类面临的迫切需要解决的问题.在很低质量浓度时,染料就能对生态环境以及人类健康造成很大的伤害,并且,由于其毒性大且性质稳定,常规的生物处理(如活性污泥和厌氧消化)无法对其产生有效处理[1].在染料废水中,合成染料是最主要的污染物,其中绝大部分是偶氮染料,约占50%,其中最典型是的刚果红(CR)[2].另外,罗丹明B (RhB)是一种具有鲜桃红色的人工合成染料,被广泛用作纺织、制革、造纸、生物染色等方面,其废水色度高、难降解等特点,被怀疑是致癌物质[3].因此,如何处理染料废水、保护我们赖以生存的水资源成了当今世界面临的重大问题.如今,常见的染料废水处理方法有光催化氧化法、混凝法、吸附法、溶剂萃取法、分子膜法等[4-8].由于吸附法具有操作简便、高效、吸附剂可再生等优点,它被普遍认为是将这些染料从水中去除的最有效方法之一[9].
g-C3N4是氮化碳中性质最为稳定的同素异形体,其结构与石墨类似.在g-C3N4晶体结构中,C、N原子均为sp2杂化,以σ键连接成六边形结构,通过pz轨道上的孤对电子形成一个类似于苯环结构的大π键,组成一个高度离域的共轭体系.层间由环C3N3或环C6N7构成[10-12].g-C3N4由地球上含量极高的C、N两元素组成,原材料获取十分简单,是一种价格低廉的非金属半导体材料.近年来,g-C3N4作为一种新型的高活性的可见光光催化剂,广泛的应用于光催化、吸附、降解等领域[13-15].其化学结构非常稳定,光学带隙能约为2.7 eV.一般来说,因其比表面积较小,块状的g-C3N4催化或吸附性能较差,无论是作为光催化剂还是作为吸附剂,都存在较大的局限性[16].因此,需要对制得的g-C3N4进行改性.常见的改性方式有:原子掺杂、构建异质结、形貌调控等[17-19].在形貌调控中,比较常见的方法是剥离,主要包括超声剥离、热氧化剥离、气相剥离、酸碱刻蚀、机械剥离等[20-24].通过剥离g-C3N4块体材料可以得到不同层数、不同尺寸的薄层g-C3N4.相比于块体材料而言,薄层g-C3N4的比表面积增大,电子和空穴对的传输速率相应增大,降低了电子—空穴复合几率,极大地提高了g-C3N4的催化活性.比表面积的显著增大,也增加了材料单位面积上的有效活性位点数,进而提高了其吸附污染物的能力[25].
通过热聚合法,由三聚氰胺制备了块体g-C3N4,并使用热剥离法对块体材料进行了改性,使其片层尺寸变小,由此得到了一次剥离g-C3N4和二次剥离g-C3N4产物.通过透射电子显微镜(TEM)、原子力显微镜(AFM)、X射线晶体衍射仪(XRD)、比表面积测定仪(BET)、紫外可见漫反射光谱(DRS)等现代分析测试技术对其形貌、组分和结构进行了表征分析;探索了温度、pH、起始浓度、吸附时间等因素对RhB和CR的吸附性能影响,揭示了其相应的吸附等温线方程和吸附动力学模型.
1 实验内容
1.1 超薄g-C3N4的制备
称取适量三聚氰胺于坩埚中,置于马弗炉中,以5 ℃·min-1的升温速度加热至550 ℃,保温4 h,自然冷却至室温,得到淡黄色块体g-C3N4.取适量块体g-C3N4置入30 mL坩埚中,加5 mL超纯水超声1 h,放入120 ℃的鼓风干燥箱中干燥2 h,取出后将样品研磨均匀;然后置于马弗炉中,以10 ℃·min-1的升温速度加热至550 ℃,保温4 h,自然冷却后得到的产物标识为一次剥离g-C3N4;重复上述步骤,得到的产物标识为二次剥离g-C3N4.
1.2 RhB溶液标准曲线的绘制
分别配制2 mg·L-1、4 mg·L-1、6 mg·L-1、8 mg·L-1、10 mg·L-1的 RhB溶液,用紫外可见分光光度计测定其吸光度,并绘制出标准曲线,如图1所示.通过线性拟合,得出了其线性回归方程A=0.17927c0+0.03183 (A为吸光度,c0为RhB的浓度),相关系数R2为0.995 94.
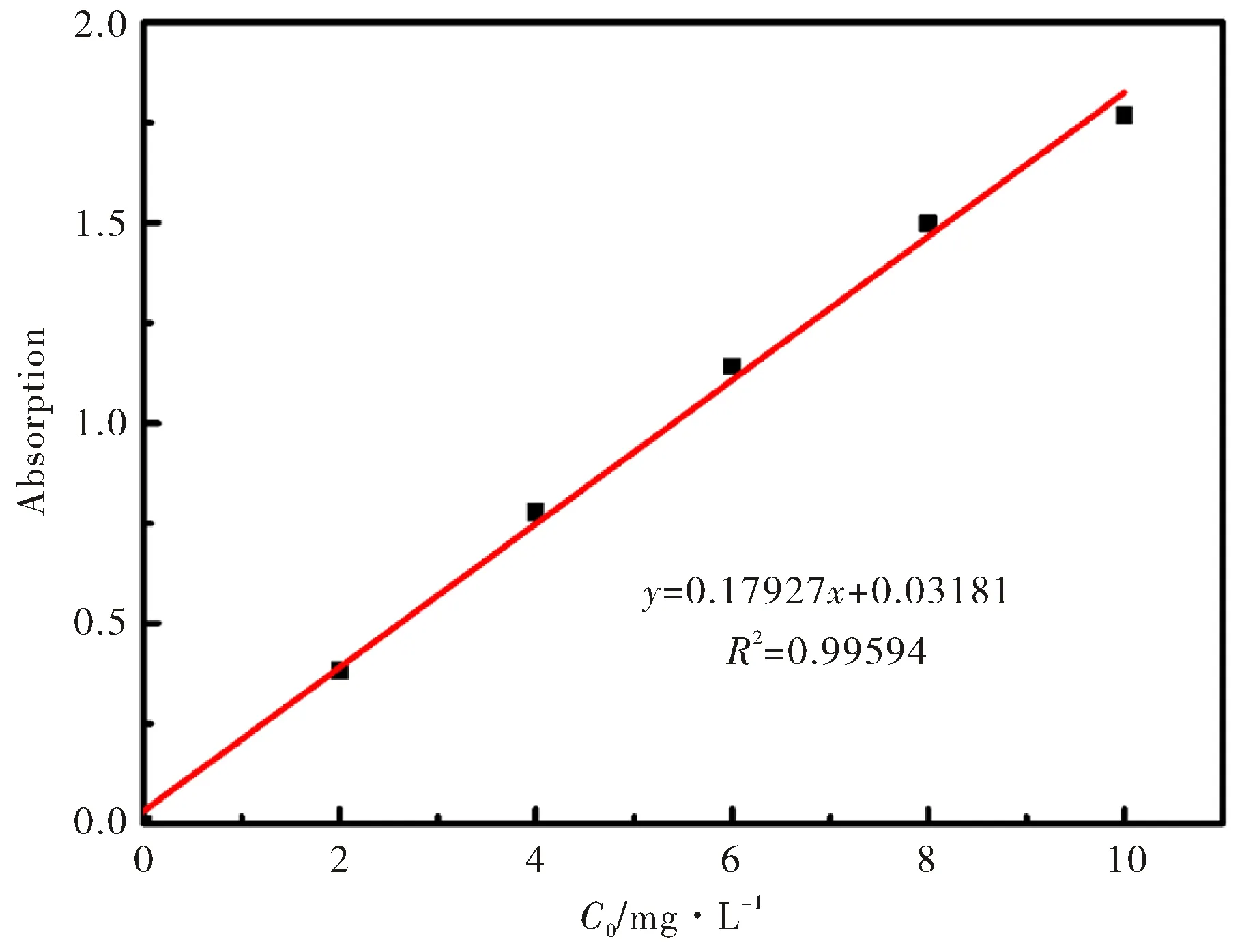
图1 RhB的标准曲线图Fig.1 Standard curve of RhB
1.3 吸附实验
量取适量的一定浓度的RhB溶液,用氢氧化钠溶液和盐酸溶液调节其pH值至某一特定值后,取50 mL RhB溶液于锥形瓶中,加入50 mg的一次剥离g-C3N4,在一定温度下振荡一段时间,取5 mL混合液,高速离心,取上层清液2 mL稀释一定倍数,采用紫外可见分光光度计测定其吸光度.
2 结果与讨论
2.1 超薄g-C3N4的表征
2.1.1 形貌表征 (TEM,AFM) 图2(a)~2(c)为高温聚合制备得到的块体g-C3N4,以及采用热剥离法一次剥离得到的g-C3N4和二次剥离得到的g-C3N4的TEM图.由图可知,所制备的样品均为层状结构,采用热剥离法得到的是薄层g-C3N4,并且二次剥离的g-C3N4比一次剥离的g-C3N4的片层更薄一些.图2(d)为二次剥离的g-C3N4的原子力显微图,可以看出其片层厚度约为2.33 nm.这说明采用热剥离法确实得到了超薄g-C3N4.
2.1.2 结构及比表面积分析 为了确定所获得样品的晶体结构,采用X射线衍射仪分别对块体g-C3N4、一次剥离的g-C3N4和二次剥离的g-C3N4进行了表征,如图3a所示.从图中可以看出,一次剥离g-C3N4和二次剥离g-C3N4的XRD图谱与块体g-C3N4的XRD图谱非常类似,表明热剥离法前后,样品的晶体结构并未发生显著的变化.值得注意的是,与块体g-C3N4的XRD图谱相比,在热剥离后获得的产物的XRD图谱中,发现位于13.3°对应的(100)晶面衍射峰几乎消失.这个衍射峰归属于g-C3N4晶体结构中的面间结构的堆垛,它的消失表明了在热剥离过程中,g-C3N4原有的较大平整结构在x-y平面上局部被撕裂;并且位于27.6°左右的(002)晶面衍射峰强度明显减弱,这个衍射峰对应于晶体结构中π共轭层的堆叠,它的峰强急剧减弱证实了块体g-C3N4的厚度在热剥离过程中变薄了.另外,随着热剥离次数的增加,(002)晶面衍射峰对应的峰位从块体g-C3N4的27.6°移动到了二次剥离g-C3N4的27.9°,这也说明了经过热剥离处理,g-C3N4的层间距逐渐增大,片层减小.以上结果均表明块体g-C3N4被成功剥离成少数几层或超薄层结构,这与TEM、AFM结果相吻合.
图3(b)为不同样品的DRS图谱转换的能级图,从图中可以看出,本实验制备得到的块体g-C3N4的带隙能约为2.66 eV,与文献报道值相符.随着热剥离次数的增加,样品的带隙能逐渐增大.这表明在CN结构中,层数的减少削弱了其共轭长度.带隙能逐渐增大的另外一个可能原因是强的量子限域效应,引起导带和价带往相反的方向移动[26].
块体g-C3N4经过热剥离后,相同质量的样品变的非常蓬松,可能是由于其比表面积急剧增大.如图3(c)所示,展示了块体、一次剥离、二次剥离g-C3N4的氮吸附-解吸等温线.值得注意的是,相比于块体g-C3N4,热剥离后的产物的BET比表面积得到了显著的增大,一次剥离g-C3N4和二次剥离g-C3N4的比表面积分别为:50.19 m2·g-1和192.98 m2·g-1,是块体g-C3N4(17.0 m2·g-1)的3倍和11倍.这表明剥离的g-C3N4的吸附能力将明显增强;并且二次剥离的g-C3N4的吸附性能可能更优于一次剥离的g-C3N4.

图3 不同材料的XRD图谱(a),DRS图谱转换的能级图(b),氮吸附—解吸等温线(c)Fig.3 XRD results (a),energy level diagram of DRS mapping conversion (b)and nitrogen adsorption-desorption isotherm (c)of different materials
2.2 超薄g-C3N4对RhB溶液的吸附
2.2.1 吸附的影响因素 在本实验中,g-C3N4一次剥离产率约为60%,二次剥离产率仅为10%左右.样品经过二次剥离后,产量很低.并且,通过TEM、XRD、BET等表征数据,可以证实相对于块体g-C3N4,一次剥离的样品变得更薄,BET比表面积增大;二次剥离后的样品是最薄的,且BET比表面积最大.据此可以推测,二次剥离的样品的吸附性能可能最佳,其次是一次剥离的样品,最差的是块体的样品.另外,本实验的目的是比较块体g-C3N4,一次剥离g-C3N4,二次剥离g-C3N4三者对不同染料分子的吸附性能.基于这几方面的综合考虑,本实验主要以一次剥离样品为考察对象,来探索吸附体系中的最佳条件,然后在最佳吸附条件下,分别探索块体g-C3N4,一次剥离g-C3N4,二次剥离g-C3N4吸附性能.
材料对有机物质的吸附常常与体系的温度、pH、吸附质的起始浓度和吸附时间等因素紧密相关.如图4所示,依次对超薄g-C3N4吸附RhB溶液这个体系的相关影响因素进行了深入研究.取50 mL浓度为20 mg·L-1的RhB溶液于锥形瓶中,加入50 mg一次剥离的g-C3N4样品,分别置于16.3 ℃、21.4 ℃、25.0 ℃、30.0 ℃和35.0 ℃下振荡1 h,离心,取上层清液2 mL稀释一倍,测定其吸光度值.将测得的吸光度代入标准曲线(图1),计算出吸附后且稀释一倍的RhB溶液的浓度c.通过与RhB溶液的起始浓度相对较,即可得出一次剥离的g-C3N4对RhB的吸附量qt.其计算公式为:
值得注意的是,为了提高实验数据的可信度,在所有的吸附实验中,每个数据点都做了5次平行实验,去除误差较大的数据点之后,其余4个数据点取平均值,即为图中所展示的数据点;并且这4个数据点的相对标准偏差RSD均小于5%.
由图4(a)可知,当温度为21.4 ℃,即室温时,一次剥离的g-C3N4的吸附性能最佳.因此,在后续的吸附实验中均选取温度值为21.4 ℃来进行实验.
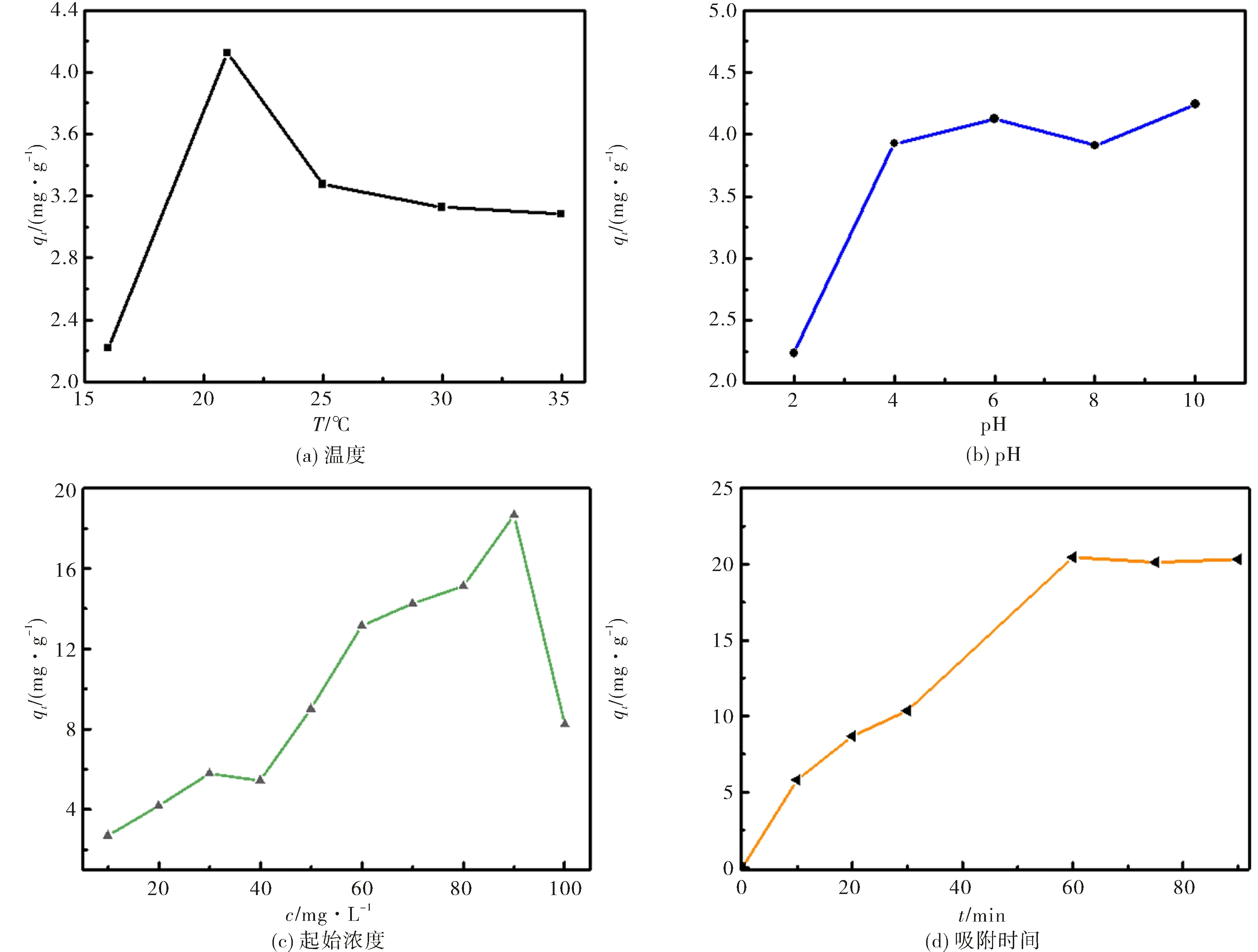
图4 一次剥离g-C3N4对RhB溶液的吸附条件优化Fig.4 Optimization of adsorption conditions for RhB solution by primary exfoliated g-C3N4
随后用一定浓度的氢氧化钠溶液和盐酸溶液调节配置好的20 mg·L-1的RhB溶液的pH值,使其分别为2、4、6、8、10.然后分别取50 mL RhB溶液于锥形瓶中,加入50 mg一次剥离的g-C3N4样品,在21.4 ℃的温度下振荡1 h,离心,取上层清液2 mL稀释一倍,测定其吸光度值.基于上述吸附量qt的计算公式,可以依次得出不同pH值条件下相应的吸附量.由图4(b)可知,当pH在4~10的范围内,一次剥离的g-C3N4对RhB的吸附性能差别不大.考虑到调试溶液pH过程中,可能存在一定的实验误差,且配置好的RhB溶液的pH值约为6,所以在此体系中,选择不调节RhB溶液的pH值进行后续的相关实验.
吸附质的起始浓度对吸附量的大小有着较大的影响,因此探讨了一次剥离的g-C3N4样品对不同起始浓度RhB溶液的吸附情况.分别配制30 mg·L-1、40 mg·L-1、50 mg·L-1、60 mg L-1、70 mg·L-1、80 mg·L-1、90 mg·L-1、100 mg·L-1的RhB溶液,取50 mL于锥形瓶中,均加入50 mg一次剥离的g-C3N4样品,在21.4 ℃的温度下振荡1 h,离心后取上层清液1 mL,分别稀释至3、4、5、6、7、8、9、10,测定其吸光度值.将测得的吸光度代入标准曲线(图1),算出吸附后且经过稀释的RhB溶液的浓度c,再换算成稀释之前即吸附完成后RhB溶液的浓度,最后与起始浓度相比较,即可得出一次剥离的g-C3N4样品对RhB的吸附量qt,其计算公式为:
……,以此类推.
由图4(c)可知,当RhB溶液的起始浓度为90 mg·L-1时,一次剥离的g-C3N4的吸附性能最佳.因此,选择起始浓度为90 mg·L-1的RhB溶液来进行后续的实验.
吸附时间与吸附量是直接相关的,因此对一次剥离的g-C3N4吸附RhB的吸附时间进行了研究,如图4d所示.取50 mL浓度为90 mg·L-1的RhB溶液于锥形瓶中,加入50 mg一次剥离的g-C3N4样品,在21.4 ℃的温度下分别振荡0 min、10 min、20 min、30 min、45 min、60 min、75 min、90 min,在每一个时刻点取少许混合液,离心,取上层清液1 mL,稀释至9 mL后,测定其相应的吸光度.将测得的吸光度代入标准曲线(图1),算出吸附后且经过稀释的RhB溶液的浓度c;再换算成稀释之前,即吸附完成后RhB溶液的浓度;最后与RhB溶液的起始浓度相比较,计算出一次剥离的g-C3N4样品对RhB的吸附量qt,其相应的计算公式为:
由图4(d)可知,当吸附时间为60 min时,吸附达到平衡.因此,选取的吸附时间为60 min来进行后续实验.
2.2.2 最佳条件 综上所述,一次剥离的g-C3N4样品吸附RhB的最佳条件为:吸附温度为21.4 ℃,pH为6,RhB溶液的起始浓度为90 mg·L-1,吸附时间为1 h.
在上述最佳吸附条件下,对块体g-C3N4和二次剥离g-C3N4的样品也进行了吸附实验的研究.其实验过程为:取50 mL起始浓度为90 mg·L-1的RhB溶液于锥形瓶中,分别加入50 mg的块状g-C3N4、一次剥离的g-C3N4和二次剥离的g-C3N4样品,在温度为21.4 ℃下振荡1 h,然后离心,取1 mL上层清液稀释至9 mL,测定其相应的吸光度.通过计算,得知:块体g-C3N4、一次剥离g-C3N4和二次剥离g-C3N4在1 h内对起始浓度90 mg·L-1的RhB的最大吸附量分别为7.270 mg·g-1,20.463 mg·g-1和36.094 mg·g-1.
2.2.3 吸附等温线 根据图4(c)测试的数据,得到一次剥离g-C3N4样品对RhB的吸附等温方程,如图5(a)所示.当温度不变时,随着起始浓度的增加,一次剥离g-C3N4样品对RhB的平衡吸附量随之增大,当达到最大吸附量时,平衡吸附量降低.因此在后续的拟合中不考虑最大吸附量之后的数据.
基于Langmuir和Freundlich等温线方程的微观物理模型假设[27]:1)染料分子在g-C3N4样品表面的吸附是单层的,没有其他的分子覆盖层;2)g-C3N4样品表面的吸附位点的可能性是一样的,且表面是完全一致的;3)染料分子在g-C3N4样品表面的吸附是动态平衡的,被吸附的染料分子受热运动影响可以重新回到液相,4)达到吸附平衡时,吸附速度等于脱附速度,对一次剥离g-C3N4样品对RhB的吸附体系采用Langmuir和Freundlich等温线方程来进行模拟,如图5(b)~5(c).Langmuir等温线方程表达式为:
Freundlich等温线方程表达式为:
式中,Ce为吸附平衡时,吸附质的浓度 (单位:mg·L-1);qe为吸附平衡时对应的吸附量(单位:mg·g-1);qm为最大吸附量(单位:mg·g-1);KL、KF为描述吸附能力的常数;n为描述吸附强度的常数.
比较图5(b)与图5(c)可知,Freundlich等温线模型[图5(c)]比Langmuir等温线模型[图5(b)]的拟合相关系数R2要大,说明Freundlich等温线模型对一次剥离的g-C3N4样品吸附RhB这个体系具有更好的拟合效果,能更好的体现一次剥离g-C3N4样品对RhB的吸附行为.

图5 一次剥离g-C3N4样品吸附RhB的吸附等温线Fig.5 Adsorption isotherms of RhB adsorbed by one stripping of g-C3N4 samples
2.2.4 吸附动力学研究 采用动力学模型对图4(c)测试的数据进行拟合,准一级动力学模型方程:
ln(qe-qt)=lnqe-k1t,
准二级动力学模型方程:
式中,qe为溶液达到吸附平衡时吸附剂的吸附量(单位:mg·g-1);qt为某一时刻吸附剂的吸附量(单位:mg·g-1);k1为准一级平衡速率常数(单位:min);k2为准二级速率常数(单位:g·mg-1·min-1).
比较图6(a)和图6(b)可知,在温度不变的条件下,准一级动力学模型[图6(a)]比准二级动力学模型[图6(b)]的拟合相关系数R2要大,说明准一级动力学模型[图6(a)]能更好地描述一次剥离的g-C3N4样品对RhB的吸附动力学过程.
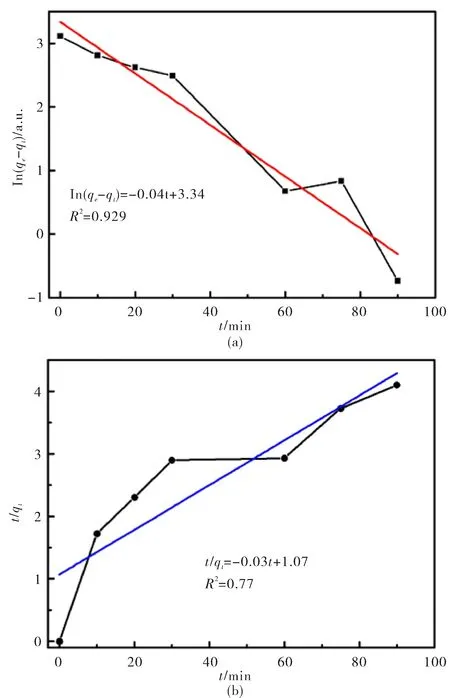
图6 一次剥离g-C3N4样品吸附RhB的吸附等温线的准一级(a),准二级(b)动力学曲线拟合图Fig.6 Pseudo-first-order (a)and pseudo-second-order (b) kinetic fit curves of the adsorption isotherm of primary exfoliated g-C3N4 samples on RhB
2.3 超薄g-C3N4对刚果红 (CR)溶液的吸附
2.3.1 吸附的最佳条件 参照一次剥离的g-C3N4样品吸附RhB的相关实验,深入探讨了一次剥离的g-C3N4样品对CR吸附的影响因素,实验结果表明,最佳吸附CR的条件为:吸附温度为21.4 ℃,pH为12,CR溶液的起始浓度为100 mg·L-1,吸附时间为20 min.
在最佳吸附条件下,进一步研究了块体g-C3N4、一次剥离的g-C3N4和二次剥离的g-C3N4样品对CR溶液的吸附行为.结果表明,块体g-C3N4、一次剥离的g-C3N4、二次剥离的g-C3N4在1 h内对100 mg·L-1CR的最大吸附量分别为:5.207、20.909和50.375 mg·g-1.
2.3.2 吸附等温线 参考图5的实验方案,得到了一次剥离的g-C3N4样品对CR的吸附等温方程,如图7(a)所示.由图可知,温度不变时,随着浓度的增加,一次剥离的g-C3N4对CR的平衡吸附量也增大.一次剥离的g-C3N4对CR的吸附也可以用Langmuir和Freundlich等温线方程来进行模拟.比较图7(b)与图7(c)可知,Freundlich等温线模型[图7(c)]比Langmuir等温线模型[图7(b)]的拟合相关系数R2要大,具有更好的拟合效果,这说明Freundlich等温线模型能更好的描述一次剥离的g-C3N4对CR的吸附行为.
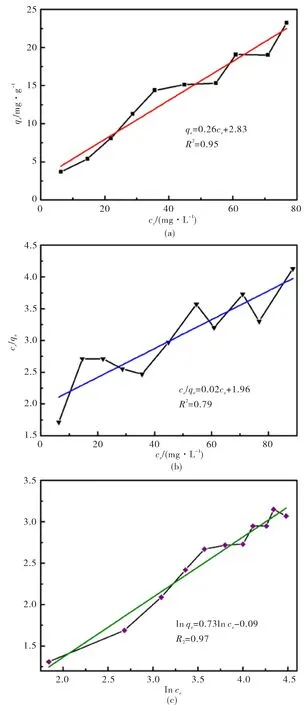
图7 一次剥离g-C3N4样品吸附CR的吸附等温线Fig.7 Adsorption isotherm of primary exfoliated g-C3N4 samples on CR
2.3.3 吸附动力学研究 参考一次剥离的g-C3N4对RhB吸附动力学研究,分别得到了一次剥离的g-C3N4对CR的吸附动力学曲线,如图8所示.在温度不变的条件下,对于一次剥离的g-C3N4样品吸附CR的体系,准二级动力学模型[图8(b)]比准一级动力学模型[图8(a)]的拟合相关系数R2要大,这说明准二级动力学模型[图8(b)]能更好地描述一次剥离的g-C3N4对CR的吸附动力学过程.
2.4 被吸附分子RhB和CR在超薄g-C3N4上吸附行为差异的解析
从超薄g-C3N4吸附RhB和CR的研究结果得知,RhB的吸附为准一级动力学模型:ln(qe-qt)=-0.04t+3.3 (R2=0.93),而CR的吸附为为准二级动力学模型:t/qt=0.07t+0.14 (R2=0.99).为了探究同一吸附材料对不同吸附质分子的吸附动力学模型差异的本质原因,采用密度泛函理论,从分子的结构、前线轨道、表面静电势等多个方面开展了计算.如图9所示,优化后的RhB和CR分子的俯视图和侧视图,可以看出其结构中的苯环或六元环有的是处于同一平面上形成大的π键,有的不是在同一平面上,而是扭曲形成不同的二面角.由于g-C3N4是类石墨相的二维材料,其碳氮六元环基本是处于同一平面形成大π键,由于π—π键的相互作用,不同构型的被吸附分子在g-C3N4表面上的吸附行为将有所差异.同时也探究了RhB和CR分子中电子填充的能量最高轨道 (HOMO)和分子中空轨道中能量最低的轨道 (LUMO)的差异.电子能级将决定于被吸附分子与吸附材料间的电荷转移能力和吸附能大小,直接影响其吸附行为.最后,对RhB和CR分子的表面静电势 (ESP)进行了理论模拟,如图9所示.不同颜色对应于不同的表面静电势强弱,这将直接影响被吸附分子与吸附材料间的吸附位点和吸附能大小,最终影响其吸附行为.综上所述,第一性原理计算表明,超薄g-C3N4对RhB和CR的吸附动力学模型不同,主要是由于RhB和CR的分子结构不同,前线轨道不同、表面静电势不同,使其在超薄g-C3N4的表面上的吸附位点和吸附能不同等微观差异所导致的.
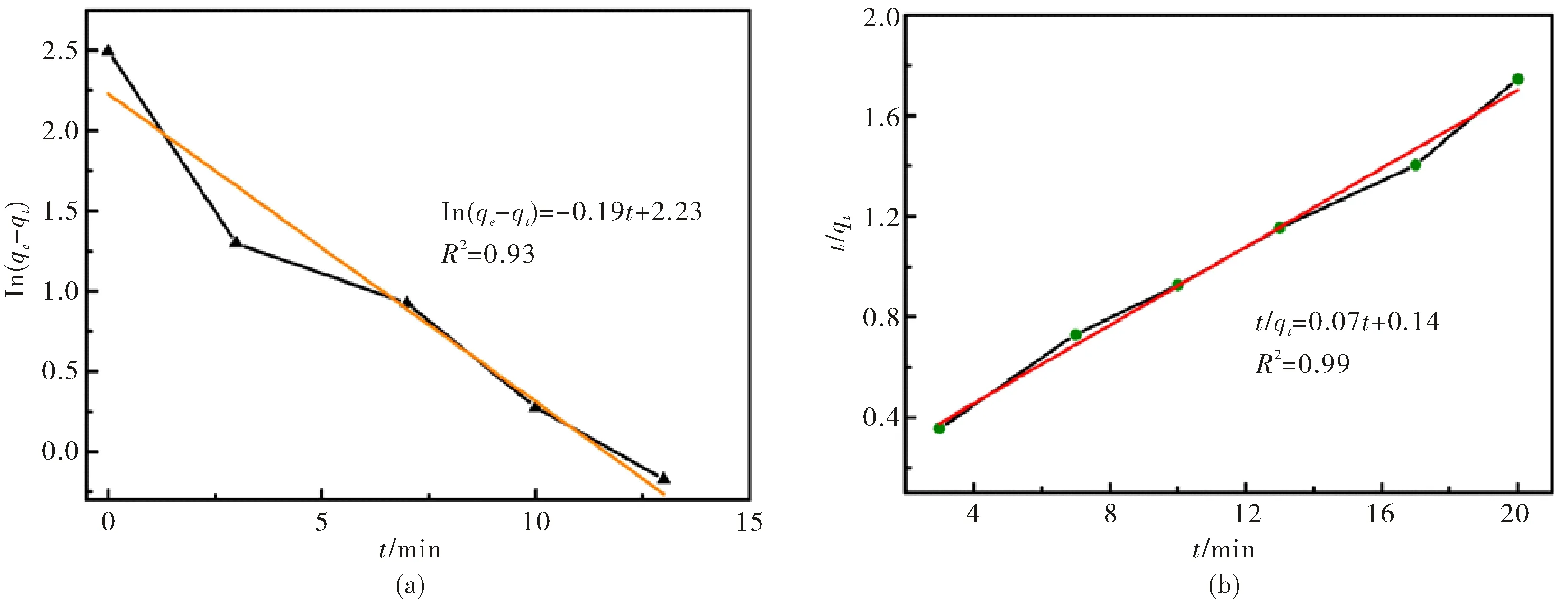
图8 一次剥离的g-C3N4样品吸附CR的吸附等温线的准一级(a),准二级(b)动力学曲线拟合图Fig.8 Pseudo-first-order (a)and pseudo-second-order (b)kinetic fit curves of the adsorption isotherm of primary exfoliated g-C3N4 samples on CR
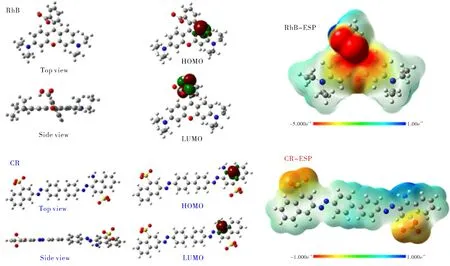
图9 RhB和CR的分子空间结构图、HOMO/LUMO轨道、表面静电势(ESP)理论计算图Fig.9 Molecular space structure diagrams of RhB and CR,HOMO/LUMO orbitals,and theoretical calculations of surface electrostatic potential
3 结论
超薄g-C3N4吸附染料RhB的最佳实验条件为:50 mL起始浓度为90 mg·L-1的RhB溶液,调节pH至6,加入50 mg吸附剂在室温下振荡1 h,可得到此体系的最大吸附量;并且二次剥离的g-C3N4的最大吸附量是块体g-C3N4和一次剥离的g-C3N4的5倍和1.8倍.超薄g-C3N4吸附染料CR的最佳实验条件为:50 mL起始浓度为100 mg·L-1的CR溶液,调pH至12,加入50 mg 吸附剂在室温下振荡20 min,可得到此体系的最大吸附量;并且二次剥离g-C3N4的最大吸附量是块体g-C3N4和一次剥离g-C3N4的9.7倍和2.4倍.对不同类型染料的吸附结果均表明,相对于块体g-C3N4和一次剥离g-C3N4,二次剥离的g-C3N4样品具有最大的吸附量,这可能是由于二次剥离g-C3N4的结构片层更薄,比表面积更大,吸附能力更强.本课题组还发现,超薄g-C3N4对RhB的吸附动力学过程为准一级动力学模型ln(qe-qt)=-0.04t+3.3 (R2=0.93),吸附Freundlich等温线方程为lnqe=-0.93+0.87lnce(R2=0.90);而超薄g-C3N4对CR的的吸附动力学过程为准二级动力学模型t/qt=0.07t+0.14 (R2=0.99),吸附Freundlich等温线方程为lnqe=-0.09+0.73lnce(R2=0.97).超薄g-C3N4对RhB和CR的吸附动力学模型不同,可能是由于不同类型染料的分子结构不同、前线轨道不同、表面静电势不同,且在超薄g-C3N4吸附过程中,不同类型染料的分子在其表面的构型、吸附位点和吸附能不同,这些微观的差异都有可能导致超薄g-C3N4发生吸附时其吸附动力学过程不一样.
