氢化可的松局部注射加90Sr-90Y同位素敷贴抑制大鼠皮肤瘢痕形成机制分析
2021-09-02张芬戴耕武杨镓宁罗东升赖小梅
张芬,戴耕武,杨镓宁,罗东升,赖小梅
作者单位:四川省人民医院皮肤外科,四川成都610031
瘢痕是物理、生物、化学等因素的损害作用于皮肤软组织,导致皮肤软组织的严重损伤而不能完全自行正常修复,转由纤维组织替代修复留下的既影响外观又影响功能的局部症状。皮肤损伤后,在自然愈合的过程中,成纤维细胞转化为成肌纤维细胞,但是一旦成纤维细胞的增殖比其凋亡更活跃,就会影响组织的正常生理功能,例如引起病理性瘢痕或诱发纤维化疾病甚至导致皮肤癌症的发生。每年在发达国家,多达5 500万次的选择性手术以及2 500万次创伤后手术导致了瘢痕的产生,而在低收入和中等收入国家中这一情况更严重,瘢痕人数更多。另一方面,瘢痕影响美观,并且经常疼痛或瘙痒,使人感到沮丧烦躁不安,大大降低了病人预后的生活质量。因此,加强对抑制瘢痕药物及治疗方式的探索具有重要的意义。
糖皮质激素是机体内极为重要的一类调节分子,它对机体的发育、生长、代谢以及免疫功能等起着重要调节作用。有研究指出,糖皮质激素可增强胰腺癌对放疗的耐受性,可增强放疗后病人的机体能量水平。也有报道指出,糖皮质激素注射治疗有使手术不能切除的瘢痕疙瘩萎缩的可能。另外通过Sr-Y敷贴器,在其衰变过程中,产生β射线,其可作用于瘢痕组织中的成纤维细胞,在受到电离辐射作用后,成纤维细胞出现变性,胶原纤维的合成与沉积被抑制,破坏了瘢痕组织,并减少炎性递质的含量,可有效抑制瘢痕的形成。基于此,本研究于2017年1月至2018年12月联合了氢化可的松局部注射联合放疗,通过动物实验,详细观察了其抑制皮肤瘢痕形成的效果,并对其作用机制进行了初步探索,报告如下。
1 材料方法
1.1 实验动物及试剂
SPF级50日龄雄性健康SD大鼠30只,体质量范围为260~300 g,购自Vital River Laboratory Animal Technology(中国北京),许可证号:北京SYXK(京)2017-0033;糖皮质激素注射液[2.5%醋酸氢化可的松注射液(25 g/L)]购自北京紫竹药业有限公司,批号H11020062,批次1706271;放射性核素Sr-Y敷贴器由中国原子能科学研究院同位素研究所研制;二辛可宁酸试剂盒购自美国Pierce Corporation公司;一抗二抗购自美国Thermo Fisher Tech公司;Elisa比色测定试剂盒Bioxytech LPO-586获自美国Oxis International公司。1.2 动物模型制备及分组
使用10%的水合氯醛溶液将30只大鼠进行麻醉,麻醉后在背侧皮肤的左侧切出一条皮肤矩形(10 mm×20 mm),通过真皮和皮下筋膜切开切口,露出下面的肌肉(未切开)。由于大鼠瘢痕模型的制备会极大地影响最终结果,因此该实验中所有大鼠的手术切口均由同一人进行。手术后第14天,将大鼠按照随机数字表法分为对照组、糖皮质激素组、糖皮质激素+放疗组,各10只。对照组不做任何处理;糖皮质激素组将醋酸氢化可的松注射液1 mL平行于皮面均匀注入瘢痕部位,拔针后用棉签按压针眼至药液不再渗出,每周注射2次为1个疗程,共治疗2个疗程;糖皮质激素+放疗组行糖皮质激素注射治疗及放射性核素Sr-Y敷贴照射治疗,糖皮质激素治疗同糖皮质激素组一致,另在3 mm的橡皮防护贴的保护下,把Sr-Y敷贴器活性面对着皮损处照射,使每个部位吸收的计量达到27 Gy,每周2次为1个疗程,共治疗2个疗程,与糖皮质激素注射治疗交替进行。1.3 医学伦理学问题
所有实验程序均符合一般动物实验伦理学原则,并根据美国国立卫生研究院(NIH)公布的实验动物护理和使用指南(NIH出版物编号85-23)进行实验。1.4瘢痕的测量
每天用游标卡尺测量术后瘢痕的长、宽,并观察是否产生了瘢痕增生,并将相关数据进行记录。于术后第30天,将大鼠处死,并将瘢痕组织收集进行相关分析。1.5 蛋白质印迹法
将皮肤瘢痕组织以1∶9(g/L)的比例加入盐水中以形成匀浆。在7 000 r/min离心5 min后,用含有0.1 mmol/L二硫苏糖醇和蛋白酶抑制剂混合物的组织蛋白提取试剂在冰上裂解沉淀物。使用二辛可宁酸试剂盒测定蛋白质浓度。使用12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)分离等量的蛋白质级分,然后在100 mmol/L的tris-甘氨酸缓冲液中转移到硝酸纤维素膜上55 min。用含有0.05%(V
/V
)Tween-20(TBST)的tris缓冲盐水中的5%(W
/V
)脱脂奶粉在室温下封闭膜2 h。在4℃下与适当的一抗孵育过夜后,用TBST洗涤膜3次,在室温下与二抗孵育2 h,然后用TBST再洗涤3次。使用增强的化学发光溶液开发蛋白质印迹。使用Image Lab Software(Bio-Rad,USA)使蛋白质表达水平可视化。1.6 酶联免疫吸附测定(ELISA)检测转化生长因子
-β1(TGF
-β1)和
转
化
生
长
因
子
激
活
激
酶1(TAK1)
使用来自皮肤瘢痕组织的蛋白质提取物,根据制造商的说明书,通过ELISA(R&D Systems)测量瘢痕组织的TGF-β1和TAK1。将值标准化为蛋白质含量。用市售的比色测定试剂盒Bioxytech LPO-586(Oxis International)测量LV中的脂质过氧化。为了计算脂质过氧化,将样品应用于MDA标准曲线并标准化为相对蛋白质含量。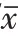
2 结果
2.1 糖皮质激素注射治疗加放疗显著减小了肉眼可见的瘢痕长度
在两个疗程结束后,即手术后第29天,对照组的瘢痕长度为(18.55±2.31)mm,宽度为(7.3±1.13)mm,80%(8/10)出现了瘢痕增生;糖皮质激素组的瘢痕长度为(15.39±2.17)mm,宽度为(4.7±1.25)mm,60%(6/10)出现了瘢痕增生;糖皮质激素+放疗组的瘢痕长度为(10.47±1.92)mm,宽度为(1.3±0.94)mm,仅20%(2/10)出现了瘢痕增生。三组间瘢痕长度及宽度比较差异有统计学意义(F
=12.734
、14.221,均P
<0.01),瘢痕增生比例比较也差异有统计学意义(χ
=7.500,P
=0.024)。经两两比较,糖皮质激素+放疗组的瘢痕长宽显著小于对照组及糖皮质激素组(P
<0.000 1),其瘢痕增生现象也明显轻于对照组及糖皮质激素组(P
<0.05)。2.2 糖皮质激素注射治疗加放疗显著减少了Smad3蛋白的表达水平
对照组、糖皮质激素组、糖皮质激素+放疗组的Smad3蛋白表达水平分别为(1.00±0.15)、(0.78±0.20)、(0.47±0.18)(F
=9.491,P
<0.01);经两两比较,糖皮质激素+放疗组的Smad3蛋白表达水平明显低于对照组及糖皮质激素组(P
<0.000 1,P
<0.01),如图1所示。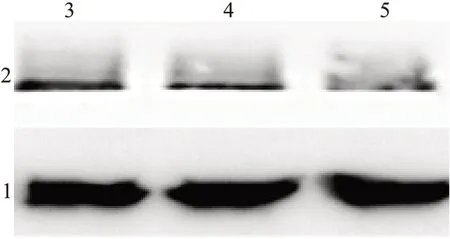
图1 蛋白质印迹法检测各组大鼠皮肤瘢痕组织Smad3蛋白水平
2.3 糖皮质激素注射治疗加放疗显著降低了TGF
β1和TAK1的表达水平
糖皮质激素+放疗组TGFβ1和TAK1的表达水平分别明显低于对照组及糖皮质激素组(均P
<0.05),如表1所示。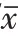
表1 各组大鼠皮肤瘢痕组织转化生长因子-β1(TGF-β1)和转化生长因子激活激酶1(TAK1)相对表达量的比较/±s
3 讨论
不论是减少相关疾病的发生率,还是要使受伤的区域恢复新生并使皮肤功能正常化,瘢痕形成的机制以及如何抑制瘢痕形成都是过去几十年来的热门话题。本研究发现,糖皮质激素注射治疗+放疗能有效抑制瘢痕的形成,这种联合方法比单一的糖皮质激素注射治疗的效果更好,这就说明,通过放射性核素Sr-Y放疗和糖皮质激素注射治疗,发挥了两种方法抑制瘢痕形成的功效,并且在实验过程中,本课题组发现,该联合方法安全、无副作用,具有在临床进行推广的潜力。
在本探究中,建立与人类相似的瘢痕模型是瘢痕研究的重要组成部分。当前,相关报道指出,用作瘢痕模型的常见动物包括猪,兔耳,裸鼠,大鼠,小鼠,其伤口愈合过程被认为与人类肥厚性瘢痕形成相似。但是以猪来制作瘢痕模型非常昂贵且困难。对猪进行手术需要花费大量时间和精力,并且容易产生人为错误。而且,这种方法的瘢痕模型不能模拟瘢痕挛缩和畸形,肥大性瘢痕不会侵犯周围的正常组织。兔耳疤模型仅限于原始创伤范围,它的胶原蛋白沉积不能达到瘢痕的厚度。小鼠是皮肤松弛的动物,其瘢痕生成过程中总是出现纤维化,更不易形成瘢痕。相比之下,大鼠更常用于制造瘢痕模型。本研究即采用了大鼠建立了线性瘢痕模型,并完成了相关的实验。
本研究初步探讨了糖皮质激素注射治疗+放疗抑制瘢痕形成的机制,根据实验结果,本课题组推断是由于Smad3途径及TGF-β1和TAK1途径的下调所致。一些报道也指出,减少Smad和TAK1磷酸化可抑制瘢痕疙瘩形成,并且也有研究指出,TGF-β1支持过多和无组织的胶原沉积,调节Ⅰ,Ⅲ和Smad胶原蛋白的表达,可以作为瘢痕治疗的靶标[20-21]。本研究通过蛋白质印迹法发现,糖皮质激素注射治疗+放疗组的Smad蛋白的表达显著低于对照组和糖皮质激素组,并且Elisa实验也发现,糖皮质激素+放疗组TGF-β1和TAK1的表达水平分别明显低于对照组及糖皮质激素组,能初步说明糖皮质激素注射治疗+放疗抑制瘢痕形成的机制。
综上所述,氢化可的松局部注射联合放疗可用于抑制瘢痕的形成,效果明显,安全可靠,可进一步在临床上进行推广。但由于其作用机制复杂多样,需在后期的研究中进行全方位的探索。
