长链非编码RNA母系表达基因8靶向微小RNA-497-5p调控血管瘤血管内皮细胞的增殖和凋亡
2021-09-02张蕾林莹波乔娟王云璐
张蕾,林莹波,乔娟,王云璐
作者单位:1河南中医药大学护理学院,河南郑州450046;2广东茂名健康职业学院,广东茂名525000
血管瘤是婴幼儿最常见的良性肿瘤,通常发生在婴儿出生时或出生后两周,约75%~80%的血管瘤病人为女性。虽然血管瘤是一种良性肿瘤,但严重的血管瘤会影响皮肤的功能,给病人及其近亲属带来沉重的身心负担,部分血管瘤的快速生长和侵袭甚至威胁儿童的生命。因此,了解血管瘤发生发展的分子机制对于血管瘤的早期诊断和有效的联合治疗具有至关重要的作用。长链非编码RNA(long non-coding RNAs,lncRNA)是一类长度超过200个核苷酸与肿瘤细胞的增殖、凋亡、扩散转移以及血管生成有关的非编码RNA。刘筱雯通过转录组芯片技术进行婴幼儿血管瘤组织lncRNAs表达谱分析发现,lncRNA母系表达基因8(maternally expressed gene 8,MEG8)在血管瘤中表达上调,且通过定量聚合酶链反应(qPCR)验证表达存在明显差异。此外,有研究报道MEG8在转化生长因子-β(TGF-β)诱导的肺癌A549细胞和胰腺癌Panc1细胞中表达上调,参与肺癌、胰腺癌细胞上皮间质转化的表观遗传学进程。但目前MEG8在血管瘤发生发展中的作用尚不明确。因此,本研究分析了MEG8在血管瘤组织中的表达,研究MEG8对血管瘤内皮细胞增殖、凋亡的影响及其可能的分子机制,以期为MEG8作为血管瘤的诊疗靶点提供理论依据。
1 材料与方法
1.1 实验材料
血管瘤组织(52例,均为增殖期肿瘤组织)和与其对应的瘤旁正常皮肤组织(52例)由河南中医药大学第一附属医院于2017年1月至2018年6月间收集。52例样本来源于婴幼儿,其中男性15例,女性37例,年龄为3个月至12岁之间。在开展本研究之前所有病人近亲属均签署知情同意书,本研究符合《世界医学协会赫尔辛基宣言》相关要求。血管瘤血管内皮细胞HemEC细胞购于上海柯雷生物科技有限公司;EBM-2培养基购于Lonza公司;胎牛血清购于杭州四季青公司;Lipofectamine2000购于Invitrogen公司;双荧光素酶报告基因检测试剂盒购于Promega公司;Trizol试剂和蛋白质印迹法(Western blotting)相关试剂购于上海碧云天生物技术有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)试剂盒购于北京索莱宝科技有限公司;PCR引物、si-MEG8、si-NC、微小RNA(miR)-497-5p mimics、miR-NC、anti-miR-497-5p、anti-miR-NC、pcDNA3.1、pcDNA3.1-MEG8以 及WTMEG8、MUT-MEG8的构建和测序均由北京华大基因公司提供;兔源细胞周期蛋白D1(cyclin D1)单克隆抗体、兔源P21单克隆抗体、兔源B细胞淋巴瘤-2(Bcl-2)单克隆抗体、兔源Bcl相关X(Bax)蛋白多克隆抗体、兔源甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体以及辣根过氧化物酶(HRP)标记的山羊抗兔Ⅱ抗均购于Abcam公司。1.2 细胞培养、转染和分组
用含有10%胎牛血清的EBM-2培养基培养HemEC细胞。培养箱环境条件是37℃,二氧化碳体积分数为5%,湿度90%。取对数生长期的HemEC细胞,按照每孔2×10个细胞的密度接种于6孔板,利用Lipofectamine2000分别将si-MEG8、si-NC、miR-497-5p mimics、miR-NC转染至生长融合度为80%的HemEC细胞,并依次标记为si-MEG8组、si-NC组、miR-497-5p组、miR-NC组,培养24~72 h后,检测转染效果,进行后续实验。为验证MEG8能够通过调控miR-497-5p表达,将antimiR-497-5p、anti-miR-NC分别和si-MEG8共转染至HemEC细胞,并依次标记为anti-miR-497-5p组、anti-miR-NC组,培养24-72 h后,检测HemEC细胞的增殖和凋亡情况。1.3 实时荧光定量逆转录聚合酶链反应(qRTPCR)检测MEG8和miR
-497
-5p的表达水平
利用Trizol法分别提取52例血管瘤组织和与其对相应的瘤旁正常皮肤组织,以及各组HemEC细胞的总RNA,紫外分光光度法测定其浓度后,利用逆转录试剂盒将RNA逆转录为互补DNA(cDNA),随后进行qRT-PCR扩增。2法计算MEG8和miR-497-5p的相对表达水平。1.4 双荧光素酶报告基因验证MEG8和miR
-497
-5p的靶向关系
利用生物信息软件预测MEG8的靶基因。发现MEG8与miR-497-5p能够特异性结合,猜测MEG8和miR-497-5p存在靶向调控关系,并利用双荧光素酶报告基因实验进行验证。利用Lipofectamine2000将miR-497-5p mimics和miR-NC分别与WT-MEG8和MUT-MEG8共转染HemEC细胞,转染48 h后,测定各组HemEC细胞的荧光素酶活性。1.5 四甲基偶氮唑盐微量酶反应比色法(MTT法)检测细胞活力
将对数期HemEC细胞按照2×10个/孔的密度接种于96孔板,按照“1.2”方法转染后,分别于转染后24 h、48 h、72 h时间点加入10 μL的质量分数为5 g/L的MTT试剂,孵育4 h后,弃去上清液,各孔再加入二甲基亚砜试剂150 μL,震荡10 min至结晶充分溶解,用酶标仪在490 nm波长处检测各孔的吸光度。1.6 流式细胞术检测细胞凋亡
收集各组对数期HemEC细胞,用预冷的磷酸盐缓冲盐溶液(PBS)洗涤细胞,离心弃上清液后,用适量的1×结合缓冲液重悬细胞,调整细胞密度为1×10/mL。每管内加入100 μL细胞悬液,再向管中加入5 μL的膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC),室温避光轻轻地混匀10 min,加入5 μL的碘化丙啶(PI),室温,避光孵育5 min,加入PBS至500 μL,轻轻混匀,在1 h内用流式细胞仪检测。
1.7 蛋白质印迹法检测
利用RIPA裂解液裂解各组对数期HemEC细胞,获得细胞总蛋白,用BCA试剂盒进行蛋白定量。取30 μg已变性的蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE),电泳结束后,利用转膜装置将已分离的细胞蛋白转至聚偏二氟乙烯(PVDF)膜上,转膜结束后,用Western封闭液室温摇床封闭30 min,吸尽封闭液后,用Western洗涤液漂洗膜(共3次,10分钟/次),然后加入已稀释的抗cyclin D1(1∶500)、P21(1∶1 000)、Bcl-2(1∶1 000)、Bax(1∶500)和GAPDH(1∶2 500)蛋白的Ⅰ抗,室温孵育2 h后,向已洗涤后的PVDF膜中加入稀释好的Ⅱ抗,孵育1 h,ECL发光试剂盒显色后进行拍照,并用Image J软件对目的条带进行定量分析。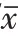
2 结果
2.1 MEG8和miR
-497
-5p在血管瘤组织和瘤旁正常皮肤组织中的表达
qRT-PCR检测显示,与瘤旁正常皮肤组织相比,血管瘤组织中MEG8的表达水平显著升高[(0.33±0.03)比(0.82±0.08),t
=41.356,P
<0.001],miR-497-5p的表达水平显著降低[(0.84±0.08)比(0.34±0.03),t
=42.200,P
<0.001]。2.2 抑制MEG8对细胞HemEC增殖的影响
如表1和图1所示,与si-NC组比较,si-MEG8组HemEC细胞MEG8的表达水平降低(P
<0.05),表明成功构建抑制MEG8表达的HemEC细胞株。与si-NC组比较,si-MEG8组HemEC细胞cyclin D1蛋白的表达水平降低,P21蛋白的表达水平升高;细胞在24 h、48 h和72 h时间点细胞存活率降低(P
<0.05)。表明,抑制MEG8能够抑制血管瘤血管内皮细胞增殖。
表1 抑制母系表达基因8(MEG8)对血管瘤血管内皮细胞HemEC增殖的影响/±s
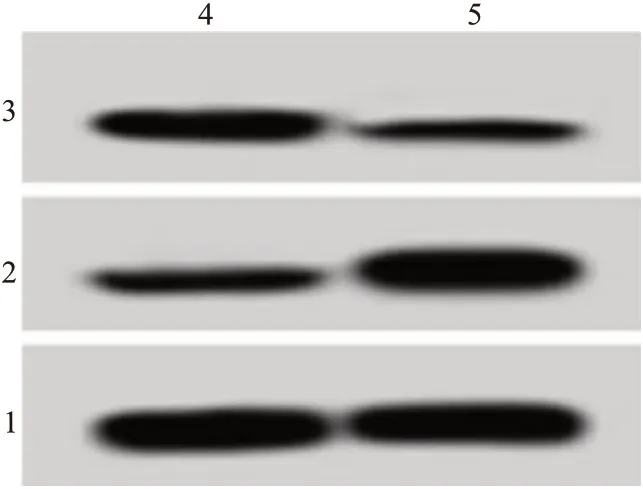
图1 抑制母系表达基因8(MEG8)对血管瘤血管内皮细胞HemEC增殖蛋白表达的影响
2.3 抑制MEG8对细胞HemEC凋亡的影响
如表2所示,与si-NC组相比,si-MEG8组HemEC细胞Bcl-2蛋白的表达水平降低,Bax蛋白表达水平升高,细胞凋亡率增加(P
<0.05)。表明,抑制MEG8能够促进血管瘤血管内皮细胞凋亡。
表2 抑制母系表达基因8(MEG8)对血管瘤血管内皮细胞HemEC凋亡的影响/±s
2.4 MEG8靶向调控miR
-497
-5p表达
利用生物学信息软件在线进行靶基因预测显示,见图2,miR-497-5p和MEG8存在部分连续结合位点。与miRNC和WT-MEG8共转染组相比,miR-497-5p和WTMEG8共转染组HemEC细胞的荧光素酶活性降低[(0.37±0.04)比(1.05±0.10),t
=15.465,P
<0.001];与miR-NC和MUT-MEG8共转 染组 相比,miR-497-5p和WT-MEG8共转染组HemEC细胞的荧光素酶活性差异无统计学意义[(1.07±0.10)比(1.08±0.10),t
=0.173,P
=0.866]。pcDNA3.1组、pcDNA3.1-MEG8组、si-NC组、si-MEG8组四组比较,F
=195.212,P
<0.001。pcDNA3.1-MEG8组HemEC细胞miR-497-5p表达水平低于pcDNA3.1组[(0.09±0.01)比(0.38±0.05),P
<0.05];si-MEG8组HemEC细胞miR-497-5p表达水平高于si-NC组[(0.88±0.09)比(0.39±0.05),P
<0.05]。以上结果表明,miR-497-5p是MEG8的靶基因,MEG8可负性调控miR-497-5p的表达。
图2 生物学信息软件在线预测母系表达基因8(MEG8)与miR-497-5p结合位点
2.5 过表达miR
-497
-5p对细胞HemEC增殖、凋亡的影响
如表3,4所示,与miR-NC组比较,miR-497-5p组HemEC细胞miR-497-5p的表达水平上调(P
<0.05),表明已成功构建过表达miR-497-5p的HemEC细胞株。与miR-NC组比较,miR-497-5p组HemEC细胞cyclin D1和Bcl-2蛋白的表达水平降低,P21和Bax蛋白的表达水平升高(P
<0.05);细胞在24 h、48 h和72 h时间点细胞存活率降低,细胞凋亡率增加(P
<0.05)。表明,过表达miR-497-5p能够抑制血管瘤血管内皮细胞增殖,促进细胞凋亡。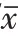
表3 过表达miR-497-5p对血管瘤血管内皮细胞HemEC增殖的影响/±s
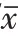
表4 过表达miR-497-5p对血管瘤血管内皮细胞HemEC凋亡的影响/±s
2.6抑制miR
-497
-5p能逆转抑制MEG8对细胞HemEC增殖、凋亡的作用
如表5,6所示,与si-NC组相比,si-MEG8组HemEC细胞miR-497-5p、cyclin D1和Bcl-2蛋白的表达水平降低,P21和Bax蛋白的表达水平升高,在24 h、48 h和72 h时间点细胞存活率降低,细胞凋亡率增加(P
<0.05);与si-MEG8+anti-miR-NC组 相 比,si-MEG8+anti-miR-497-5p组HemEC细胞miR-497-5p、cyclin D1和Bcl-2蛋白的表达水平升高,P21和Bax蛋白的表达水平降低,在24 h、48 h和72 h时间点细胞存活率增加,细胞凋亡率下降(P
<0.05)。以上结果表明,抑制miR-497-5p表达能够逆转抑制MEG8对血管瘤血管内皮细胞增殖和凋亡的影响。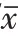
表5 抑制miR-497-5p能逆转抑制母系表达基因8(MEG8)对血管瘤血管内皮细胞HemEC增殖的影响/±s
3 讨论
近年来,lncRNA在血管瘤的发生发展中的作用受到越来越多研究者的关注。马从乾等研究发现,LINC00152在血管瘤组织中的表达明显上调,LINC00152可通过促进血管内皮生长因子受体2(VEGFR2)表达促进血管瘤内皮细胞的增殖、迁移和侵袭;Zhao等研究表明,核内小RNA宿主基因16(SNHG16)在血管瘤组织中呈高表达,SNHG16通过调控miR-520d-3p/信号转导及转录激活蛋白3(STAT3)轴,作为细胞增殖、血管形成、迁移和侵袭的竞争性内源RNA;Zhang等报道沉默尿路上皮癌相关1(UCA1)通过上调miR-200c表达抑制血管瘤内皮细胞存活,诱导细胞凋亡,进而抑制血管瘤生长;此外,肿瘤易感性候选基因9(CASC9)和opa相互作用蛋白5反义转录本1(OIP5-AS1)也参与对血管瘤细胞的增殖和转移的调控。以上研究提示,lncRNA在血管瘤的进展中发挥至关重要的作用,探索与血管瘤相关的lncRNA,对血管瘤病人的精准治疗具有重大意义。
MEG8基因定位于人14号染色体和鼠12号染色体,是最早在小鼠中鉴定的印记基因。其与父系表达基因Dlk1和Dio3以及若干母系表达基因Gtl2、Meg3、Mirg等构成Dlk1-Dio3印记区域,参与调控肌肉形成和胚胎发育。目前,关于MEG8基因在肿瘤的研究还比较少,仅发现MEG8在TGF-β诱导的肺癌A549细胞和胰腺癌Panc1细胞中表达上调,MEG8通过与EZH2蛋白增强子结合,诱导其募集到miR-34a和miR-203的调节区域,促进H3甲基化,抑制转录。然而,其人类同系物Meg3基因在肿瘤中的作用被广泛报道。例如,在宫颈癌中,Meg3表达下调,过表达Meg3通过靶向miR-21-5p可抑制宫颈癌肿瘤的生长,促进肿瘤细胞凋亡;在胃癌中,Meg3也呈低表达,过表达Meg3通过调控p53信号通路可抑制胃癌细胞的增殖和转移;此外,Meg3还可发挥内源性miR-494分子海绵作用调控PTEN/PI3K/AKT通路抑制血管瘤的发生。本研究发现,MEG8在血管瘤组织中表达上调,抑制MEG8能够抑制血管瘤内皮细胞增殖,促进细胞凋亡。表明,MEG8在血管瘤中发挥癌基因作用。
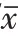
表6 抑制miR-497-5p能逆转抑制母系表达基因8(MEG8)对血管瘤血管内皮细胞HemEC凋亡的影响/±s
为探索MEG8调控血管瘤发生的分子机制,利用生物信息学软件在线进行靶基因预测发现,miR-497-5p是MEG8的潜在靶基因。miR-497-5p是一种抑癌基因,研究发现,miR-497-5p在非小细胞肺癌、骨肉瘤等恶性肿瘤中表达下调,过表达miR-497-5p能够抑制肿瘤细胞增殖和侵袭能力。本研究结果显示,miR-497-5p在血管瘤组织中表达水平显著下调。同时通过双荧光素酶报告基因实验和蛋白质印迹法检测证实MEG8可靶向负性调控miR-497-5p表达,进一步研究发现,过表达miR-497-5p能够抑制cyclin D1和Bcl-2蛋白表达,促进P21和Bax蛋白表达,抑制血管瘤内皮细胞增殖,促进细胞凋亡。为进一步证实MEG8通过调控miR-497-5p表达参与对血管瘤内皮细胞增殖和凋亡的调控,将si-MEG8和anti-miR-497-5p共转染至血管瘤内皮细胞,发现抑制miR-497-5p表达能够逆转抑制MEG8对血管瘤内皮细胞增殖和凋亡的影响。提示MEG8通过靶向调控miR-497-5p表达促进血管瘤的发生发展。
综上所述,lncRNA MEG8在血管瘤组织中表达显著上调,miR-497-5p表达下调,抑制MEG8通过靶向miR-497-5p能够抑制血管瘤内皮细胞增殖,诱导细胞凋亡,MEG8有望成为血管瘤分子治疗的新靶点。
