高效液相色谱法测定小麦粉中玉米赤霉烯酮的不确定度评定
2021-09-01◎赵飞
◎ 赵 飞
(辽宁省检验检测认证中心,辽宁 沈阳 110000)
测量不确定度评定是按照实际检测过程和相关信息对检测结果的分散性进行评估的一种方式[1]。测量不确定度可以客观的评价检测数据,尤其是当检测数据处于临界值时,进行不确定度评定可以保障检测结果的准确性[2]。
玉米赤霉烯酮,又称F-2毒素,是玉米赤霉菌的代谢产物[3-4]。玉米赤霉烯酮易污染玉米、小麦等谷物,尤其是当这些谷物储存不当时更易被污染[5]。它对神经系统、心脏、肾脏等有毒害作用。因此本文严格按照《食品安全国家标准 食品中玉米赤霉烯酮的测定》(GB 5009.209—2016)[6]操作,对其检测结果的不确定度进行评估,为实验室出具的玉米赤霉烯酮检测结果的准确性提供科学依据。
1 材料和方法
1.1 仪器与试剂
Agilent 1260 Infinity液相色谱仪(美国安捷伦公司)、ZORBAX SB-C18色谱柱(4.6 mm×150 mm,0.5 μm,美国安捷伦公司)、BSA224S-CW电子天平(德国赛多利斯公司)、GM200高速粉碎机(德国莱驰公司)、FJ300-SH均质器(德国IKA公司)、TTL-DCII氮吹仪(北京同泰联科技发展有限公司)、X1R高速冷冻离心机(德国Thermo公司)。
乙腈、甲醇(色谱纯,美国Fisher公司);氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾(分析纯,国药集团化学试剂有限公司);水,均为一级水;玉米赤霉烯酮标准物质(浓度为100.2 μg·mL-1,ROMER公司)。
1.2 实验方法
1.2.1 标准溶液的配制
准确吸取1.0 mL玉米赤霉烯酮标准溶液于10 mL容量瓶中,用乙腈稀释配制成浓度为1.02 μg·mL-1的标准储备液,-18 ℃避光保存。用70%乙腈溶液将上述标准储备液稀释成系列标准溶液,浓度分别为10 ng·mL-1、25 ng·mL-1、50 ng·mL-1、75 ng·mL-1和100 ng·mL-1,标准系列溶液临用现配。
1.2.2 液相色谱参考条件
色 谱 柱:ZORBAX SB-C18色 谱 柱(4.6 mm×150 mm,0.5 μm);流动相:乙腈∶水=70∶30(v/v);流速:0.7 mL·min-1;柱温:30 ℃;激发波长:274 nm;发射波长:440 nm;进样体积:100 μL。
1.2.3 样品前处理
称取40 g试样(精确至0.1 g)于均质杯中,加入4 g氯化钠、100 mL提取液,高速搅拌提取2 min,过滤。移取10 mL滤液于40 mL水中,经玻璃纤维滤纸过滤至澄清;准确移取10 mL上述滤液至免疫亲和柱上,直至有部分空气进入,用5 mL水淋洗柱子一次,再准确加入1.5 mL甲醇洗脱,流速为1滴/s。收集洗脱液于玻璃试管中,55 ℃下氮气吹干,用1.0 mL流动相溶解残渣,过膜待测。
1.2.4 数学模型的建立
样品中玉米赤霉烯酮的含量按式(1)计算。
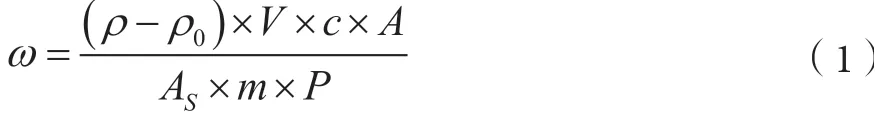
式中,ω-样品中玉米赤霉烯酮的含量,μg·kg-1;ρ-由标准曲线得出的样品溶液中玉米赤霉烯酮的浓度,ng·mL-1;ρ0-空白溶液中玉米赤霉烯酮的浓度,ng·mL-1;V-样品定容体积,mL;c-系数;A-试样溶液中玉米赤霉烯酮的色谱峰面积;AS-标准溶液中玉米赤霉烯酮的色谱峰面积;m-称样量,g;P-加标样品回收率。
2 标准不确定度分量的评定
2.1 标准品引入的不确定度ur(s)
2.1.1 标准品纯度引入的不确定度ur(c1)
通过查看玉米赤霉烯酮的标准物质证书,得到该标准品相对不确定度U=0.2%,k=2,则其相对标准不确定度为:
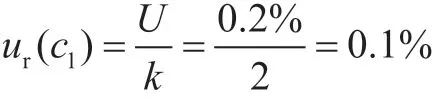
2.1.2 标准储备液配制引入的不确定度ur(c2)
标准储备液配制中用到1 mL的A级单标线吸量管、10 mL容量瓶,允许误差分别为±0.008 mL、±0.020 mL,按照均匀分布考虑,取则吸量管和容量瓶引入的不确定度为:
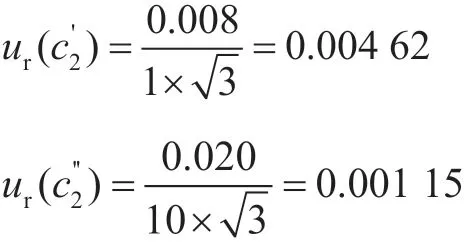
标准溶液配制室的温度通常控制在(20±5)℃,20 ℃下乙腈的膨胀系数为1.37×10-3℃-1,由实验室温度变化引起体积变化的相对标准不确定度为:
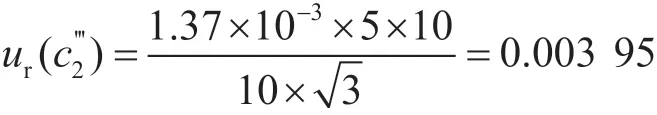
综上,标准储备液配制过程引入的不确定度为:

2.1.3 标准工作液配制引入的不确定度ur(c3)
标准曲线配制过程中各分量的相对合成标准不确定度见表1。

表1 标准曲线配制过程引入的不确定度表
根据各分量,标准曲线配制过程引入的相对标准不确定度为:
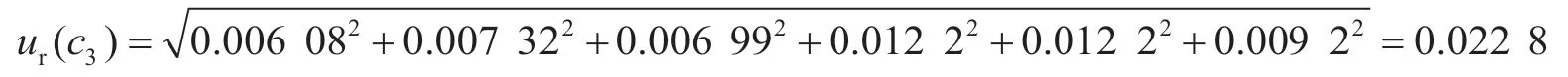
2.1.4 标准曲线拟合引入的不确定度ur(c4)
本方法对浓度依次为10 ng·mL-1、25 ng·mL-1、50 ng·mL-1、75 ng·mL-1和100 ng·mL-1的玉米赤霉烯酮标准溶液进行测定,以玉米赤霉烯酮标准溶液的浓度为横坐标,以响应值峰面积为纵坐标进行线性拟合,校准曲线方程见表2,并对阴性样品加标进行6次平行测定,测得结果分别为52.0 ng·mL-1、52.6 ng·mL-1、53.2 ng·mL-1、53.3 ng·mL-1、53.0 ng·mL-1和52.8 ng·mL-1,平均值为52.8 ng·mL-1,由标准曲线引入的不确定度可由式(2)计算。
表2 碘化钾饱和溶液的放置时间对测定结果的影响表

表2 玉米赤霉烯酮校准曲线表

式中,ur(c4)-曲线拟合引入的不确定度;S(A)-标准溶液待测物质信号残差的标准差;b-校准曲线的斜率;p-样品溶液检测次数(6次);n-标准溶液的测定次数(5次);c0-校准曲线校正后待测样品中玉米赤霉烯酮浓度的平均值,ng·mL-1;ci-标准曲线各点玉米赤霉烯酮浓度理论值,ng·mL-1;标准曲线各点玉米赤霉烯酮浓度的平均值,ng·mL-1。
其中,S(A)可按公式(3)计算。
式中,n-校准曲线的点数;Ai-标准溶液各浓度点的峰面积;A-根据标准曲线算出的理论峰面积。
由校准曲线拟合引入的相对标准不确定度为ur(c4)=0.001 88。
综上,标准物质引入的相对标准不确定度计算为:
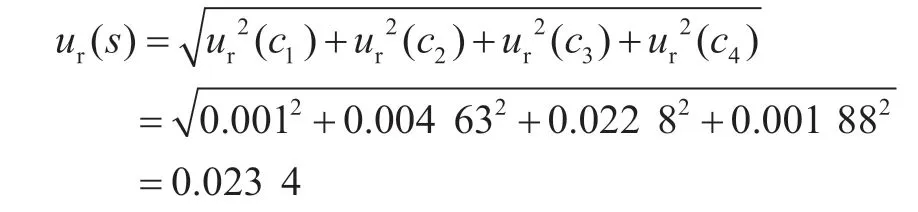
2.2 样品称量引入的不确定度ur(m)
采用分度为0.1 g的天平称量待测样品,该天平在0~50 g称量范围内的最大允许误差为±0.05 g,样品称量过程引入的相对不确定度为:

2.3 样品前处理引入的不确定度ur(V)
样品前处理过程中采用100 mL量筒,其容量允差为±1.0 mL,在(20±5)℃条件下,由此引入的相对标准不确定度为:
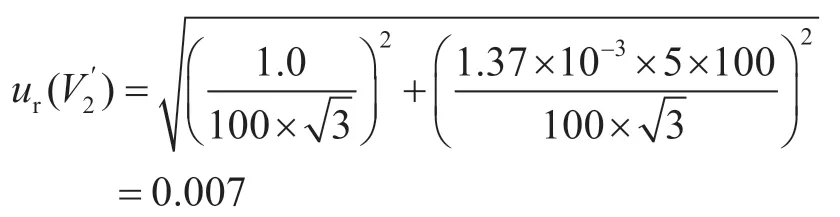
移取10 mL提取液的滤液,并加入40 mL水稀释混匀,10 mL单标线吸量管和50 mL刻度吸量管的容量允差为±0.020 mL、±0.10 mL,稀释过程引入的相对标准不确定度为:
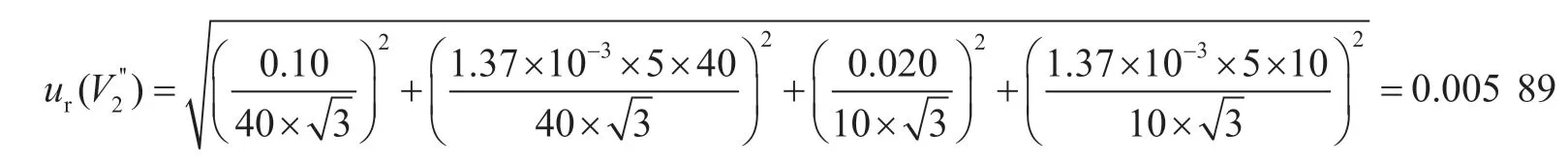
准确移取10 mL滤液至免疫亲和柱上净化,最后用1.0 mL流动相复溶,10 mL和1 mL单标线吸量管的容量允差为±0.020 mL、±0.007 mL,稀释过程引入的相对标准不确定度为:
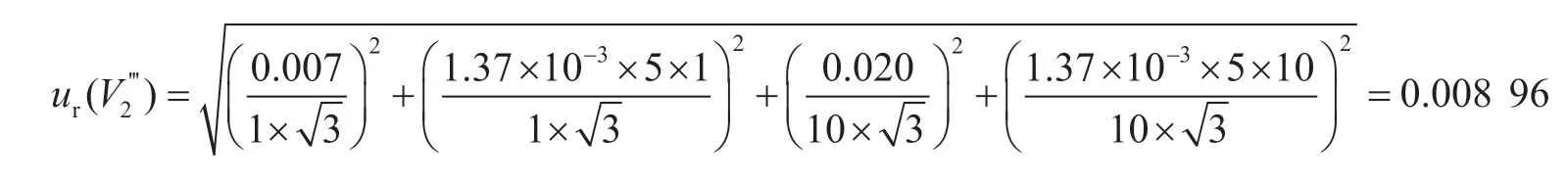
该过程引入的相对合成标准不确定度为:
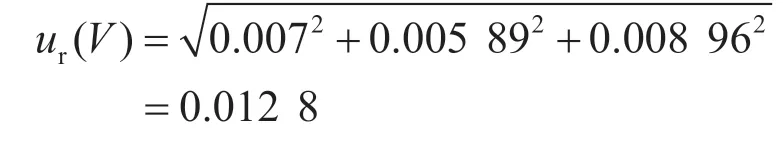
2.4 重复性引入的不确定度ur(R)
开展加标实验,添加量为70.0 μg·kg-1,测定值分别为65.0 μg·kg-1、65.7 μg·kg-1、66.5 μg·kg-1、66.6 μg·kg-1、66.2 μg·kg-1和66.0 μg·kg-1,平均值为66.0 μg·kg-1。按照A类评定,应用贝塞尔公式计算,待测物的实际标准偏差为0.590,其相对标准不确定度为:

2.5 回收率引入的不确定度ur(P)
向不含玉米赤霉烯酮的小麦粉中加标,添加量为70.0 μg·kg-1,通过前处理并检测计算,得回收率分别为92.9%、93.9%、95.0%、95.1%、94.6%和94.3%,平均值为94.3%,按照A类评定应用贝塞尔公式计算待测物的实际标准偏差为0.843%,其标准不确定度为:

用t来检验确定平均回收率是否与1有显著差异,当n=6,自由度为5时,在置信概率为95%时,t0.95(5)=2.571,该回收率下即t>2.571,需要用回收率对结果进行修正。回收率引入的相对标准不确定度为:

3 合成不确定度
采用本方法检测小麦粉中玉米赤霉烯酮的相对标准不确定度为:

玉米赤霉烯酮的合成标准不确定度为:

4 扩展不确定度的计算和检测结果的表示
在95%置信概率下,扩展因子k=2,则采用本方法检测小麦粉中玉米赤霉烯酮的扩展不确定度为U95=k×ur(x)=3.60 μg·kg-1,小麦粉中玉米赤霉烯酮的检测结果表示为(66.0±3.60)μg·kg-1;k=2。
5 结论
采用食品安全国家标准方法测定小麦粉中玉米赤霉烯酮含量,对检测结果的不确定度进行评定。通过评定,该实验中标准曲线配制过程引入的不确定度贡献最大。因此,在实验室采用该方法开展玉米赤霉烯酮检测时,要注意选用合适的量具,并定期开展检定校准,严格控制标准溶液配制室温度,切实减小不确定度分量,保证检测数据的科学性和合理性。
