基于深度学习光学相干断层扫描辅助诊断常见眼底疾病
2021-09-01何佳雯王莉菲张如如王晴川陈正宇范家伟鄂海红宋美娜
何佳雯,王莉菲,张如如,谭 玲,刘 毓,王晴川,陈正宇,范家伟,鄂海红,宋美娜*
(1.北京邮电大学计算机学院,北京 100876;2.教育部信息网络工程研究中心,北京 100876;3.河北省眼科医院眼底外科,河北 邢台 054001)
光学相干断层扫描(optical coherence tomography, OCT)是无接触、无创成像技术,以较高分辨率快速对眼部结构进行可视化,提供清晰的横轴位成像[1],现已成为诊断老年性黄斑变性(age-related macular degeneration, AMD)和糖尿病黄斑水肿(diabetic macular edema, DME)等眼底疾病的金标准[2];但图像中病变区域与正常区域之间的对比度较低,且成像过程受仪器噪声及其他生物组织的干扰,分析图像较为耗时,结果难以避免主观性。近年来,深度学习(deep learning,DL)技术发展迅速,用于医学图像处理可快速、准确地捕捉病变特征并判断疾病类型,提高工作效率和诊断精度及稳定性[3]。本文对基于DL的OCT辅助诊断常见眼底疾病研究进展进行综述。
1 OCT技术概述
基于干涉仪原理,不同深度的生物组织对于OCT设备发出光波的后向反射能力不同。以近红外弱相干光照射待测组织,检测不同深度层面生物组织的背向反射或数次散射信号,可得到眼部组织的二维或三维结构图像(图1)。OCT具有出色的光学切片能力,能利用宽带光源的低相干性实现对次表面的高分辨率层析成像而捕捉病变的精确信息[4],其探测深度远超过传统共焦显微镜。
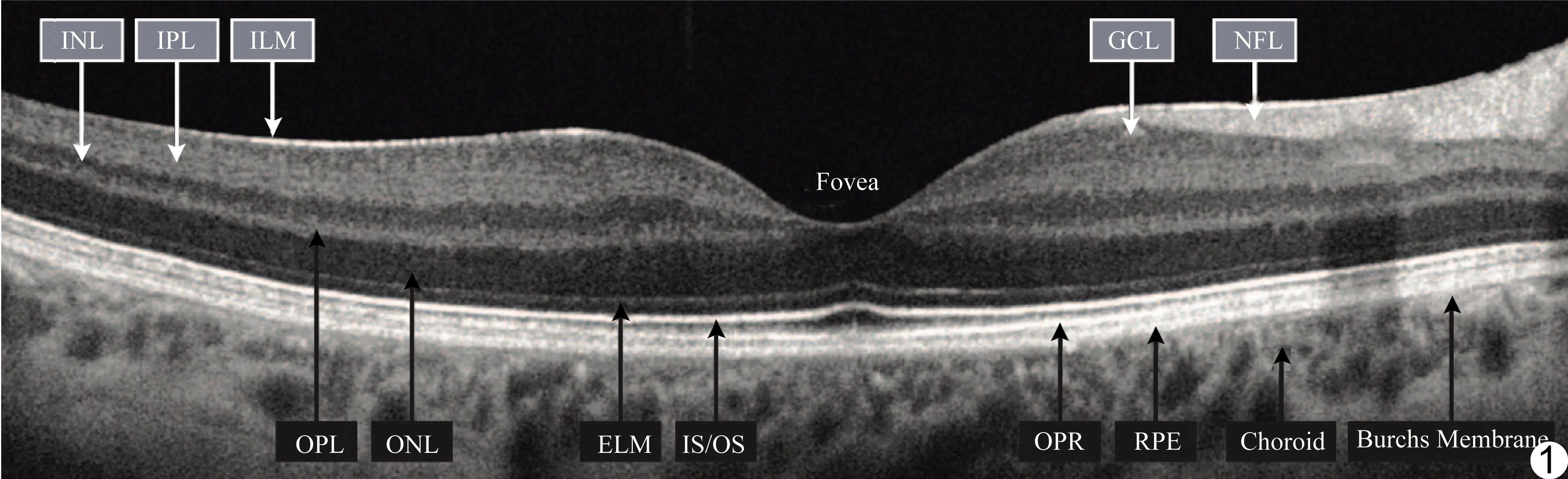
图1 视网膜黄斑区OCT INL为内核层,IPL为内部网状层,ILM为内限膜,GCL为神经节细胞层,NFL为神经纤维层,OPL为外丛状层,ONL为外核层,ELM为外部限制膜,IS/OS为内部和外部感光段的连接,RPE为视网膜色素上皮+布鲁赫膜,OPR为光感受器外节/RPE复合体,Choroid为脉络膜,Bruchs Membrane为布鲁赫膜
2 深度学习OCT辅助诊断常见眼底疾病研究进展
2.1 DL概述 DL是机器学习最重要的分支之一,通过大量训练样本而学习样本的内在规律和表示层次,具有预测、分类及分割能力。基于DL的OCT辅助诊断眼底疾病主要包括OCT预处理、OCT分割和OCT分类各环节。预处理指对OCT图像进行去噪、图像增强及形态学处理,以去除散点噪声、提高对比度,清晰显示特征区域;提取ROI,后续仅针对其进行分割或分类。OCT分割可量化图像中不同组织层的厚度及病变区域范围,帮助临床医生或辅助诊断系统根据病变类型、位置、区域及数量判断疾病严重程度。在分割基础上进行分类,通过DL技术分析OCT图像中病变区域特征与眼底疾病的关系,实现自动筛查眼底疾病,辅助眼科医师提出进一步诊疗计划及转诊建议等。
对于DL模型而言,足量训练样本非常重要。目前主要OCT开源数据集见表1,可根据不同需求适当选用。
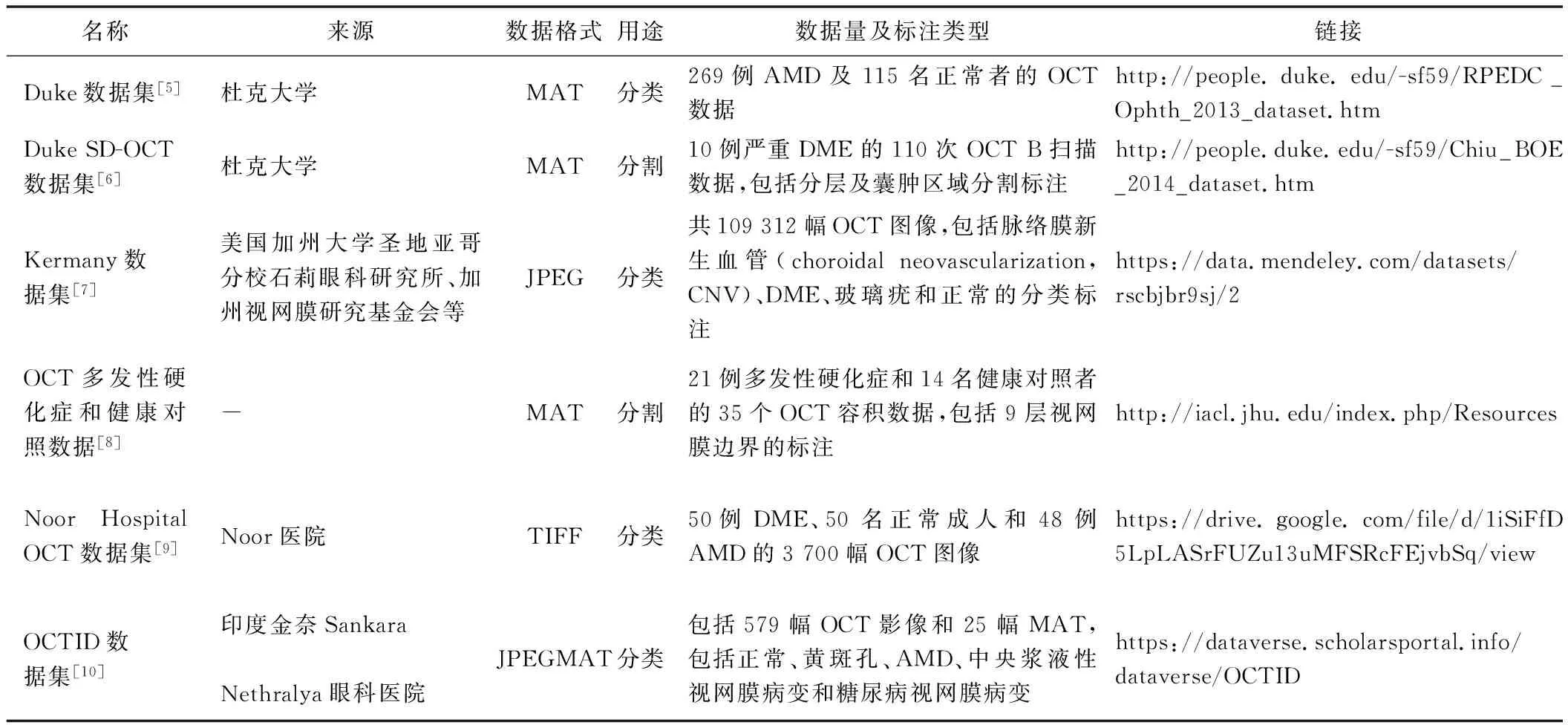
表1 现有主要可用 OCT开源数据集
2.2 基于DL的OCT辅助诊断常见眼底疾病研究进展 视网膜内液(intraretinal fluid, IRF)、视网膜下液(subretinal fluid, SRF)及色素上皮脱离(pigment epithelium detachment, PED)等是OCT诊断常见眼底疾病的重要依据。目前针对OCT的DL模型已可分割多种病变区域及对眼底病变进行分类,主要包括AMD、DME及青光眼等。
2.2.1 AMD AMD为黄斑区结构衰老性改变,分为干性AMD和湿性AMD。干性AMD表现为黄斑区存在玻璃疣等;湿性AMD表现为CNV异常生长。2018年,SEEBÖCK等[11]以正常人眼部OCT图像训练多尺度深度去噪自编码器(deep denoising autoencoder, DDAE)用于提取正常OCT图像中的特征,并训练单类支持向量机模型用于识别OCT图像中的AMD区域,根据聚类结果将OCT图像分为正常及早期、晚期AMD,预测分类准确率达81.40%,使模型可解释性趋于更好。2019年,HWANG等[12]以InceptionV3模型将583例AMD和174名正常人的35 900幅OCT图像分类为正常、干性AMD、活跃性湿性AMD及非活跃性湿性AMD,降低了任务复杂度,准确率达92.67%。ASLAM等[13]基于OCT训练前馈神经网络模型,以预测渗出性AMD患眼的视力,与实际视力相比,其均方根误差为8.20个字母,并可用于监测AMD患眼视力,有助于及时诊断和治疗ADM复发。基于DL智能诊断AMD现已达到较高精度,有待进一步研究验证并付诸临床应用。
2.2.2 DME DME是糖尿病眼部主要并发症,为四大致盲眼病之一,在OCT图像中主要表现为高反射点、视网膜内囊样积液及中心凹下脉络膜厚度改变等。2018年,PERDOMO等[14]提出端到端的OCT-NET DL模型,实现DME与正常二分类,通过网格搜索方法筛选最优的批量大小和学习率,其准确率、敏感度和特异度均达93.75%。VAHADANE等[15]提出两阶段DL网络筛查DME,第一步使用图像处理技术检测硬渗出物和积液区域的候选补丁;第二步以卷积神经网络(convolutional neural network, CNN)对候选补丁进行分类,判断是否存在DME病理特征,以筛查DME;补丁可有效提高模型的聚焦特性、降低模型规模,使其精确率达96.43%。2019年,HASSAN等[16]提出基于双模态数据的DL框架,通过CNN自彩色眼底图像和OCT图像中提取特征并加以融合,之后通过人工神经网络、支持向量机和朴素贝叶斯进行集成,以分类DME与正常,其准确率达94.33%。上述研究表明,OCT图像中DME的病变特征相对明显,对经典DL模型进行迁移即可获得较高的诊断精度。
2.2.3 青光眼 青光眼是视神经受损所致,因早期症状不明显而诊断困难,需综合考虑眼压、眼底形态、视野及视网膜神经纤维层(retinal nerve fiber layer, RNFL)等多个因素。2018年,WANG等[17]提出了分割检测联合网络(joint segmentation and diagnosis network, S-D Net),以模拟临床医师诊断青光眼:首先应用分割网络(segmentation network, S-Net)对OCT图像进行视网膜层分割,之后以诊断网络(diagnosis network, D-Net)依据RNFL厚度诊断青光眼,由于存在正常人RNFL变薄、而青光眼RNFL无变化的现象,该网络的诊断准确率为85.40%。2019年,AN等[18]基于OCT和彩色眼底图像开发了一种智能辅助诊断开角型青光眼的算法,通过OCT图像分别获取黄斑区、视盘区、RNFL和神经节细胞覆盖合体(ganglion cell complex, GCC)的厚度,结合视盘区域的彩色眼底图像,使用5个基于VGG模型的预模型,并采用随机森林算法分类青光眼与正常,其曲线下面积(area under the curve,AUC)达0.963;但该研究样本量较少,且部分患者合并近视,导致结果可能存在偏差。RAN等[19]基于谱域OCT(spectral-domain OCT, SD-OCT)数据开发一种3D DL系统,通过检测RNFL厚度自动诊断青光眼视神经病变,基于深度残差网络(deep residual network, ResNet)生成热图,显示青光眼视神经病变相关组织结构;经香港中文大学眼科中心和香港眼科医院收集的数据初步验证其诊断效能优于2D DL系统,并基于香港威尔斯亲王医院、屯门眼科中心及美国斯坦福大学拜尔斯眼科研究数据进行了外部验证,其表现良好,但仍需进一步研究评估其增量成本效益。现有多数DL模型基于RNFL及GCC厚度诊断青光眼,总体诊疗精度相对较低,结合视盘和黄斑区血管密度、黄斑全层厚度、视野及眼压等综合数据进行多模态[20-21]分析有助于准确诊断青光眼。
2.2.4 其他眼底疾病 随着技术的迅速发展,现已实现同时分割多种病灶区域或同时分类多种眼底疾病。2018年,谷歌DeepMind团队[22]提出一种两阶段DL模型,先以3D U-Net分割模型分割OCT图像中眼部15种不同组织和病变区域,再利用CNN进行诊断和转诊推荐分类,可准确检测50余种眼部疾病,且其迁移性在不同设备上均较好,准确率达94.5%,符合医师诊疗流程,适用于临床。KERMANY等[7]以Inception V3模型为基础进行迁移学习,以筛查CNV、DME和玻璃疣,并根据检测到的疾病类型提出转诊建议,分类准确率为96.60%,敏感度为97.80%,特异度为97.40%。FANG等[23]提出的病变感知CNN模型可用于分类玻璃疣、CNV、DME与正常,该模型模拟医师诊疗习惯,首先以注意力机制生成病灶检测软注意力图,并将之合并到分类模型中,根据注意力程度对局部卷积表示进行加权,分类玻璃疣、CNV、DME与正常的准确率分别为94.9%、94.5%、97.1%及97.5%。2020年,ZHANG等[24]提出BMM-Net模型分割OCT图像中的视网膜水肿、SRF和PED病变区域,以U-Net为基础,集成边界提取模块、多尺度信息感知模块,以捕捉准确位置和语义特征,解决病变区域对比度低及病灶尺寸不均衡的问题,并在AI Challenger挑战赛数据集上进行验证,平均Dice系数达82.22%,性能佳。目前基于DL的OCT图像已在分割多种病变区域及分类多种眼底疾病方面取得突出成果,且正朝向可解释、多分类及泛化方向发展。
3 小结与展望
基于DL的OCT辅助诊断眼底疾病具有广阔应用前景,但仍面临挑战:①由于隐私问题,可用于训练模型的高质量、标准化OCT图像数据仍甚匮乏;②DL模型的机制缺乏可解释性[25],这在很大程度影响辅助诊断系统用于临床实践。相信未来将会克服上述不足,获得优秀成果,推动该领域的发展。
