不同灭活条件对常见呼吸道病原体核酸检测结果的影响
2021-09-01王博文曾晓华彭凯歌武莹超黄英眉马盼盼拉姆次仁李国凯
王博文, 曾晓华, 彭凯歌, 刘 畅, 武莹超, 黄英眉,马盼盼, 拉姆次仁, 李国凯,杨 莉
(1.西藏军区疾病预防控制中心,西藏 拉萨 850000;2.西藏军区总医院感染科,西藏 拉萨 850000)
呼吸道感染是临床最常见的感染性疾病之一,发病率和病死率常年居高不下[1]。西藏地区海拔高、气压低、氧气稀薄、气温变化快,极易引起机体免疫力下降,呼吸道感染的发病率更高,患者病情更重、病程更长[2]。目前,临床上普遍采用实时荧光定量聚合酶链反应(realtime fluorescence quantitative polymerase chain reaction,qPCR)检测患者鼻拭子和咽拭子样本中的呼吸道病原体,该方法具有通量高,敏感性和特异性好的特点,对呼吸道感染的病原学诊断具有重要意义[3]。
2019年年底以来,由于严重急性呼吸综合征冠状病毒2(severe acute respiatory syndrome coronavirus 2,SARS-CoV-2)检测生物安全防护的需要,鼻拭子和咽拭子样本在进行核酸检测前需要56 ℃热处理30 min,以达到病毒灭活的目的[4-5]。但在实际操作过程中,受检测单位条件和检测人员操作的限制,灭活温度会有所波动,灭活时间也时常延长。不同灭活条件对样本呼吸道病原体核酸检测结果是否会产生影响,目前鲜见报道。本研究收集了12例腺病毒、支原体、甲型流感病毒或乙型流感病毒检测阳性患者的鼻拭子和咽拭子样本,设计不同的灭活条件,对比灭活前后qPCR的检测结果,为确保呼吸道病原核酸检测结果的准确性提供依据。
1 材料和方法
1.1 研究对象
收集2020年1月—2021年3月就诊于西藏军区总医院腺病毒、支原体、甲型流感病毒或乙型流感病毒核酸检测阳性患者的鼻拭子和咽拭子样本各3份,共计12份。
1.2 仪器与试剂
TaKaRaMiniBEST Viral RNA/DNA Extraction Kit[宝日医生物技术(北京)有限公司],腺病毒、支原体、甲型流感病毒和乙型流感病毒核酸检测试剂盒(北京金豪制药股份有限公司),病毒采样管(北京友康生物公司),Rotor Gene Q实时荧光定量PCR仪(德国Qiagen公司),恒温水槽(常州澳华仪器有限公司)。
1.3 方法
1.3.1 样本采集 (1)咽拭子样本。用聚丙烯纤维头塑料杆拭子擦拭患者双侧咽扁桃体及咽后壁,然后将拭子头浸入病毒采样管的采样液中,尾部弃去,旋紧采样管螺旋口。(2)鼻拭子样本。将聚丙烯纤维头塑料杆拭子轻轻插入患者鼻道内鼻腭处,停留片刻后缓慢转动退出,然后将拭子头浸入同一病毒采样管的采样液中,弃去尾部,旋紧采样管螺旋口。
1.3.2 样本灭活温度梯度和时间梯度设置 将鼻拭子和咽拭子样本置于恒温水槽中,分别于56、66、76和86 ℃热处理30 min;于56 ℃分别处理30、60、120、240、480和960 min。处理完毕后进行样本核酸提取。
1.3.3 核酸提取和病原体检测 采用TaKaRa MiniBEST Viral RNA/DNA Extraction Kit提取核酸,按照说明书要求进行操作,每个样本提取需要200 μL采样液。采用腺病毒、支原体、甲型流感病毒和乙型流感病毒核酸检测试剂盒在Rotor Gene Q实时荧光定量PCR仪上进行qPCR检测,按照说明书要求进行操作,阳性判读标准参考各试剂盒说明书,所有检测均重复3次,取平均循环阈值(cycling threshold,Ct)。
1.4 统计学方法
采用SPSS 21.0软件进行统计学分析,每组样本的Ct值用±s表示。未灭活和不同灭活条件处理样本之间Ct值的比较采用Dunnett-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 患者基本信息
患者的性别、年龄、病原学诊断、核酸类型和Ct值见表1。

表1 患者基本信息
2.2 不同灭活温度对样本qPCR检测结果的影响
对于腺病毒和支原体,56 ℃和66 ℃灭活3 0 m i n 与未灭活相比,C t 值无明显变化(P>0.05),76 ℃和86 ℃灭活30 min可引起样本Ct值显著升高(P<0.05、P<0.01);甲型流感病毒和乙型流感病毒,56 ℃灭活30 min与未灭活相比,Ct值无明显改变(P>0.05),66 ℃、76 ℃和86 ℃灭活30 min会导致样本Ct值升高(P<0.05、P<0.01)。见图1。
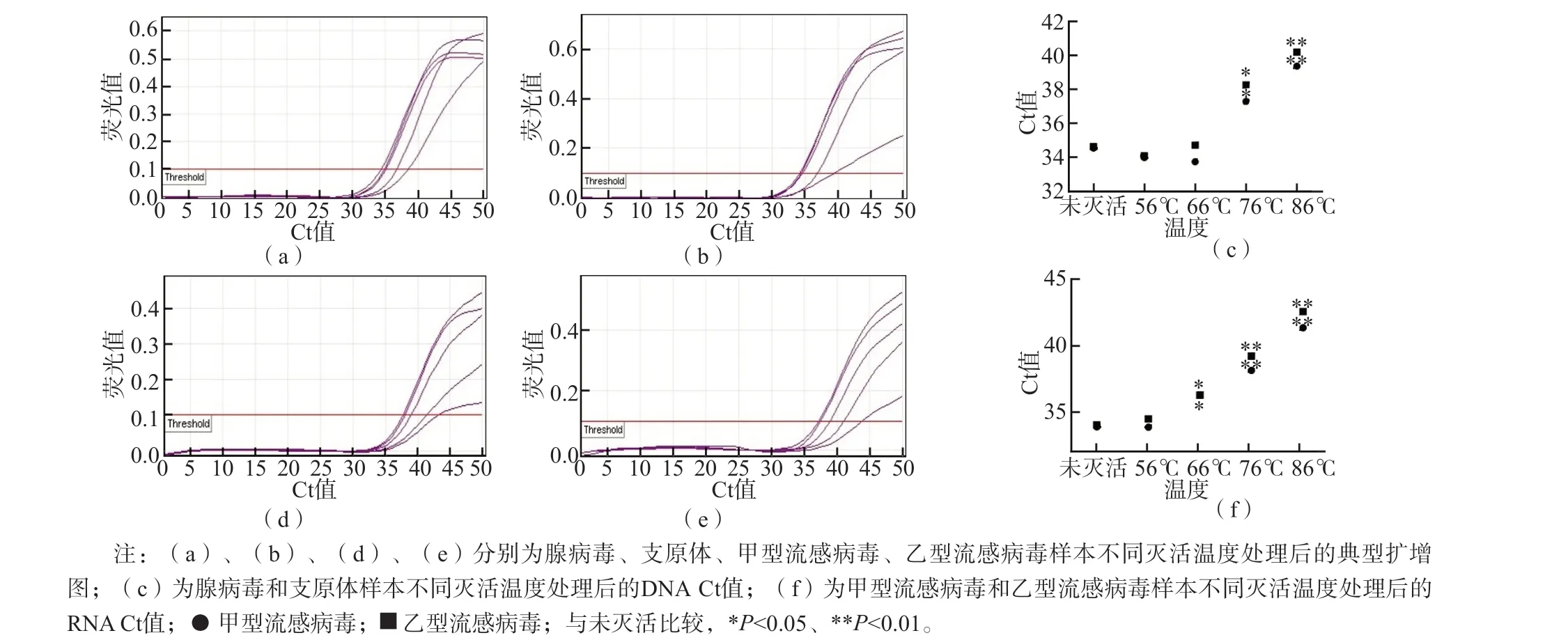
图1 不同灭活温度对样本qPCR检测结果的影响
2.3 不同灭活时间对样本qPCR检测结果的影响
对于腺病毒和支原体,56 ℃灭活30、60、120和240 min与未灭活相比,Ct值无明显变化(P>0.05);灭活480和960 min可引起样本Ct值显著上升(P<0.01、P<0.001)。对于甲型流感病毒和乙型流感病毒,56 ℃灭活30、60和120 min与未灭活相比,Ct值无明显改变(P>0.05);灭活240、480和960 min会导致样本Ct值增大(P<0.05、P<0.01、P<0.001)。见图2。

图2 不同灭活时间对样本qPCR检测结果的影响
3 讨论
西藏自治区平均海拔超过4 000 m,年平均气温8 ℃,氧含量低,对人体免疫系统损伤大,极易引起呼吸道感染[6-7]。80%以上的高原呼吸道疾病是由非细菌性病原体引起的,其中腺病毒、肺炎支原体、呼吸道合胞病毒、甲型流感病毒和乙型流感病毒最为常见[8]。qPCR检测已成为呼吸道病原学诊断的主流方法,该方法简便易行、灵敏度高、特异性强。随着新型冠状病毒肺炎(corona virus disease 2019,COVID-19)疫情的出现,为了最大程度保护实验室人员,COVID-19诊疗方案明确指出,SARS-CoV-2样本检测前一定要经过灭活处理,推荐灭活方式为56 ℃热处理30 min[9]。然而不同的病原体对热灭活的敏感性相差很大:对于严重急性呼吸综合征冠状病毒,56 ℃热处理30 min可以使其核酸降解,并低于检测限[10];而SARS-CoV-2 56 ℃热处理30 min只能将病毒灭活,不会影响核酸检测结果[11];同样,该灭活操作将会导致猪流行性腹泻病毒——冠状病毒RNA的明显降解[12]。但是目前尚未见热灭活处理对常见呼吸道病原体检测结果的影响的相关研究。此外,西藏自治区检测单位条件相对落后,一些实验室样本加热设备温控系统不稳定,实际温度可能比预设温度高几十度;一些实验人员操作不规范,随意延长样本灭活时间,甚至过夜灭活。这些问题都可能对实验结果造成巨大影响。
本研究发现,DNA病原体和RNA病原体对热的敏感性不尽相同,相同灭活时长,腺病毒和支原体核酸可以抵御66 ℃热灭活,而甲型流感病毒和乙型流感病毒在66 ℃就会出现不同程度的核酸降解;同样的灭活温度下,腺病毒和支原体核酸可以承受240 min加热,而甲型流感病毒和乙型流感病毒核酸只能在120 min内维持稳定;这可能是不同核酸类型结构稳定性不同决定的[13]。尤其是对于核酸含量较低的弱阳性样本,提高灭活温度和延长灭活时间可能会造成样本Ct值的明显变化,甚至可能导致样本核酸检测假阳性结果。本研究未收集到病毒载量很低的弱阳性样本,没有展示出灭活条件改变对弱阳性样本检测结果的影响,我们会在下一步研究中进行深入探讨。
综上所述,为保证qPCR检测的敏感性,避免呼吸道病原体的漏检、误检,建议对于鼻拭子和咽拭子样本进行灭活处理时,温度应控制在56 ℃左右,灭活时间应控制在120 min以内。各临床实验室应结合自身实际情况,尽可能优化操作步骤,严格操作流程,确保检测过程安全、规范,检测结果稳定、可靠。
