禽白血病病毒p27基因在毕赤酵母中的表达
2021-08-31曹利利宫鹏涛郭衍冰宋建臣姚新华苑淑贤
曹利利,宫鹏涛,姜 旭,,郭衍冰,宋建臣,董 航,姚新华,苑淑贤,王 治
(1.吉林省畜牧兽医科学研究院,长春 130062;2.吉林大学动物医学学院,长春 130062;3.延边大学农学院,延边 133000;4.北部战区疾病预防控制中心,济南 250014)
禽白血病(avian leukosis)是指由反转录病毒科禽α反转录病毒属的禽白血病病毒(Avian leukosis virus,ALV)引起的,以造血细胞增生为主的一类肿瘤性疾病[1]。ALV作为我国二类动物疫病,能够诱发禽类的多种肿瘤性疾病,致使生产性能下降,甚至死亡。自1908年首次分离该病毒以来,ALV呈全球流行,严重制约了世界各国的禽业发展[2]。ALV作为国家中长期动物疫病防治规划(2012~2020年)中优先防治的病原[3],目前只能依靠病原检测为手段淘汰阳性鸡,进而达到净化的目的[4]。因此,精准诊断对于有效防控ALV至关重要[5]。
ALV基因组中主要包括gag、pol、env基因,在不同亚群间,gag编码的p27蛋白十分保守且同源性达96%以上[6],含有许多可以用于检测的抗原表位[7]。以往研究常借助原核系统表达p27蛋白用于ALV检测方法的建立。研究表明,酵母方法和大肠杆菌表达相比,有细胞繁殖快,培养与试验方法简单,适用于工业生产等优势[8],且因毕赤酵母表达外源蛋白的高效性,研究者们已经实现多种外源蛋白的高效表达[9-10]。而目前国内外尚无毕赤酵母表达ALV p27蛋白的相关报道。利用毕赤酵母表达外源蛋白的高稳定、高表达、高分泌、高密度生长的特性,本研究对禽白血病的种间特异性抗原p27蛋白进行表达,获得的表达产物为制备包被抗原,建立禽白血病病毒ELISA检测方法或组装试剂盒奠定基础。
1 材料与方法
1.1 毒株与细胞DF1、细胞禽白血病标准毒株HRPS-103[11]由本实验室保存;巴斯德毕赤酵母GS115购自Invitrogen公司。
1.2 载体与工具酶表达载体pPIC9K购自Invitrogen公司;pMD18-T载体、dNTP、Taq DNA聚合酶、EcoRⅠ、NotⅠ、T4 DNA连接酶等均购自TaKaRa公司。
1.3 主要试剂与试剂盒病毒基因组RNA提取试剂盒、DL2000 DNA marker、PCR反应试剂、pre-stained protein marker购自天根生化科技有限公司;通用型RT-PCR试剂盒购自北京鼎国昌盛生物技术有限责任公司;Biospin胶回收试剂盒购自BioFlux公司;Plasmid Miniprep Purification Kit Ⅱ 购自捷恩麥克生物科技有限公司;ALV检测试剂盒购自IDEXX公司;Ni-Agarose His标签蛋白纯化试剂盒(可溶性蛋白)购自康为世纪生物科技有限公司。
1.4 p27基因的克隆
1.4.1 引物合成 查找已发表的AIV全基因序列中p27的基因序列(GenBank登录号:Z46390.1),利用Primer Premier 5.0软件设计一对特异性引物,且两端分别含有EcoRⅠ与NotⅠ酶切位点。p27-F:GA CGAATTCATGAAGACAGAGGGACCCGCCTG,p27-R:AGGCGGCCGCTTAATGATGATGATGAT GATGCTACGCGGCTATGCCTTGATCCG。
1.4.2 cDNA合成 按照病毒RNA提取试剂盒的操作说明提取ALV HRPS-103的RNA,以禽白血病总RNA为模板,反转录后得到cDNA,于-20℃保存。
1.4.3 p27基因的扩增 以ALV cDNA为模板扩增p27基因。反应体系为:cDNA 2 µL,引物p27-F/R各1 µL, ddH2O 10 µL,2×Taq PCR Master Mix 4 µL。反应条件为:95℃预变性5 min;95℃变性30 s,65℃退火30 s,72℃延伸50 s,35个循环;72℃延伸10 min。以1%琼脂糖凝胶电泳对扩增的目的片段进行初步判断。
1.4.4 pMD18-T-p27的构建 对含有p27基因片段进行胶回收,与pMD18-T载体相连接后转化至DH5α感受态细胞中,随后提取重组质粒进行测序鉴定。
1.5 酵母表达质粒的构建将pPIC9K载体与构建的质粒pMD18-T-p27分别进行双酶切,回收目的片段,在4℃条件下通过T4 DNA Ligase连接酶连接过夜。取酵母感受态细胞80 µL同10 µL构建的质粒pPIC9K-p27轻混后进行电转,随后取电转产物100 µL均匀涂布于含有Zeocin的YPDS培养基中,在30℃条件下培养3~5 d后,挑取单菌落接种于5 mL液体YPDS培养基中,在28~30℃、250 rpm条件下振荡过夜,随后提取菌液基因组以PCR进行鉴定。
1.6 p27蛋白的诱导表达将重组菌培养至OD600值为2~6时,于1000 ×g条件下离心5 min后收集菌体,以BMMY重悬至OD600值为1.0,持续培养120 h,期间每隔24 h取样1 mL并加入甲醇用于诱导目的蛋白的表达,取出的菌液以4000×g离心8 min,收集上清液。
定义10 称fti+v/ti+v-1′(A′(ti+v)/A′(ti+v-1))为变换φi下,马尔可夫过程{ξ(t),t∈T},(t1
1.7 SDS-PAGE鉴定将处理后的样品加入SDSPAGE凝胶孔中,浓缩胶部分以80 V条件电泳,分离胶部分以120 V条件电泳。电泳结束后将凝胶置于考马斯亮蓝R-250中缓缓摇动染色4 h,而后在脱色液中脱色至凝胶条带清晰。
1.8 Western blot鉴定切割SDS-PAGE电泳后凝胶至适当大小,同时裁剪一张略大于胶的PVDF膜并以甲醇激活,滤纸提前在转膜液中浸泡,按照阴极、滤纸、胶、PVDF膜、滤纸、阳极的顺序放置,排除中间气泡后,110 V条件下湿转30 min;取出膜在封闭液中封闭2 h后,加入ALV阳性血清作为一抗,4℃孵育过夜;TBST洗膜3次,每次5 min,加入1∶5000稀释的HRP兔抗鸡IgY作为二抗,于37℃摇动孵育1 h后TBST洗膜3次,每次5 min;在膜上滴适量DAB显色后拍照保存。
1.9 p27蛋白表达条件的优化以单菌落接种YPD液体培养基,30℃条件下220 rpm振荡培养24 h。取100 µL重组菌液接入50 mL BMGY中,每隔5 h取样一次测定OD600值,记录并绘制生长曲线。各条件的优化方法如下:
(1)目的蛋白表达量检测:取5 mL菌液,离心收集上清液,按照Ni-Agarose His标签蛋白纯化试剂盒进行纯化。经DHS NanoPro 2010/2020超微量紫外可见分光光度计测定蛋白表达量。(2)诱导时间:重组菌共诱导表达120 h,每隔24 h取样1次,检测目的蛋白表达量。(3)甲醇诱导浓度:每隔24 h向培养基中添加1次甲醇,使甲醇终浓度分别为1.5%、1.25%、1%、0.75%、0.5%、0.25%,在培养72 h后检测目的蛋白表达量。(4)pH值:以PBS缓冲液调节培养基的pH值分别为8.0、7.5、7.0、6.5、6.0、5.5、5.0,在其他诱导条件相同的情况下检测目的蛋白表达量。(5)诱导温度:调节培养基温度分别为30℃、28℃、26℃、24℃,在其他诱导条件相同的情况下检测目的蛋白表达量。
2 结果
2.1 PCR扩增结果对PCR产物进行凝胶电泳分析,如图1所示,在760 bp处有条带显示,且大小与预期一致。
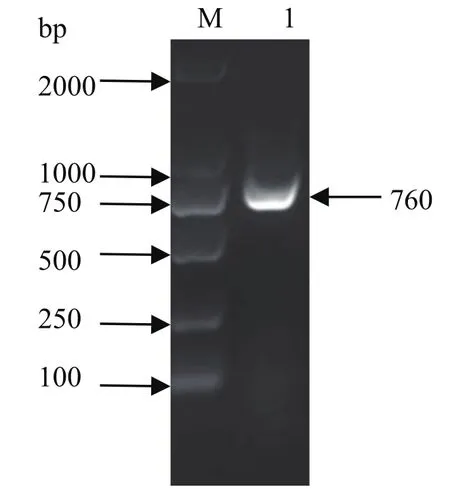
图1 p27基因PCR扩增Fig.1 PCR amplification of p27 gene
2.2 pMD18-T-p27的酶切鉴定将pMD18-T与目的基因p27连接成功后提取质粒,以限制性内切酶(EcoRⅠ和NotⅠ)进行双酶切,如图2所示,在760 bp处有条带显示且与预期大小一致。

图2 pMD-p27的双酶切产物Fig.2 pMD-p27 double digestion results
2.3 测序结果分析将测序结果在NCBI中进行BLAST比对,结果显示重组质粒中目的片段大小为717 bp,与已公布的AIV基因序列(GenBank登录号:Z46390.1)相比同源性为100%。
2.4 酵母表达株的鉴定将构建的重组质粒pPIC9K-p27双酶切后进行电泳,结果如图3所示,在760 bp处有条带显示,与预期大小一致。说明成功构建pPIC9K-p27。

图3 重组酵母株pPIC9K-p27的鉴定结果Fig.3 Identification of the recombinant yeast strain pPIC9K-p27

图4 PCR鉴定结果Fig.4 PCR identification results
2.6 p27蛋白的鉴定
2.6.1 SDS-PAGE结果 SDS-PAGE凝胶结果如图5所示,约30 kDa处有条带显示,且与p27蛋白预期大小相符,并将表达的重组蛋白命名为rp27。
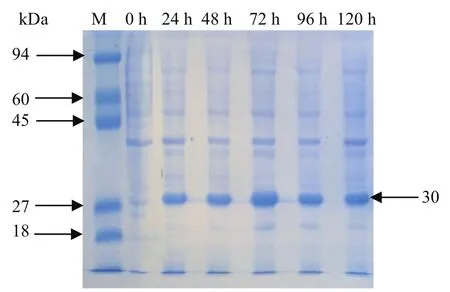
图5 重组蛋白rp27的SDS-PAGE结果Fig.5 SDS-PAGE results of rp27 protein
2.6.2 Western blot结果 Western blot显色结果如图6所示,约30 kDa处有条带显示,与预期相符,说明表达的重组蛋白p27具有良好的反应原性。
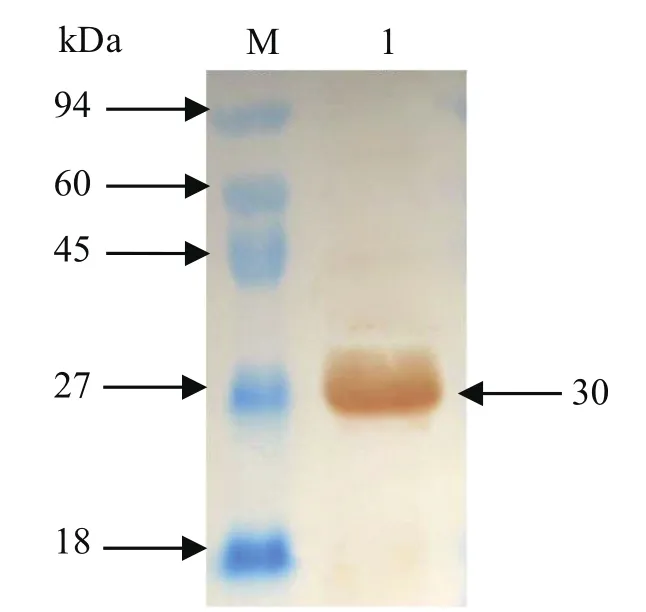
图6 重组蛋白rp27的Western blot结果Fig.6 Western blot results of rp27 protein
2.7 表达条件的优化
2.7.1 重组菌生长曲线 持续观察酵母的培养及生长情况,如图7所示,10 h后酵母菌进入对数生长期,培养至30 h期间OD600呈逐渐上升趋势,随后重组菌生长速度减缓。
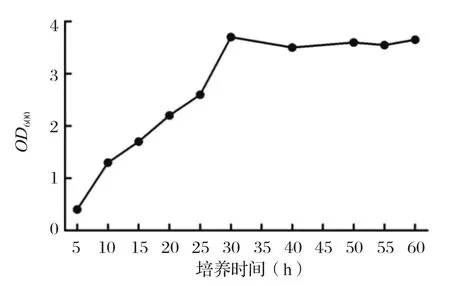
图7 重组菌体的生长曲线Fig.7 Growth curve of recombinant bacteria
2.7.2 诱导时间的优化结果 如图8A所示,随着诱导时间的逐步延长,蛋白表达呈快速上升趋势,直至72 h时表达量最大,随后继续诱导重组蛋白rp27产量则略有下降。
2.7.3 甲醇浓度的优化结果 如图8B所示,当甲醇浓度为1.0%时p27蛋白表达量最大,而浓度或高或低时重组蛋白rp27产量都会减少。
2.7.4 pH值的优化结果 如图8C所示,以不同pH条件培养重组菌,rp27蛋白的表达量有所不同,当培养液pH值为7.0时rp27表达量最大。
2.7.5 诱导温度的优化结果 如图8D所示,重组菌在不同温度诱导条件下,当温度为28℃时rp27蛋白的表达量最高。
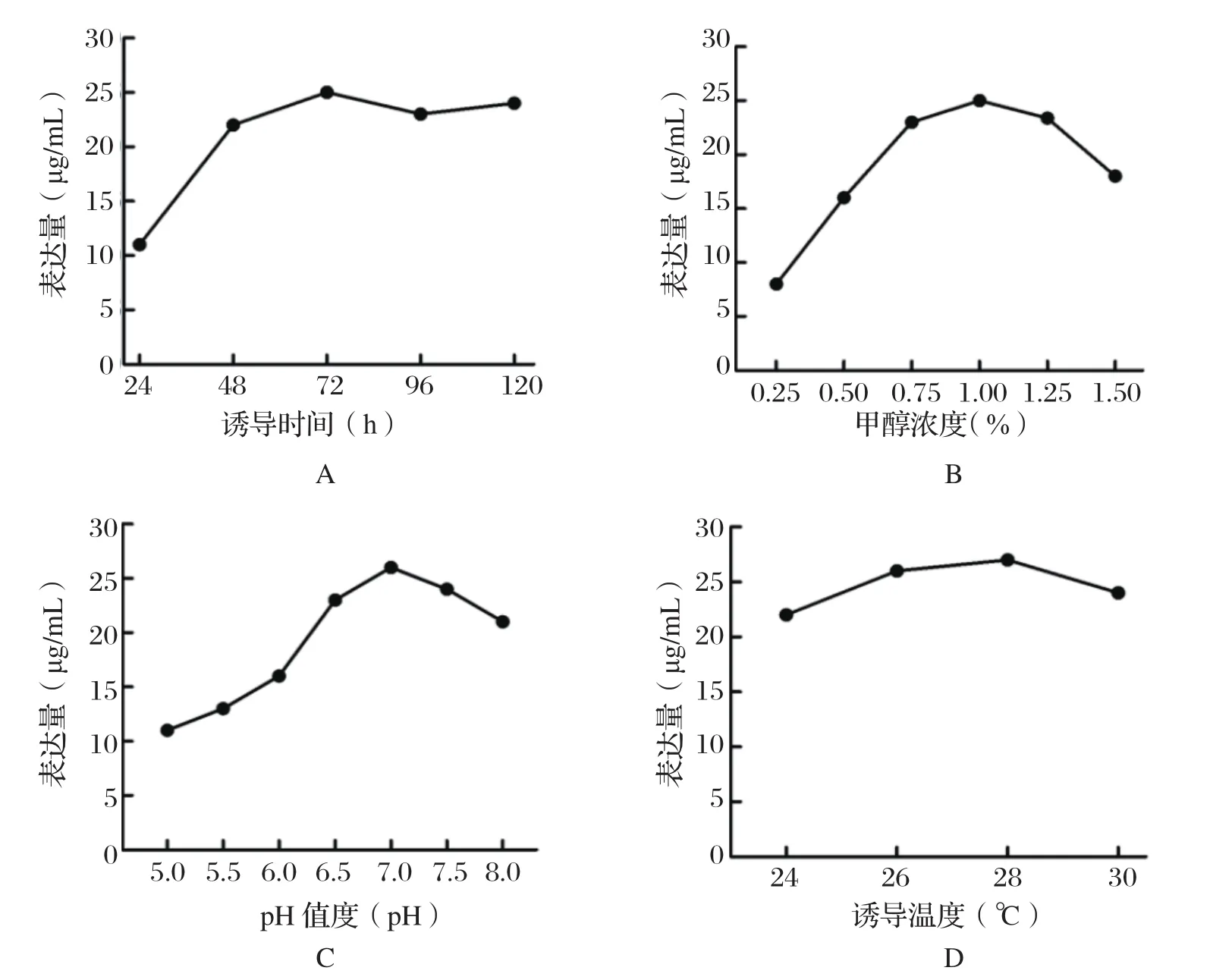
图8 诱导条件的优化Fig.8 Optimization of induction conditions
3 讨论
检测p27已成为国内外种群净化ALV的常用方法之一,本实验室通过构建目的重组质粒,经诱导以酵母分泌表达,首次在国内通过毕赤酵母系统制备了高纯度的p27蛋白。对于ALV的诊断国外已有商品化试剂盒,国内也有利用大肠杆菌表达p27蛋白及建立检测方法等研究,但仍存在价格昂贵,分离提取p27蛋白的产量少,成本较高,生物学活性较低等问题。周晨妍等[12-14]分别将木聚糖酶 Xyn43A和 抗病毒蛋白RC28在大肠杆菌及毕赤酵母中的表达进行比较,结果表明毕赤酵母表达较优,且相比于大肠杆菌系统可有效克服蛋白翻译后加工以及修饰不够的难题。毛娅卿等[12]通过原核诱导表达p27蛋白约为27 kDa,而本实验所表达的P27蛋白约为30 kDa,分析其原因,推测可能是与毕赤酵母系统表达过程中对蛋白进行了翻译修饰有关,这一推测与胡青松等[16]的实验结果相一致。为了保证了重组蛋白与天然p27蛋白结构和功能的相似,本研究选择酵母分泌表达目的蛋白,为研究p27衣壳蛋白的生物学功能,以及与宿主相互作用等提供基础。
以往研究表明,毕赤酵母表达体系相较于其他原核或真核表达系统,不仅能够提高重组蛋白的生物学活性,还具有对培养环境要求简单、成本低等优势[17]。但它也存在一定不足,如分泌表达的蛋白可被自身分泌的蛋白酶降解,有些蛋白表达量较低或者发生过度糖基化等,但可以通过其他技术手段尽量扬长避短。在毕赤酵母生长与诱导过程中,时间、pH、温度、甲醇浓度等都会影响到p27蛋白的表达[18],选择最适合的反应条件能有效的提升蛋白的表达量[19-20]。实验中通过不断优化各种反应条件,确保能够获得高表达的p27蛋白,相比以往的大肠杆菌表达系统,毕赤酵母表达体系生长周期短且提纯过程技术简单成熟,加之发酵生产中安全性较高,更适于工业化规模生产,为下一步诊断试剂盒的商品化生产与应用奠定了良好的基础。
